磁性松香基高分子固定化交联脂肪酶聚集体的制备及性质研究
卢建芳,黎克纯,雷福厚,周菊英
(1.广西民族大学 化学化工学院,南宁 530006; 2.广西林产化学与工程重点实验室,南宁 530006)
脂肪酶是一类重要的酰基水解酶,常被用来催化酯的合成、水解、醇解及酯交换等反应。由于脂肪酶较高的活性、稳定性、区域和立体选择性,被广泛应用于洗涤剂、油脂、皮革、纺织、有机合成和制药行业等多个领域[1-3]。但是游离脂肪酶的可操作性和稳定性较差,限制了其应用。当脂肪酶暴露在高温或有机溶剂中,会发生变性引发活性损失[4]。此外,由于高成本,难以回收和再利用以及污染产品等缺陷使得可溶性酶在工业过程中的广泛应用受到限制。因此,必须寻找一种有效的酶处理方法[5],提高其操作稳定性,且易于分离回收。目前,固定化方法基本分为两种类型:载体和无载体[6]。无载体最新技术——交联脂肪酶聚集体(CLEAs)是利用蛋白沉淀剂,将溶解状态的酶进行物理沉淀得到酶聚集体,随后利用交联剂与酶聚集体分子上的氨基发生Schiff碱反应,生成不溶水的交联脂肪酶聚集体。载体固定化是利用载体固定化技术即采用吸附、包埋、共价结合等方法将酶固定在载体上。两种方法各有优缺点。有载体的固定化酶不可避免地导致酶催化活性的稀释[7],而无载体酶具有较高单位酶活性[8],避免粗酶的进一步纯化。但CLEAs具有一些缺点:机械稳定性低,酶分子泄漏和难以恢复。将CLEAs与载体固定化相结合不仅可以提高CLEAs的机械强度而且可以根据实际需要设计不同类型的固定化酶。王冬伟等[9]将木聚糖酶聚集体固定到LKZ-128氨基型树脂上,酶活达到190 U/g,操作稳定性、热稳定性和pH稳定性均得到提高。Gao等[10]制备了介孔氧化硅固载化脂肪酶交联脂肪酶聚集体(CLL@MPS),应用于水解、酯化和转酯反应时,CLL@MPS展现出良好的稳定性和重复使用性。Zeinali等[11]将剑豆脲酶交联聚集体包埋在聚丙烯酰胺凝胶中,考察了酶活最佳条件,显示此方法可明显提高脲酶的储存稳定性和操作稳定性。
松香含有共轭二烯结构和羧酸基团,有利于形成机械强度高、耐热性良好的功能高分子,可以结合多种生物分子。磁性具有良好的磁导向性,且通过外加磁场快速进行分离和回收。本研究将CLEAs和载体固定化方法相结合,制备固定化交联脂肪酶聚集体(CLEAs-L)。首先,通过沉淀制备脂肪酶聚集体,然后用戊二醛交联。其次,将含有—NH2的磁性松香基高分子作为载体固定CLEAs,最终得到固定化CLEAs-L。此外,研究了固定化CLEAs-L的最佳制备条件,表面和微孔结构,活性和稳定性,以期该技术获得更好的催化性能。
1 材料与方法
1.1 实验材料
脂肪酶(BR),酚酞(Ind),橄榄油(CP),聚乙烯醇(CP,相对分子质量为1 750±50),戊二醛(CP),二氯亚砜(CP),氢氧化钠、无水乙醇、十二水合磷酸二钠、磷酸二氢钾、1,4-二氧六环、甲基丙烯酸、丙烯酸、过氧化二苯甲酰,均为分析纯。马来松香丙烯酸乙二醇酯,广西林产化学与工程重点实验室提供。
SYC-15超级恒温水浴锅;Scientz-10N冷冻干燥机;ZJ-2B磁天平;SUPRA 55 Sapphire场发射扫描电子显微镜,德国卡尔蔡司(CARL ZEISS)公司。
1.2 实验方法
1.2.1 磁性松香基高分子的制备[12]
取4.2 g甲基丙烯酸、1.8 g丙烯酸和20.0 g马来松香丙烯酸乙二醇酯,溶于50 mL乙酸乙酯后,再加入0.06 g过氧化二苯甲酰,超声20 min后再加入3.2 g FeCl3·6H2O、1.4 g FeCl2·4H2O及100 mL蒸馏水,继续超声30 min,然后400 r/min搅拌,缓慢加热至80℃,迅速加入25 mL 质量分数25%的氨水,保温6 h。通过外加磁场分离出磁性高分子,并用无水乙醇和去离子水各30mL洗涤5次,得到磁性松香基固体。
取5 g磁性松香基固体加入5 mL吡啶中,冰浴条件下缓慢滴加15 mL二氯亚砜,反应4 h后减压抽滤。再向其中加入溶有5 mL乙二胺的10 mL 1,4-二氧六环的溶液。常温条件下,磁力搅拌反应2 h,在外加磁场的作用下固液分离并用蒸馏水反复洗涤,得到磁性松香基高分子。
1.2.2 脂肪酶聚集体的制备
将0.4 g脂肪酶溶于pH 7.5的磷酸盐缓冲溶液中,0℃下磁力搅拌1 h。-10℃、8 000 r/min离心10 min取上层清液,冰浴下加入一定量的沉淀剂(无水乙醇),反应0.5 h,8 000 r/min离心10 min,得脂肪酶聚集体。取脂肪酶聚集体,冷冻干燥,测定其活性,确定聚集条件。
1.2.3 交联脂肪酶聚集体的制备
取25 mL脂肪酶聚集体悬浮液(将0.4 g脂肪酶制得的酶聚集体放入25 mL磷酸盐缓冲溶液中超声分散)置于冰浴中,缓慢滴加一定量戊二醛溶液,轻微搅拌,交联反应一段时间,6 000 r/min离心10 min,弃去上清液,用pH 7.5的磷酸盐缓冲液反复洗涤沉淀。得到交联脂肪酶聚集体,测定酶活力,确定交联条件。
1.2.4 磁性松香基高分子载体固定交联脂肪酶聚集体的制备
将0.5 g磁性松香基高分子载体和0.2 g交联脂肪酶聚集体放入20 mL pH 7.5的磷酸盐缓冲溶液中,加一定量戊二醛。冰浴中交联反应1 h。外加磁场分离固体,冷冻干燥,测定固定化CLEAs-L活力,确定二次交联条件。
1.2.5 固定化脂肪酶的制备
0.4 g脂肪酶溶解在100 mL pH 7.5的磷酸盐缓冲溶液中,磁力搅拌1 h,冷冻离心取上层清液,加入如1.2.4相同量的磁性松香基高分子载体,添加1%戊二醛,冰浴交联反应1 h。外加磁场分离固体,冷冻干燥,即得固定化脂肪酶。
1.2.6 脂肪酶活性的测定[13]
游离脂肪酶和固定化酶的活性均采用橄榄油乳化法,即1 min催化产生1 μmol脂肪酸所需的酶量定义为1个活力单位。
固定化酶的酶活回收率=固定化酶的酶活/加入酶液的酶活×100%
固定化酶的相对活性=每组中所测酶活性值/该组中最高酶活性值×100%
1.2.7 SEM的测定
将脂肪酶聚集体、交联脂肪酶聚集体、载体、固定化脂肪酶、固定化CLEAs-L粘在导电胶上,进行喷金,然后用场发射扫描电子显微镜观察材料的表面形态。
1.2.8 粒径分布的测定
分别以粒径700~1 400 μm、1 400~2 800 μm、2 800~4 200 μm和4 200~5 600 μm 4个级别对固定化CLEAs-L进行筛分,以筛分后的700~5 600 μm固定化CLEAs-L的总质量为基础,计算不同粒径范围内的固定化CLEAs-L的质量占比。
1.2.9 酶负载量的测定
采用元素分析仪测定固定化脂肪酶和固定化CLEAs-L的氮含量,按下式计算固定化脂肪酶和固定化CLEAs-L的酶负载量。
(L+M)×N1=M×N2+L×N3
式中:L为载体的质量,g;M为磁性松香基载体酶负载量,mg/g;N1为固定化脂肪酶或固定化CLEAs-L的氮含量,%;N2为游离脂肪酶的氮含量,即2.065%;N3为载体氮含量,0.055%。
2 结果与分析
2.1 固定化CLEAs-L制备条件的研究
2.1.1 聚集条件的确定
2.1.1.1 沉淀剂无水乙醇用量对脂肪酶聚集体活力的影响
沉淀剂通过破坏蛋白分子表面带电状态使蛋白质聚集沉淀,这一过程会造成酶的空间结构发生变形,酶分子的活性中心遭到破坏,酶活力下降[14]。高浓度的沉淀剂能使酶蛋白快速从溶液中聚集并沉降下来,有助于酶活性中心结构的维持;而浓度越低,聚集沉淀的速度越慢,对酶活性中心的损害就越大。与此同时,沉淀剂浓度过高,也会造成酶空间结构变形,酶活中心受损,致使酶完全或部分失活。在脂肪酶质量浓度2 g/L的条件下,无水乙醇用量对脂肪酶聚集体活力的影响见图1。
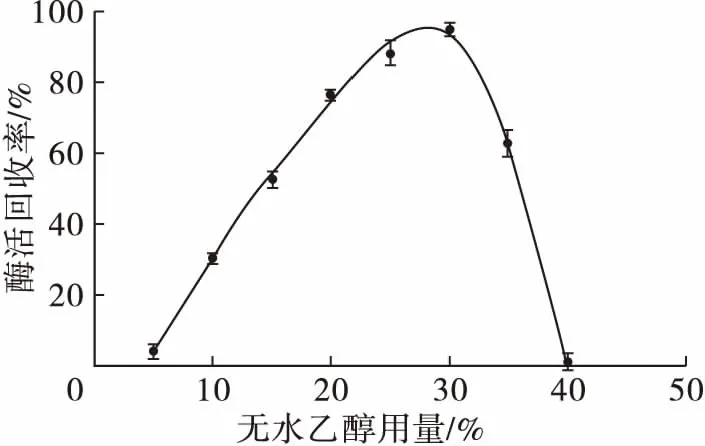
图1 无水乙醇用量对脂肪酶聚集体活力的影响
由图1可知,随着无水乙醇用量的增加,脂肪酶聚集体的活力也增加,当无水乙醇用量超过30%后,酶活力反而下降。当无水乙醇用量为30%时,脂肪酶聚集体的活力最大。
2.1.1.2 脂肪酶质量浓度对脂肪酶聚集体活力的影响
沉淀剂无水乙醇用量为30%,加入不同质量浓度的脂肪酶,其聚集体活力的变化见图2。
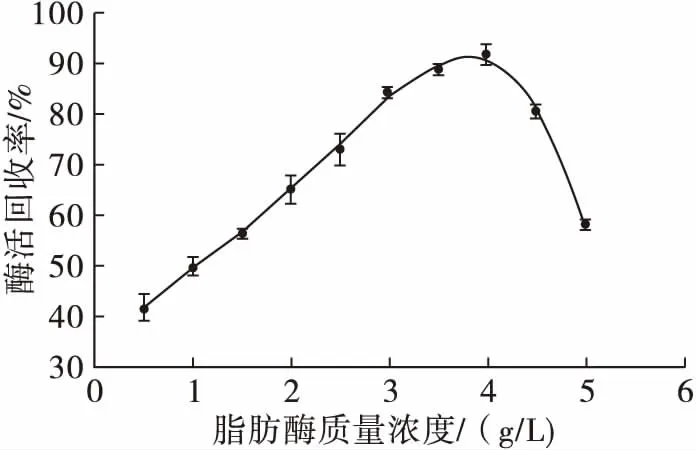
图2 脂肪酶质量浓度对脂肪酶聚集体活力的影响
由图2可知,当沉淀剂用量一定时,脂肪酶质量浓度过大,酶分子不能完全沉集,脂肪酶聚集体活力低,脂肪酶的质量浓度低,沉淀剂会造成酶的三维空间结构发生变形,活性中心会遭到破坏,酶活力下降。因此,当脂肪酶质量浓度为4 g/L时,所得脂肪酶聚集体活力最大。
2.1.2 交联条件的确定
2.1.2.1 戊二醛用量对交联脂肪酶聚集体(CLEAs-L)活力的影响
在交联时间2 h条件下,交联剂戊二醛用量对交联脂肪酶聚集体活力的影响见图3。
戊二醛既是酶交联剂,同时也是蛋白质变性剂。低浓度的戊二醛对酶聚集体交联不完全或不牢固,易发生酶泄漏,而高浓度的戊二醛,有更多的机会进攻酶的活性位点,导致酶失活的概率增大。由图3可知,当加入的戊二醛用量为0.3%时,酶活回收率最大。
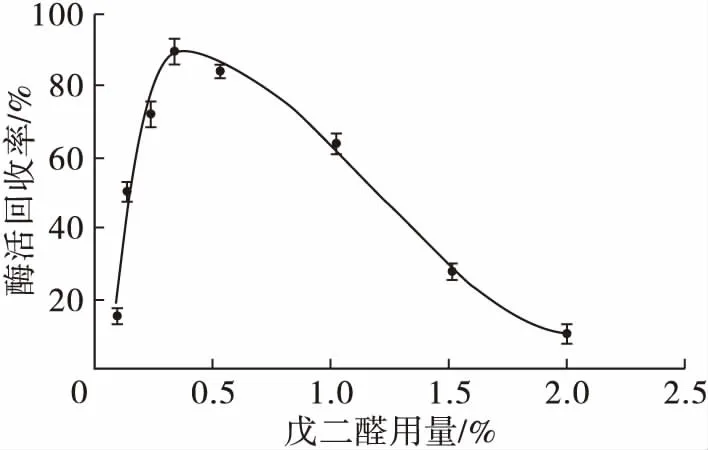
图3 戊二醛用量对交联脂肪酶聚集体活力的影响
2.1.2.2 交联时间对交联脂肪酶聚集体活力的影响
在戊二醛用量0.3%条件下,交联时间对交联脂肪酶聚集体活力的影响见图4。
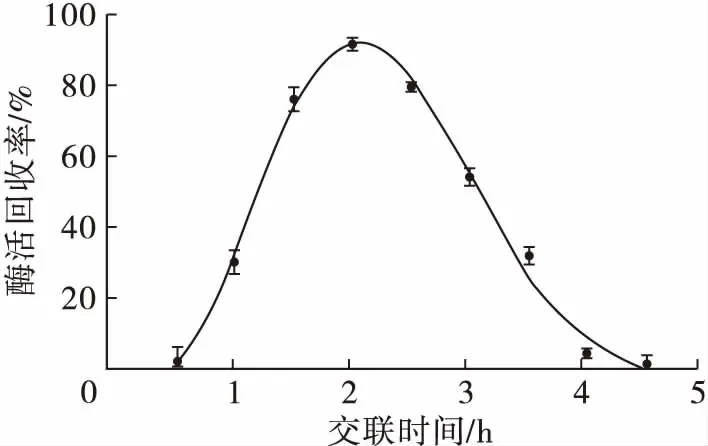
图4 交联时间对交联脂肪酶聚集体活力的影响
由图4可知,交联时间超过2 h,可能是部分未反应的醛基继续与CLEAs-L的活性氨基进行反应,增加了CLEAs-L活性位点的损失,致使交联脂肪酶聚集体活力下降。与此同时,戊二醛本身就是一种酶蛋白的变性剂,随着酶蛋白与戊二醛接触时间的延长,脂肪酶自身的酶活也会有所降低。交联时间为2 h时,酶活回收率最大。
2.1.3 二次交联条件的确定
2.1.3.1 戊二醛用量对固定化CLEAs-L活力的影响
在CLEAs-L与载体质量比为1∶1条件下,戊二醛用量对固定化CLEAs-L活力的影响见图5。
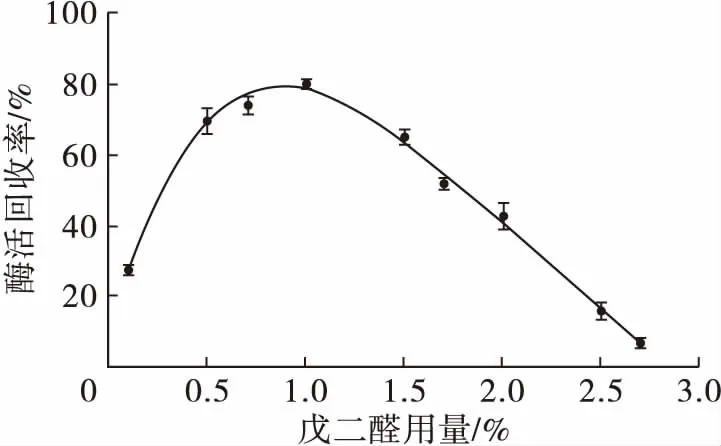
图5 戊二醛用量对固定化CLEAs-L活力的影响
戊二醛起“手”的作用将CLEAs-L和磁性松香基高分子连接起来,实现载体与无载体固定化技术相结合。由图5可知,戊二醛用量少不能有效固定交联脂肪酶聚集体,固定化CLEAs-L酶活低。当戊二醛过量,会交联CLEAs-L的活性位点,导致酶失活。因此,二次交联采用戊二醛用量为1%,固定化CLEAs-L酶活回收率最大。
2.1.3.2 交联脂肪酶聚集体与载体质量比对固定化CLEAs-L活力的影响
在戊二醛用量为1%条件下,交联脂肪酶聚集体与载体质量比对固定化CLEAs-L活力的影响见图6。
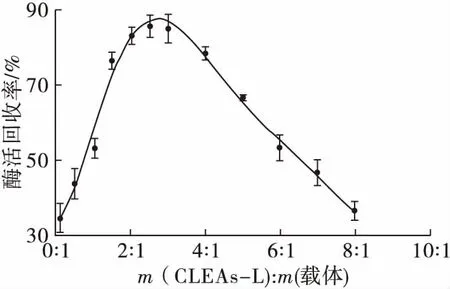
图6 交联脂肪酶聚集体与载体质量比对固定化 CLEAs-L活力的影响
由图6可知,随着CLEAs-L与载体质量比增大即交联酶聚集体的投放量增大,固定化CLEAs-L酶活回收率先增大后减小,2.5∶1时酶活回收率最大,为86.52%。当投入过多的CLEAs-L时,可能引起过多的CLEAs-L堆积在载体上,阻止酶与底物接触,此时虽然加入的CLEAs-L量大,但是其酶活回收率很低即有效利用的酶量较小,不经济实惠。
2.2 酶学性质
2.2.1 最适温度及最适pH(见图7)
取若干个三角烧瓶,每瓶加入0.2 g的固定化CLEAs-L(或1 mL游离脂肪酶溶液),pH为7.5的磷酸盐缓冲液5 mL和4 mL聚乙烯橄榄油乳化液,将三角烧瓶置于20~70℃下反应10 min,然后立即取出加入15 mL 95%乙醇和3滴酚酞溶液后用0.05 mol/L的NaOH溶液滴定至粉红色,30 s内不褪色。测酶的活性,取同组实验中酶活最大的值为100,其余与之相比较,选出游离脂肪酶或固定化CLEAs-L最适温度。
取三角烧瓶若干编号,每瓶加入0.2 g的固定化CLEAs-L(或1 mL的游离脂肪酶溶液),然后在各烧瓶中分别加入pH为5.8~8.0的磷酸盐缓冲液,再加入4 mL的聚乙烯橄榄油乳化液,分别置于40℃(游离脂肪酶)和45℃(固定化CLEAs-L)水浴中反应10 min,取出加入95%乙醇15 mL,滴加3滴酚酞溶液后用0.05 mol/L的NaOH溶液滴定至粉红色,30 s内不褪色。测定酶的活性,以同组实验中某次酶活最大值为100,同组之间进行比较得到游离脂肪酶或固定化CLEAs-L的最适pH。
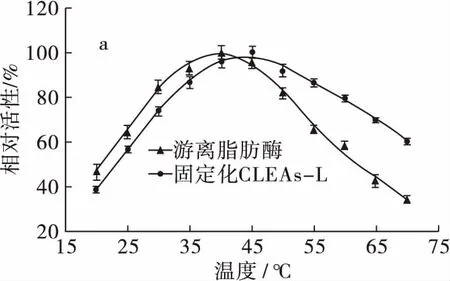
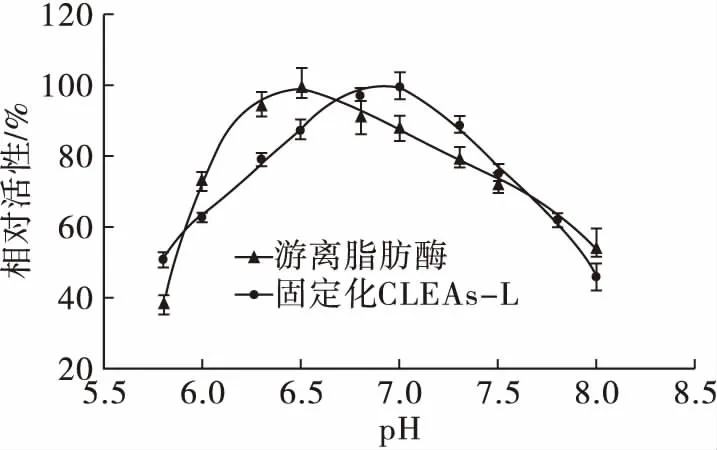
图7 温度(a)和pH(b)对固定化CLEAs-L和游离脂肪酶活性的影响
由图7可知,固定化CLEAs-L和游离脂肪酶的最适温度分别为45、40℃。40℃之前固定化CLEAs-L 的相对活性低于游离脂肪酶的,可能是由于高分子链在低温下没有伸展开,部分固定化CLEAs-L不能与底物接触,没有发生反应。40℃之后,固定化CLEAs-L的相对活性高于游离脂肪酶的,受温度影响变小。可能是磁性松香基高分子产生的屏蔽效应,在较高的温度下保护了酶的活性。同时,酶分子与载体、酶分子与酶分子多点连接,防止了酶分子伸展变形。因此,固定化CLEAs-L的耐热性明显提高[15]。
固定化CLEAs-L的最适pH为7.0,比游离脂肪酶向碱性方向移动了0.5个单位。可能是因为磁性松香基高分子碱性载体可以吸引更多的在固定化CLEAs-L附近的H+,局部的环境比溶液的酸性更强。因此,固定化CLEAs-L比游离脂肪酶耐碱性增强,耐酸性有所降低[16]。
2.2.2 操作稳定性
固定化CLEAs-L、固定化脂肪酶和交联脂肪酶聚集体(CLEAs-L)在45℃、pH 7.0的磷酸盐缓冲溶液中按1.2.6方法测定酶活性,然后外加磁场将固定化CLEAs-L、固定化脂肪酶回收,过滤将交联脂肪酶聚集体(CLEAs-L)回收,再用10 mL pH 7.0的磷酸盐缓冲溶液洗涤3种酶。然后将3种酶再按1.2.6方法测定酶活性,再回收、洗涤,重复操作,研究3种酶的操作稳定性,结果见图8。
由图8可知,重复操作6次后,固定化CLEAs-L、固定化脂肪酶、CLEAs-L的酶活回收率分别为60.53%、36.60%和32.12%。固定化CLEAs-L效果最好。随着循环操作次数的增加,酶活回收率下降,可能是由于在重复使用过程中,固定化载体溶胀、结构发生变化和酶的泄露所造成的。
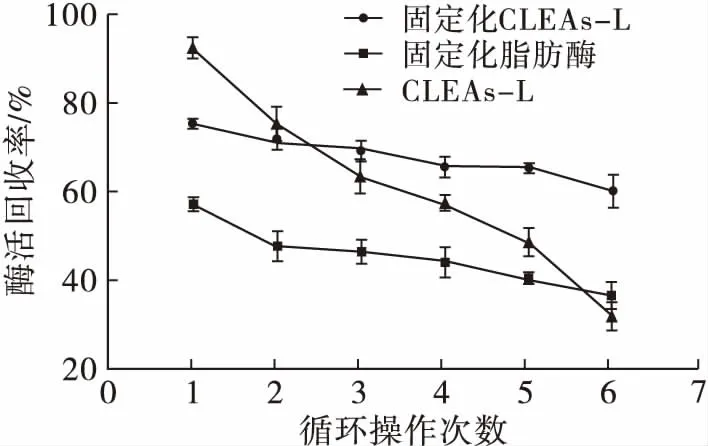
图8 操作稳定性
2.2.3 储存稳定性
将各0.1 g游离脂肪酶、固定化CLEAs-L和CLEAs-L分别放在20 mL、0.1 mol/L pH 7.5的磷酸盐缓冲溶液中,4℃下低温保存,定期取样测定酶活性。3种酶的储存稳定性结果见表1。
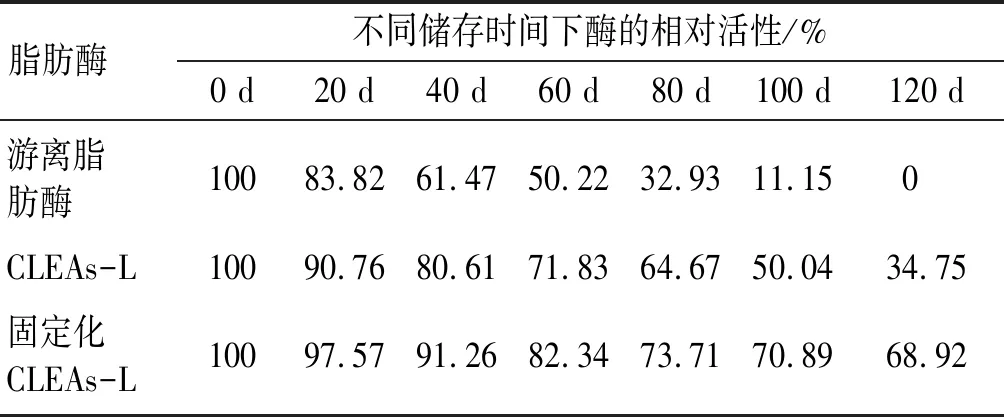
表1 游离脂肪酶、CLEAs-L和固定化CLEAs-L的 储存稳定性
由表1可知,在相同条件下储存120 d,固定化CLEAs-L和CLEAs-L相对活性分别为68.92%和34.75%,而游离脂肪酶已经没有活性了。说明固定化CLEAs-L稳定性较好,适合于长期储存和使用。这可能是因为当酶分子从溶液中转移到固定化CLEAs-L中,由于不溶的刚性载体的存在,对酶有屏蔽作用,并且增大了分子间的疏水作用,防止酶发生变性,从而增强了酶对热和其他变性剂的稳定性[17]。
2.2.4 热稳定性
将固定化CLEAs-L、CLEAs-L和游离脂肪酶放置在40~80℃的恒温水浴中保温2 h。并定义25℃游离脂肪酶的酶活性为100%,经过热处理的酶活性与之比较,从而得出相对活性。结果见表2。
由表2可知,固定化CLEAs-L的耐热性明显提高,可能是:①磁性松香基高分子载体的屏蔽作用,抑制酶分子活性结构的破坏,有效保护了交联脂肪酶聚集体;②在酶分子的聚集过程中,酶蛋白分子进行了有序的排列,并在交联过程中将酶分子进行固定,减少其受温度影响发生折叠和反转引起三维结构损坏[11]。
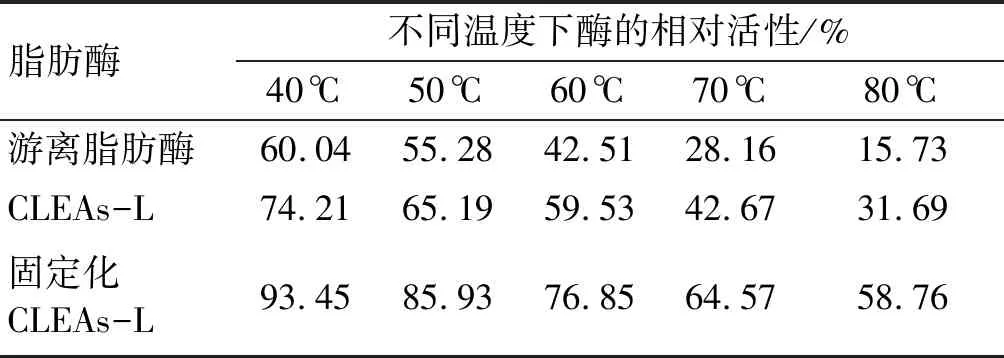
表2 游离脂肪酶、CLEAs-L和固定化 CLEAs-L活性的热稳定性
2.3 磁性松香基高分子和固定化CLEAs-L的结构
2.3.1 电镜扫描
采用扫描电子显微镜(SEM)研究了脂肪酶聚集体、CLEAs-L、载体、固定化脂肪酶、固定化CLEAs-L的表面形态,结果如图9所示。
由图9可知,脂肪酶聚集体为“蜂窝状”连贯结构,由松散的不规则的凝聚物组成。而合成的CLEAs-L表面光滑,棒状,几乎平行排列。进一步证明CLEAs-L具有更好的储存稳定性,操作稳定性和热稳定性。图9c、d、e显示在相同放大倍率下,载体表面粗糙,不均匀,存在大量的空隙和凹坑。固定化脂肪酶表面几乎与载体表面相同。相比之下,固定化CLEAs-L的相应SEM图像清晰可见显示出具有少量空隙的不同表面,其均匀且完全被分散良好的CLEAs-L覆盖。

注:a×5 000;b×5 000;c×15 000;d×15 000;e×15 000。图9 脂肪酶聚集体(a)、交联脂肪酶聚集体(b)、载体(c)、固定化脂肪酶(d)、固定化CLEAs-L(e)的SEM图
2.3.2 粒径分布
固定化CLEAs-L的粒径分布如图10所示。
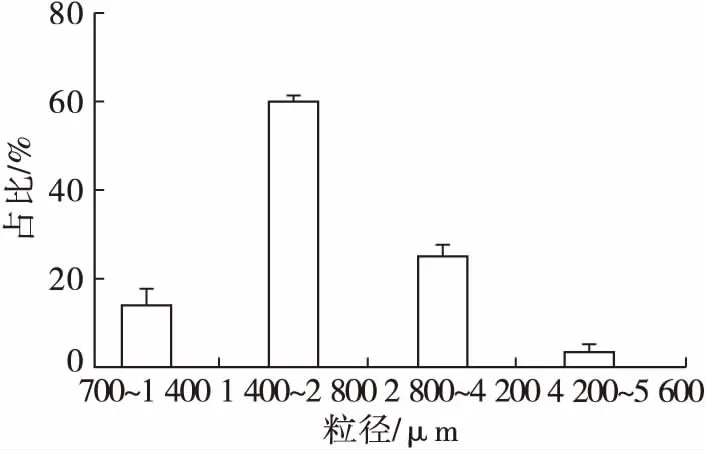
图10 固定化CLEAs-L的粒径分布
脂肪酶催化反应的底物大多比较黏稠,若固定化酶颗粒比较小,不利于反应结束后的分离回收。由图10可知,有60%的固定化CLEAs-L的粒径集中在1 400~2 800 μm,颗粒较大、均匀、且具有磁性,在外加磁场的作用下有利于回收操作。
2.3.3 固定化脂肪酶和固定化CLEAs-L的酶负载量(见表3)

表3 固定化脂肪酶和固定化CLEAs-L的 氮含量及酶负载量
由表3可知,固定化CLEAs-L酶负载量约为固定化脂肪酶的5倍,但是图8显示,酶负载量与活性不成正比。可能是由于脂肪酶在聚集和交联过程中发生变性失活或是酶的活性位点与交联剂发生交联导致实际上能起催化作用的酶含量降低。
3 结 论
本研究将交联脂肪酶聚集体固定在磁性松香基高分子上(即固定化CLEAs-L)。研究了制备过程中的工艺参数对固定化CLEAs-L活性的影响。最佳制备条件为:沉淀剂无水乙醇用量30%,脂肪酶质量浓度4 g/L,一次交联反应中添加0.3%的戊二醛,交联2 h,二次交联反应中添加1%的戊二醛,交联脂肪酶聚集体与载体的质量比为2.5∶1。在最佳制备条件下,固定化CLEAs-L的酶活回收率为86.52%,固定化CLEAs-L的最适温度和pH分别为45℃和7.0,热稳定性、操作稳定性和储存稳定性均有所提高。有60%的固定化CLEAs-L的粒径集中在1 400~2 800 μm,颗粒较大,且载体具有磁性,外加磁场易于回收分离。此方法工艺简单,操作简便,改善了单一法所带来的固定不稳定及酶活回收率低等缺点。

