枸杞蜜的抗氧化活性及其对DNA氧化损伤的保护作用
何亮亮,赵浩安,刘新艳,张 颖,王 银,程 妮,2,曹 炜,2,*
(1.西北大学食品科学与工程学院,陕西西安 710069; 2.陕西省蜂产品工程技术研究中心,陕西西安 710065)
自由基在机体的生命过程中发挥着重要的作用,体内过多的自由基不仅能够攻击DNA、蛋白质和多糖等生物大分子,而且会导致机体损伤,引发多种慢性疾病[1]。流行病学和营养学研究表明,长期摄入适量的天然抗氧化剂能够显著降低癌症和心脑血管硬化等疾病的发病率[2]。从食品中寻找安全的天然抗氧化剂,保护机体免受氧化应激,预防慢性疾病的发生,已经成为研究热点[3-4]。
枸杞蜜是蜜蜂采集枸杞(LyciumbarbarumL.)花蜜后与自身分泌物在蜂巢中酿制而成的,为我国西北地区特有的单花种蜂蜜,呈浅琥珀色,花香味淡雅,结晶细腻,深受消费者青睐[5]。玄红专等[6]测定了洋槐、枸杞、椴树和枣花等四种单花蜜对羟基自由基的清除能力,但研究结果未能反应枸杞蜜的抗氧化活性与生物体的相关性。单细胞凝胶电泳(Single Cell Gel Electrophoresis,SCGE)技术又被称为彗星试验,是一种灵敏的测定DNA损伤的方法,当DNA断裂损伤时,在细胞电泳过程中,细胞核带负电荷的DNA片段由核心向阳极移动,形成彗星状的图像,可根据尾部与头部的荧光比例评定DNA的损伤程度[7]。淋巴细胞是机体的免疫细胞能够准确反映机体的健康及生理状况,而羟基自由基是最活泼的活性氧分子,是导致DNA损伤的重要因素[8]。不同蜂蜜中化合物种类和含量的不同,对特定自由基和过渡态金属离子的亲和力存在差异,因此在抗氧化活性方面表现出很大差异[9]。目前关于枸杞蜜的过渡态金属离子络合力、总抗氧化能力等体外抗氧化活性的研究很少,而有关枸杞蜜总酚、总黄酮含量及其对DNA氧化损伤保护作用研究还未见报道。
本文对青海枸杞蜜样本的总酚、总黄酮含量和抗氧化活性进行初步评定,并采用彗星电泳技术,研究了枸杞蜜对小鼠淋巴细胞DNA氧化损伤的保护作用,旨为枸杞蜜的质量控制、生物活性评价和功能性食品的开发提供参考依据。
1 材料与方法
1.1 材料与仪器
昆明小鼠(SPF级,雌性,18~22 g,6周龄,生产许可证号:SCXK 2012-003) 由西安交通大学医学院提供;动物饲养和实验 符合中华人民共和国科学技术部颁发的管理规定;动物饲料 自西安秦乐饲料有限公司;枸杞蜜 样品10个,分别用S1~S10表示,2017年8~9月份采集自青海西宁地区,经花粉孢子镜检分析,蜜源植物均为宁夏枸杞(LyciumbarbarumL.),所有样品在4 ℃冰箱中避光保存;菲洛嗪(Ferrozine,纯度≥98%)、1,1-二苯基-2-三硝基苯肼(DPPH)、水溶性VE(Trolox,纯度≥97%)、2,4,6-三吡啶基三嗪(TPTZ,纯度≥98%) Sigma公司;没食子酸(纯度≥99%)、芦丁(纯度≥98%) 中国医药(集团)上海化学试剂有限公司;阿魏酸(纯度≥98%)、槲皮素(纯度≥99%) 阿拉丁试剂(上海)有限公司;抗坏血酸、乙二胺四乙酸二钠(EDTA-2Na)、十二烷基肌氨酸钠、三羟甲基氨酸甲烷、磷酸二氢钠(均为分析纯) 天津市北联精细化学品开发有限公司;福林酚(Folin-Ciocalteu)试剂、30%过氧化氢(优级纯)、L型抗坏血酸(纯度≥99.7%)、溴化乙锭(EB)、三羟甲基氨基甲烷(Tris) 科昊生物工程有限公司。
722G可见分光光度计 上海仪电分析仪器有限公司;HH-2型电热恒温水浴锅 北京科伟永兴仪器有限公司;BSA-CW型电子分析天平 北京赛多利斯科学仪器有限公司;DYY-6D型电脑三恒多用电泳仪 北京市六一仪器厂;BK-FL型荧光显微镜 重庆奥特光学仪器有限公司;Nikon YS100型显微镜 尼康映像仪器销售(中国)有限公司。
1.2 实验方法
1.2.1 花粉分析 枸杞蜜中花粉的检测参照GB/T 23194-2008[10],根据检测结果,确定这10个枸杞蜜样本是否为单花蜜。
1.2.2 枸杞蜜中的单酚类含量的测定 参考Zhou等[11]的方法,将10 g枸杞蜜溶解在100 mL pH2.0盐酸溶液中,经XAD-2型树脂进行吸附,用pH2.0的盐酸溶液和蒸馏水洗脱除去糖等极性物质。甲醇溶液洗脱,洗脱液在40 ℃,-0.1 MPa真空条件下减压浓缩至干,再用甲醇定容后经0.45 μm有机系微膜过滤。采用Zorbax SB-C18(250 mm×4.6 mm,5 μm)色谱柱,进样量10 μL,分离温度30 ℃。流动相为甲醇(A)-0.1%甲酸水溶液(B),采用梯度洗脱。0~10 min,5%~15% A;10~20 min,15%~17% A;20~30 min,17%~30% A;30~50 min,30%~40% A;50~60 min,40%~55% A;60~70 min,55%~80% A。流速为1 mL/min。二极管阵列检测器在280和324 nm波长下检测,电化学检测器设置在900 mV氧化模式下进行。
1.2.3 总酚含量(TPC)测定 枸杞蜜中总酚含量的测定采用Folin-Ciocalteu法[11]。取1 mL 0.1 g/mL的枸杞蜜溶液,加入1 mL Folin-Ciocaltue溶液,混匀后静置5 min,加入5 mL 1 mol/L Na2CO3溶液,加蒸馏水定容至10 mL,摇匀,室温避光1 h后在760 nm 波长测定吸光值。标准曲线用0.01~0.20 mg/mL没食子酸绘制,回归方程为:y=216.56x+0.079(R2=0.9987),以毫克没食子酸当量(GAE:gallic acid equivalent)每千克枸杞蜜表示,单位为mg GAE/kg。
1.2.4 总黄酮含量(TFC)测定 枸杞蜜总黄酮测定采用Al(NO3)3比色法[12]。称取10 g蜂蜜,加100 mL 0.1 mol/L盐酸溶液溶解后上XAD-2树脂柱,用0.01 mol/L 100 mL盐酸溶液淋洗除去极性物质,再用蒸馏水水淋洗至中性,后加入甲醇洗脱,收集洗脱液,于-0.1 MPa真空,40 ℃条件下浓缩至干,用甲醇溶解定容至10 mL。吸取2.5 mL上述甲醇溶液,加1 mL 5%亚硝酸钠溶液,6 min后加入1 mL 10%硝酸铝溶液,静置6 min后,再加入10 mL 4%氢氧化钠溶液,后加水至25 mL。反应15 min后在510 nm波长下测定吸光值。用0.05~1 mg/mL的芦丁制作标准曲线,回归方程为:y=11.327x-0.006(R2=0.9968),以毫克芦丁当量(RE:rutin equivalent)每千克枸杞蜜表示,单位为mg RE/kg。
1.2.5 枸杞蜜的体外抗氧化活性
1.2.5.1 DPPH自由基清除能力 参考Zhou等[11]方法。分别吸取0.2、0.1、0.05、0.025、0.0125 g/mL枸杞蜜溶液1 mL于试管中后,加入4 mL 0.025 mg/mL DPPH甲醇溶液,混匀后25 ℃避光放置1 h,在517 nm处测定吸光值。DPPH自由基的清除率结果用IC50表示。DPPH自由基清除率计算公式:

式中:A0为空白对照溶液吸光值;A1为反应1 h后样品溶液吸光值。
1.2.5.2 总抗氧化能力的测定(FRAP法) FRAP的测定参考Benzie等[13]的方法。取0.4 mL 0.1 g/mL枸杞蜜溶液,加入3.6 mL TPTZ工作液(TPTZ工作液由2.5 mL 10 mmol/L TPTZ溶液,2.5 mL 20 mmol/L FeCl3溶液和25 mL 300 mmol/L pH=3.6醋酸盐缓冲液组成)混匀后室温放置10 min后,于593 nm处测定吸光度。用0.05~0.50 mg/mL Trolox(水溶性维生素E)制作标准曲线,回归方程为:y=37.432x-0.012(R2=0.9981),结果表示为mg Trolox/kg蜂蜜。
1.2.5.3 Fe3+还原力的测定 参照Liang等[14]的方法,取0.1 g/mL枸杞蜜溶液1 mL与2.5 mL 0.2 mol/L pH=6.6磷酸盐缓冲液和2.5 mL 1%铁氰化钾混匀,50 ℃水浴反应20 min,水浴结束后加入5 mL 10% 三氯乙酸混合均匀,在25 ℃ 1000 r/min条件下离心5 min,取上清液2 mL,加2 mL蒸馏水和0.4 mL 0.1% FeCl3充分混匀后,在700 nm处测定吸光值。用0.01~0.10 mg/mL抗坏血酸制作标准曲线。回归直线方程为:y=0.028x+0.002(R2=0.9991),结果用mg VC/kg表示。
1.2.5.4 Fe2+络合力的测定 取200 μL 0.1 g/mL的枸杞蜜溶液,加入浓度为1 mmol/L的FeSO4溶液100 μL、1 mmol/L的Ferrozine溶液300 μL,加甲醇补足体积至3 mL,于562 nm处测吸光值[14]。以0.025~0.050 mg/mL EDTA-2Na做标准曲线,回归直线方程为:y=7.031x+0.016(R2=0.9995),枸杞蜜的铁离子络合力测定结果用mg EDTA-2Na/kg表示。
1.2.6 小鼠淋巴细胞悬浮液的制备 为保证实验中采用的小鼠淋巴细胞为正常淋巴细胞,实验中的4只小鼠饲喂在塑料鼠房中,饲喂室温度为20~25 ℃,空气湿度为70%左右,白天照明时间为14 h,小鼠自由采食,饲料和饮水充足。采集活体小鼠淋巴细胞前对小鼠提前8 h禁食,预先在4 mL离心管中加入50 μL肝素钠抗凝剂,小鼠常规眼眶取血约0.5 mL,1∶1加入细胞分离液后4 ℃,3500 r/min条件下离心2 min,取中间淋巴细胞液层。用0.15 mol/L,pH=7.4无钙镁磷酸缓冲(PBS)溶液和血球计数板,将细胞浓度调至105~106个/mL,得淋巴细胞悬液。
1.2.7 枸杞蜜对羟基自由基诱导小鼠淋巴DNA氧化损伤的保护作用 参考并改进Singh等[15]的方法。将1.2.6中制得的小鼠淋巴细胞悬液分为五组进行实验,以PBS溶液为空白对照,模型组和三个剂量组中加入10 μL 0.2 mol/L H2O2,分别在低、中、高三个剂量组中各加入10 μL 浓度为0.05、0.10、0.20 g/mL枸杞蜜溶液(以0.15 mol/L,pH=7.4 PBS溶解配制),各组再加入10 μL淋巴细胞悬液,最后用PBS溶液将各组体积补至50 μL,混匀,在37 ℃避光条件下水浴30 min。在磨砂载玻片上铺1%正常熔点琼脂糖,冷却凝固后,取10 μL上述细胞混合液与加热融化冷却后的1%低熔点琼脂60 μL混匀后在载玻片上铺第二层胶,于4 ℃下冷却凝固,后在pH10.0细胞裂解液中裂解20 min,在25 V,300 mA条件下电泳20 min后,玻片用Tris-HCL溶液中和,加入无水乙醇脱水,干燥后,加一滴10 μg/mL溴化乙锭(EB)染色,盖片。玻片在荧光显微镜590 nm绿光下激发,10倍目镜,40倍物镜条件下观察,拍照。每组随机选择50个细胞,用CASP图像处理软件分析各组的尾部DNA含量(Tail DNA%)、尾矩(Tail Moment)和Olive尾矩(Olive Tail Moment)。
1.3 数据处理
每个样品平行测三次,数据表示为平均值±标准差。方差分析和显著性分析采用SPSS 19.0软件进行分析,采用Duncan’s multiple range test进行多重比较。
2 结果与分析
2.1 枸杞蜜的花粉分析
当蜂蜜中单一花粉比例高于80%时,即为单花蜜[16]。样本枸杞蜜的花粉分析结果如表1所示,各样本蜂蜜中枸杞花粉所占的比例为80.4%~89.4%,表明本研究中各样本蜂蜜均为枸杞单花蜜。

表1 枸杞蜜的枸杞花粉比例Table 1 Proportion of medlar pollen in honey samples
2.2 枸杞蜜中单酚类化合物
HPLC-ECD结果如图1所示,所有样本枸杞蜜中均含有没食子酸、阿魏酸和槲皮素,含量如表2所示。不同枸杞蜜样品的酚酸含量也有显著差异(p<0.05),没食子酸含量为8.425~16.354 mg/kg、阿魏酸含量为5.801~13.004 mg/kg和槲皮素含量为0.702~1.806 mg/kg,且没食子酸含量明显高于阿魏酸和槲皮素含量。Tenore等[17]的研究结果显示枸杞蜜中的没食子酸含量显著高于柑橘蜜、柠檬蜜、杏花蜜等三种蜂蜜,而Liang等[14]的研究表明,枣花蜜中没食子酸含量为0.25~0.32 mg/kg,远低于枸杞蜜中的没食子酸含量。因此没食子酸可以作为一种潜在的花源标志物用于鉴别枸杞蜜和其他浅色蜜。

表2 枸杞蜜中没食子酸、阿魏酸和槲皮素含量Table 2 Contents of gallic,ferulic and quercetin of medlar honey

图1 样品色谱图Fig.1 Chromatogram of samples注:A标准品;B枸杞蜜样品;峰1:没食子酸;峰2:阿魏酸;峰3:槲皮素。
2.3 枸杞蜜的总酚和总黄酮含量
蜂蜜的总酚含量与蜜源植物、气候、收获技术和贮藏条件等因素相关,因此各蜂蜜样品的总酚含量存在差别[5]。如图1结果所示,在枸杞蜜中发现有酚酸类和黄酮类物质,因此测定其总酚和总黄酮含量[14]。与Tenore等[17]的研究结果一致,实验中测得枸杞蜜的总酚酸、总黄酮含量分别为401~532 mg GAE/kg和7.19~12.26 mg RE/kg。
2.4 枸杞蜜的体外抗氧化活性
2.4.1 DPPH自由基清除能力 枸杞蜜样品对DPPH自由基清除能力结果如图2所示,所有枸杞蜜样品对DPPH自由基均有清除作用,枸杞蜜对DPPH自由基清除活性的IC50值为36.72~52.32 mg/mL。曹炜等[18]的研究结果表明蜂蜜的DPPH自由基清除能力主要与其总酚含量相关。实验中枸杞蜜的总酚含量越高,对应的DPPH自由基清除IC50值越小,自由基清除能力越强。由表3和图2可得,样品S9的总酚含量最高,其DPPH自由基清除能力清除能力也最强。

图2 枸杞蜜的DPPH自由基清除能力Fig.2 DPPH scavenging activity of medlar honey注:不同小写字母表示差异显著(p<0.05);图3~图5、图7同。

表3 枸杞蜜中总酚和总黄酮含量Table 3 The contents of total phenolic acid and total flavonoids of medlar honey
2.4.2 总抗氧化能力(FRAP) 对10种枸杞样品总抗氧化能力进行评价,实验结果如图3所示,枸杞蜜的FRAP值为122.5~187.6 mg Trolox/kg。不同枸杞蜜样品的FRAP值如图3所示,S3样品的FRAP值最小为122.5 mg Trolox/kg,而S9号样品的FRAP值最大为187.6 mg Trolox/g。FRAP法不是测定具体某种自由基,而是样品总的还原能力,一些学者用此法测定样品的总抗氧化活性[19]。Can等[20]的研究结果显示柑橘蜜的FRAP值为57.3~89.2 mg Trolox/kg,远低于枸杞蜜的FRAP值,表明柑橘蜜的抗氧化活性弱于枸杞蜜,可能与蜂蜜的产地、气候的因素相关。枸杞蜜产地为我国西北地区,是典型的干旱半干旱地区,而柑橘蜜的产地为湿润区,一般干旱半干旱地区蜂蜜的抗氧化活性高于湿润区蜂蜜的抗氧化活性[21]。

图3 枸杞蜜的FRAPFig.3 FRAP of medlar honey
2.4.3 枸杞蜜的Fe3+还原力测定 10种枸杞蜜样品铁离子还原力实验结果如图4所示,枸杞蜜的Fe3+还原力平均值为0.214~0.427 mg VC/kg。枸杞蜜的Fe3+还原力有较大的差异性,其中S9号枸杞蜜样品的Fe3+还原力能力最强,约为S3枸杞样品的2倍。Wang等[22]的研究结果表明蜂蜜的Fe3+还原力与蜂蜜的采收时间、运输和贮藏温度等因素相关,而在实际生产中蜂蜜的采收时间、运输和贮存条件很难保持一致,因此不同枸杞蜜样本的Fe3+还原力呈现较大的差异性。

图4 枸杞蜜的Fe3+还原能力Fig.4 Fe3+ reducing activity of medlar honey
2.4.4 枸杞蜜对Fe2+的络合力 如图5,测定的10个枸杞蜜样品均对Fe2+具有络合力,在27.4~41.7 mg EDTA-2Na/kg之间。Sun等[23]认为蜂蜜对Fe2+的络合合能力主要与其黄酮类物质独特的C6-C3-C6结构和碳桥上特定的酚羟基能够高效的络合过渡态金属离子有关。Wang等[24]研究结果显示荆条蜜的Fe2+的络合力为3.18~41.7 mg EDTA-2Na/kg。Tenore等[17]研究结果表明,花蜜的成分受植物的生长环境和气候影响较大,接受充足阳光的植物比其他植物具有更多的多酚含量,而荆条蜜产地的纬度与枸杞蜜相似,因此两种蜜的Fe2+的络合力无显著性差异。
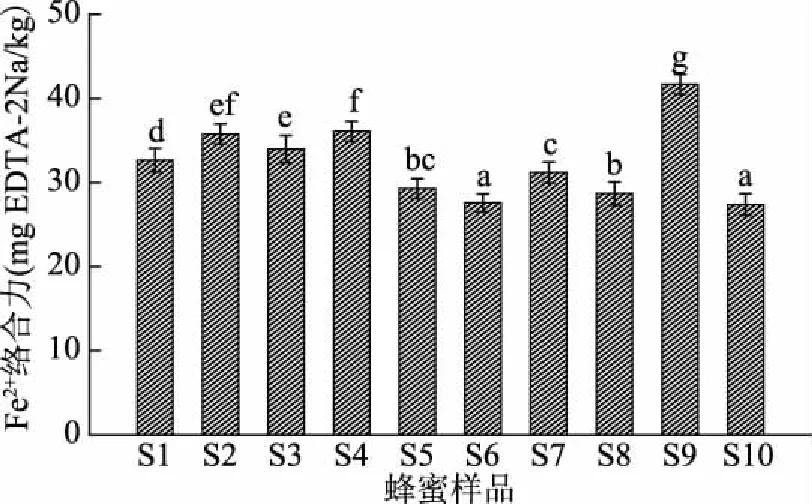
图5 枸杞蜜的Fe2+络合能力Fig.5 Ferrous ion-chelating activity of medlar honey
2.5 总酚、总黄酮含量与抗氧化活性的相关性分析
枸杞蜜的抗氧化活性与总酚、总黄酮含量的相关性分析结果如表4所示。酚类物质中的酚羟基可以提供电子,具有较强的还原能力,是蜂蜜具有抗氧化活性的化学基础。枸杞蜜的DPPH自由基清除能力和Fe3+还原能力与其总酚含量均显著相关(p<0.05,p<0.01),表明枸杞蜜清除DPPH自由基和Fe3+还原能力主要是通过酚羟基中的氢原子的还原性。枸杞蜜的Fe2+络合能力与其总黄酮含量极显著相关(p<0.01),是由于黄酮类物质特殊的化学结构,使Fe2+能够螯合在黄酮类化合物母核的3-羟基和4-羰基之间[25]。

表4 枸杞蜜的总酚、总黄酮含量与抗氧化活性的相关性分析Table 4 Correlation analysis between total phenolic content and antioxidant activities of medlar honey
2.6 枸杞蜜对H2O2诱导的小鼠淋巴细胞DNA损伤的保护作用
采用羟基诱导小鼠淋巴细胞作为DNA损伤模型,研究枸杞蜜对DNA氧化损伤的保护作用。枸杞蜜S9的总酚、总黄酮含量是10个样本蜜中最高的,因此选用S9样品进行彗星电泳实验。如图6a所示,空白对照组无明显DNA损伤,细胞呈圆形,模型组(图6b)因加入H2O2的能够通过Fenton反应产生羟基自由基对DNA结构造成严重的损伤,细胞呈现明显的彗星式拖尾,而加入枸杞蜜的各剂量组(图6c~图6e)与模型组相比拖尾明显减弱。

图6 小鼠淋巴细胞彗星电泳实验结果Fig.6 Results of the comet assay for the DNA damage in lymphocytes of mice注:a对照组;b模型组;c低剂量组;d中剂量组;e高剂量组。
由于细胞间存在个体差异,为避免受极值的影响,各实验组随机选择细胞50个,统计尾部DNA含量、尾矩和Olive尾矩,以比较各组数据分布和组间差异。结果如图7所示,三个加入枸杞蜜保护组淋巴细胞的尾部DNA含量、尾矩和Olive尾矩,均显著低于模型组(p<0.05)。彗星电泳实验结果表明枸杞蜜在0.05~0.2 g/mL浓度范围内能够减轻由羟基自由基诱导的小鼠淋巴细胞DNA氧化损伤。对比低、中、高三个剂量组,当枸杞蜜浓度增加时,彗星尾部DNA比例(依次为63.5%、50.4%和35.0%),尾矩(依次为266.9、166.8和91.5)和Olive尾矩(依次为131.7、91.6和57.4)依次减小。多元线性回归结果显示,尾部DNA含量、尾矩和Olive尾矩与枸杞蜜浓度的线性回归方程决定系数依次为:R2=0.9775,R2=0.9341,R2=0.9425,表明枸杞蜜对小鼠淋巴细胞DNA的保护作用存在明显的剂量-效应关系。

图7 彗星尾部DNA含量、Olive尾矩和尾矩Fig.7 Percents of DNA,olive tail moment and tail moment in the comet tail
羟基自由基在活性氧中对DNA攻击能力最强,能够直接导致DNA开环甚至断裂[26]。当机体内的自由基过多,机体无法正常清除时会发生氧化应激,外源抗氧化剂能够起到预防自由基对DNA生物大分子的氧化损伤[27]。枸杞蜜对DNA氧化损伤的保护机制可能是蜂蜜中酚类化合物能够直接清除羟基自由基或通过酚羟基络合过渡态金属离子抑制Fenton反应从而减少羟基自由基。张华等[28]的研究结果表明,酚酸类物质的抗氧化活性高于黄酮类物质,枸杞蜜中的酚酸含量较高。枸杞蜜中黄酮类物质含量较低,对Fe2+络合力弱,因此枸杞蜜对DNA的主要保护机理可能为通过酚酸类物质的酚羟基直接清除羟基自由基,而络合过渡态金属离子抑制Fenton反应为辅助途径。本研究结果表明枸杞蜜能够减轻羟基自由基诱导的小鼠淋巴细胞DNA氧化损伤,且其对DNA氧化损伤的保护作用与枸杞蜜浓度存在剂量-效应关系。
3 结论
西北地区特有的枸杞蜜是单花种蜜,具有较强的还原能力、DPPH自由基的清除活性和抗氧化能力,在体外环境中能够对羟基自由基诱导的小鼠淋巴细胞DNA的氧化损伤起到较好的保护作用。枸杞蜜的抗氧化活性不仅与其总酚含量呈显著的正相关(p<0.05),而且对羟基自由基诱导的小鼠淋巴DNA氧化损伤的保护作用也呈量效关系(p<0.05)。枸杞蜜对DNA氧化损伤的保护机制主要与其酚类物质有较强的清除自由基活性有关,而枸杞蜜中抗氧化成分的分子结构特征、抗氧化机制及其各抗氧化成分间的协同相互作用还有待进一步深入研究。

