例谈基于数据推理的化学教学实践
丁浩 黄金泉

摘要: 以四个化学教学实践为案例,阐述立足课堂运用合理数据进行推理分析,解答学生疑问,培养学生寻找所需证据的途径,增强学生的证据意识,发展学生化学学科核心素养。提升教师对教材、试题的洞察力和理解力,创设真实的学习情境,为学生的学科素养发展奠定基础。
关键词: 数据推理; 证据意识; 化学教学; 海水提镁
文章编号: 10056629(2019)7005504中图分类号: G633.8文献标识码: B
化学学科核心素养包括“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”五个方面[1]。其中证据意识,通过分析推理加以证实或证伪,建立观点、结论和证据之间的逻辑关系是我们一线教师所追求的本真课堂之一。怎样立足课堂和教材,挖掘素材,创设具体的教学情境,引导学生推理求真,培养他们的证据意识?为此,笔者结合自己的教学实践就如何利用数据推理培养学生证据意识浅谈自己的一些体悟,以求抛砖引玉并欢迎同行批评指正。
1 辨识除杂试剂是否合理
在讲授苏教版《化学1》[2]专题1第二单元中的“物质的分离与提纯”时,笔者常以粗盐(假定含Ca2+、 Mg2+、 SO2-4等杂质)为例进行教学。
教师: 欲除去这些杂质离子,应分别将Ca2+、 Mg2+、 SO2-4一一转化为什么物质?
学生: 应转化为相应的CaCO3、 Mg(OH)2、 BaSO4,然后通过过滤操作除去这些沉淀以达到去除杂质离子的目的。
教师: 为防止引入新的杂质离子,加入的除杂试剂分别是什么?
学生: 应分别为Na2CO3、 NaOH和BaCl2溶液。为确保杂质离子都已除尽,这些加入的试剂都应适度过量。
教师: 过量的BaCl2怎么去除?要不要另加试剂?
学生: (经一番讨论后)没必要,只需确保Na2CO3溶液在BaCl2溶液后面加入即可。也就是说,Na2CO3溶液起两方面的作用,一是沉淀Ca2+;二是除去过量的Ba2+。适度过量的Na2CO3和NaOH溶液,都可以通过滴加盐酸调节溶液pH的方式达到去除的目的。这样加入的除杂试剂组合顺序可能就有多种情况,但不管哪一种组合方式,Na2CO3溶液务必排在BaCl2溶液后面加入才算合理,其他除杂试剂的组合顺序则无关紧要。这种除杂方式通常是一种除杂试剂只能沉淀一种杂质离子。
课上到这,问题都一一解决了,这时却有学生提出: 能否加入Ba(OH)2溶液这一种试剂来同时替代NaOH溶液和BaCl2溶液这两种试剂?这样正好既沉淀了Mg2+,同时又沉淀了SO2-4。为拨开学生心中的疑团,课堂上笔者以资料卡的形式提供了模拟海水中几种主要无机盐的离子含量[3](见表1),对该问题进行了数据推理分析,得到了较为满意的效果。同时,也培养了学生证据意识,提升了学生的学科素养。
经过这样一番的推理分析,学生豁然开朗,脸上也都露出会心的笑容,同时也激励了学生学化学的热情。看得出,学生对这样的解释非常满意。课的最后教师总结说这样看似以一当二的做法其实是不科学的,工业上也并不采用。况且,就目前而言,Ba(OH)2·8H2O的价格比BaCl2·2H2O贵,不经济、不实惠。可见,用Ba(OH)2来代替NaOH和BaCl2,根本达不到正好既沉淀Mg2+,又沉淀SO2-4的目的[4]。
2 辨别混有少量KCl的KNO3提纯方案的合理性
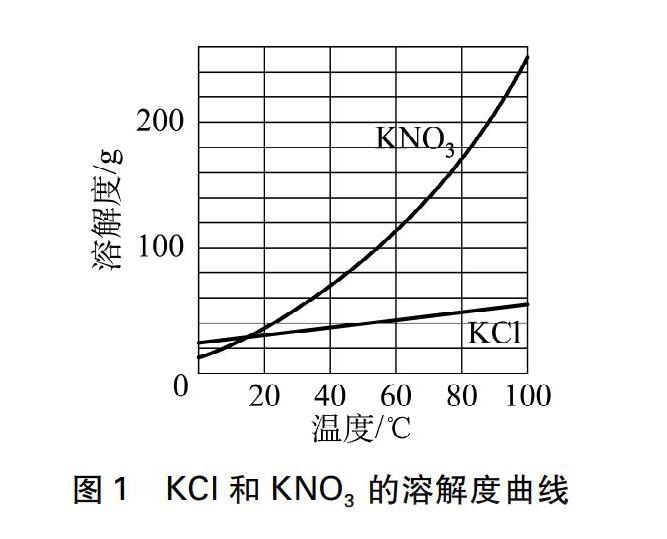
在讲授“物质的分离与提纯”时,教材中的交流与讨论还涉及到这样一个问题: 现有混有少量氯化钾的硝酸钾粉末,请参照溶解度曲线(见图1),设计实验方案提纯硝酸钾。教材文本的方案是:“在提纯混有少量氯化钾的硝酸钾时,先在较高温度下将混合物溶于水中形成浓溶液。然后冷却到一定温度,由于硝酸钾的溶解度随温度降低急剧下降,因此有大量硝酸钾晶体析出,而氯化钾的溶解度随温度变化不大,因而不会有结晶析出。再过滤,即可得到纯净的硝酸钾晶体”。可为什么氯化钾在温度降低的过程中不会同时析出?难道它不能达到饱和状态吗?它的溶解度不是也在随温度的降低而降低吗?只是降低的幅度不大而已,我看肯定會析出那么一点点!因此得不到纯净的硝酸钾!课堂上学生这样“振振有词”地反驳道。显然,要彻底消除学生的疑虑,光定性讲解是远远不够的,教学中笔者结合了相关物质的一些溶解度数据进行推理,起到了事半功倍的教学效果。
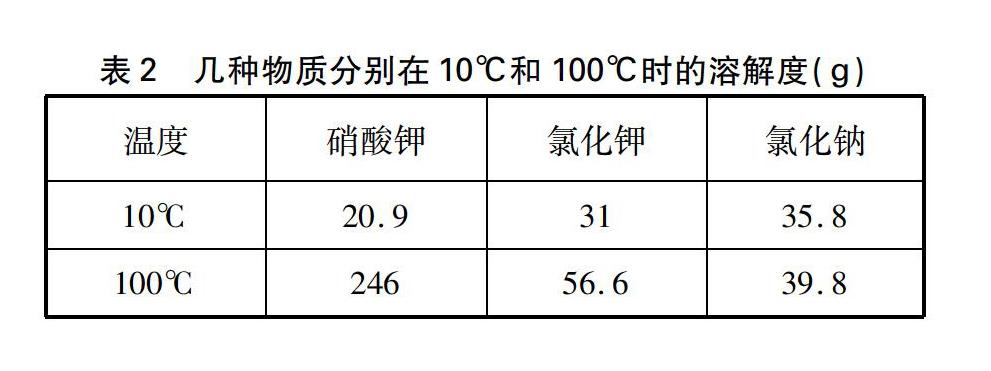
教师: 假设硝酸钾和氯化钠混合物的总质量为140.9g,其中硝酸钾为123g,氯化钠为17.9g(这样的设定足以说明氯化钠的量是少量的)。硝酸钾、氯化钾和氯化钠分别在10℃和100℃时的溶解度数据见表2。若用10℃的水完全溶解此混合物,至少需要水多少克?(假设盐类物质共存时,不影响各自的溶解度)
也就是说当温度降低到一定数值时(假定为10℃),在此温度下氯化钠根本就不会析出结晶。通过这样设定的数据进行推理,证实了将上述浓溶液冷却到一定温度时,氯化钠的溶解度随温度变化不大,因而不会析出结晶的事实,水到渠成地解开了学生心中的疑虑,同时也诠释了教材文本给出的提纯方案的合理性。当然,如果将混合物中的氯化钠换成氯化钾,只需设定氯化钾在混合物中的质量不超过15.5g,其他数据不变,利用所给的溶解度进行数据推理,同样也能得出相同的结论,具体推算过程不再赘述了。
3 海水提镁
在讲授苏教版《化学1》专题2第二单元中的“镁的提取及应用”时,教材文本是这样阐述从海水提镁的步骤的:“将石灰乳加入海水沉淀池中,得到氢氧化镁沉淀,再将氢氧化镁与盐酸反应,得到的溶液蒸发结晶,可得六水合氯化镁晶体(MgCl2·6H2O)。将六水合氯化镁晶体在一定条件下加热生成无水氯化镁,电解熔融氯化镁可以得到金属镁”。应该说教材文本把从海水中如何提取镁的过程概括得非常简洁、精炼,涉及的反应原理也清晰明了。实际教学中,教师如果不能挖掘这段话里面的学科价值一带而过,当学生细细“品味”这段话的含义,很有可能会在他们的脑海中产生这些疑问: (1)为什么是加石灰乳将海水中的镁离子沉淀下来?改加氢氧化钠溶液行不?(2)为什么海水中的镁离子要以氢氧化镁沉淀形式分离出来?以碳酸镁、硫酸镁、氯化镁等其他形式分离行不?(3)为什么是选择电解熔融的氯化镁制取镁?选择电解熔融的氧化镁制取镁行不?选择电解熔融的硫酸镁行不?(4)不选用电解法制取镁,而选用金属置换法行不?如此一系列问题,如果课堂上不能及时加以分析、解决,学生就会带着这些悬而未解的疑问贯穿于整个课堂,很可能导致听课效率大大降低。那么,怎样对上述问题一一进行“破解”呢?数据推理就起了至关重要的作用。
针对疑问(1),课堂上笔者以资料卡的形式给出了几种常见碱的市场价格数据(见表3),让学生自行评价为什么选用石灰乳而不选用氢氧化钠溶液。学生根据提供的常见碱的价格能很快推理出氢氧化钙不仅比其他碱便宜,而且更易就地取材。甚至还进一步解释说按资源就近利用和原料廉价易得的原则,石灰乳可利用海边大量存在的贝壳煅烧成石灰制得。如果氢氧化钙成品加运输成本低于制造成本,则直接购买。
4 高考试题中蕴含的数据
2016年江苏高考试题第16题是一道工业流程图题。原试题摘录如下: 以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
(1)(2) 略
(3) 向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是。
该试题将元素化合物、化学反应原理和化学实验融为一体,意在引导化学教学关注化学学科内知识的融合,强化培养学生综合运用化学知识解决真实而有意义的化学问题的能力,帮助学生树立学科价值观。当年该试题的第3小题失分较为严重,大多数学生直接回答“冷却结晶”,有的只答“蒸发浓缩”,少数学生则错答成“蒸发结晶”。究其原因,很多学生当时只注意到KClO3的溶解度随温度的升高而增大,没有留意到“溶液中KClO3的含量为100g·L-1”这一信息,甚至视而不见;还有学生误以为给出的这一数据纯粹多此一举。这道题应答全“蒸发浓缩、冷却结晶”才能给分,为什么非要强调先蒸发浓缩呢?试题给出溶液中KClO3含量这一数据透露出什么信息?如何解读?该信息对解题有什么帮助?如何处理?等等。如果试着假设溶液的体积為1L,则溶液中KClO3的质量为100g,若溶液的体积近似为水的体积,1000g水中大约溶解了100g KClO3,即近似于100g水中溶解了大约10g KClO3,从图示中大致可以看出对应的温度近似于30℃,也就是说KClO3大致在近似于30℃达到饱和状态,在该温度下直接冷却(即使冷却到0℃),只能得到较少的KClO3固体。相比其他三种盐,KClO3的溶解度随温度的变化最大,且在低温时溶解度很小。因此为了尽可能多地从滤液中析出KClO3固体,采取的方法应是蒸发浓缩、冷却结晶。
高考命题者的目的是考查学生基于“溶液中KClO3的含量为100g·L-1”这一证据,去推理KClO3大致在什么温度下能够达到饱和状态,从而判断欲从该溶液中尽可能多地析出KClO3固体,应该采取什么样的措施[5]。
可见,运用数据进行分析推理能够培养学生的证据意识,有效提升学生的学科素养。基于证据进行推理,确定形成科学结论或解释证据与结论之间的关系,是当前新课程标准所倡导的,也是化学学科核心素养所要求的。因此,我们要立足于教材,并加强教材到教学的深度研究,提升对教材的理解力,创设具有真实的化学学习情境,开展以素养为本的课堂教学实践,为学生的学科核心素养发展奠定坚实的基础。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018: 3.
[2]王祖浩主编. 普通高中课程标准实验教科书·化学1(必修)[M]. 南京: 江苏教育出版社, 2014.
[3]郭琨编著. 海洋手册[M]. 北京: 海洋出版社, 1984: 41.
[4]黄金泉. 对教学中几个疑问的探讨与思考[J]. 化学教学, 2015, (3): 83~84.
[5]黄金泉. 由苏州市中学教师专业素养竞赛备考说开去[J]. 化学教与学, 2017, (6): 74~75.

