对乙醇催化氧化实验的补充认识
唐思嘉 刘怀乐

摘要: 对乙醇氧化反应实验进行了深入研究,设计用CuO粉末作氧化剂氧化乙醇生成乙醛的实验,说明教材上红热螺旋铜丝氧化乙醇的氧化剂是CuO本身,而教材、教参、教辅等长时期把该反应视为铜起催化剂作用的催化氧化反应。设计了“乙醇的铜催化脱氢”以及“有空气参与的铜催化脱氢”两个实验,进一步实证乙醇的铜催化氧化反应机理是复杂的,既有无氧条件下铜的催化脱氢,又有空气存在下的铜的催化脱氢,还有CuO作氧化剂的氧化反应,不能一概而论。
关键词: 乙醇催化氧化; 乙醛; CuO; 实验探究
文章编号: 10056629(2019)7008003中图分类号: G633.8文献标识码: B
1 曾被忽视的问题
现行高中化学教材有人教版、苏教版和鲁科版三种版本,里面有一个共同的实验几乎用了完全一样的实验方法,去认识乙醇氧化生成乙醛的反应。
实验如是描述,试管里放入几毫升乙醇,把烧呈红热的螺旋铜丝迅速插入乙醇中,反复多次,观察铜丝的变化和注意酒精气味的变化。要求学生“综合整个反应过程,说明铜丝在反应中的作用”。
有文献指出,红热螺旋状铜丝(CuO)氧化乙醇的氧化剂是氧化铜本身[1]。反应中红热的Cu丝表面被空气氧化生成黑色的CuO,是CuO把乙醇氧化成乙醛。反应过程当写成:
Cu+O2△2CuO
CH3CH2OH+CuO△CH3CHO+Cu+H2O
至于Cu丝的作用,我们提供以下几个实验来说明。
(1) 在试管里放进黄豆大小的黑色CuO粉末,加入约1mL酒精把CuO润湿,然后加热蒸干(直至灼热),会发现CuO变成紫红色的Cu,试管底呈现光亮的Cu镜,并可以闻到浓烈的乙醛气味。
(2) 把米粒大的CuO粉末放在玻璃质燃烧匙里,把燃烧匙烧至红热,迅速伸进盛有少量无水乙醇试管内的液面上方(有乙醇蒸气),燃烧匙内的黑色CuO也会立即变成红色的Cu,试管口可以闻到乙醛的气味。
(3) 在玻璃棒的一端,抹上一些黑色CuO粉末,当把烧呈红热的玻璃棒迅速伸进有乙醇蒸气的试管内,黑色CuO也立即变成红色(Cu)。同时在试管口闻到乙醛的气味。
将这三个实验与教材中红热螺旋铜丝迅速插入乙醇中的实验作比较,很有相似之处。我们的研究发现,在反复加热螺旋铜丝的过程中,可观察到红热铜丝表面有黑色氧化铜生成,当与乙醇接触后即轉化为金属铜。可见,红热铜丝起了与试管、玻璃质燃烧匙和玻璃棒等同的承载CuO的作用[2,3]。如果有人因此把这里的Cu丝视为这个反应的催化剂,那我们提供的玻璃质燃烧匙、玻璃棒还能是这个反应的催化剂么?事实上像Fe2O3、 Pb3O4、 PbO等也有完全等同于CuO的氧化还原效果。
因此,我们有理由说,以上两个反应是断续的、独立的,不同条件下的反应不宜简单地合起来写,更不能把这两个式子加合起来,在没有任何条件的情况下还在箭头上面写上Cu或Cu催化剂,很是欠妥。
2 实证乙醇的Cu催化脱氢反应生成乙醛
大学有机化学都有乙醇催化脱氢成乙醛的内容[4]。
CH3CH2OHCu, 325℃△CH3CHO+H2
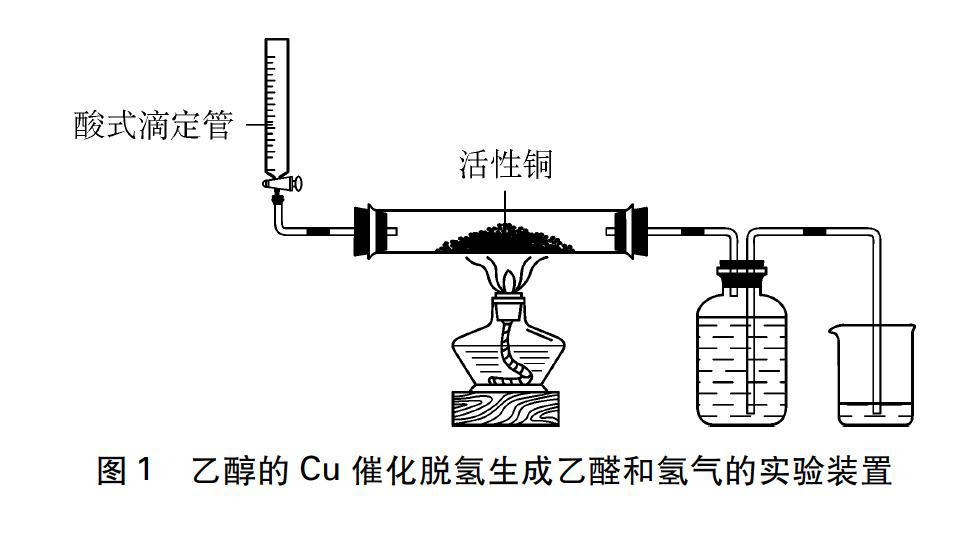
根据上述反应原理,设计了图1所示的实验方法,去认识反应生成的乙醛和H2。
实验前在玻璃管内加入足量的CuO,开启启普发生器用H2排尽玻璃管内的空气(氧气),并充分还原CuO,让全部CuO都加热还原成Cu(活性铜)。然后如图1所示连接好实验装置,用酒精灯加热玻璃管(使乙醇通过活性铜时充分反应),通过酸式滴定管,以约0.40mL/min的速度滴加乙醇,使气化了的乙醇通过活性铜时充分反应。
图1 乙醇的Cu催化脱氢生成乙醛和氢气的实验装置
随着反应的进行,集气瓶中的水逐渐减少,最终进入到烧杯中,最后把烧杯中的水倒入量筒中测得水的体积,就是乙醇催化脱氢生成氢气的体积。多次实验表明,1mL的乙醇可定量收集到约365~370mL的氢气(实验在冬天室温为12℃的情况下完成),实验记录于表1。
实验后可以从集气瓶或烧杯中取出少量的液体与新制的碱性Cu(OH)2共热检验生成的乙醛。
为了验证反应生成的气体,在上述实验之后点燃集气瓶中的氢气,可以观察到H2安静地燃烧呈淡蓝色的火焰。
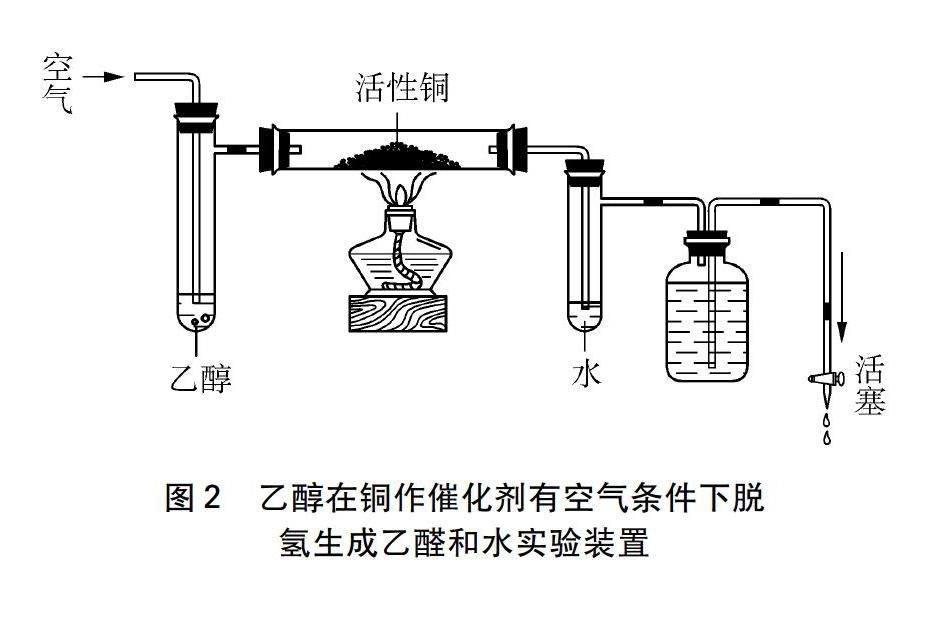
3 实证乙醇的Cu催化有空气条件下脱氢生成乙醛
玻璃管内放如图2所示用的活性铜(用H2还原CuO制得),然后按图2所示连接装置,用酒精灯加热玻璃管中有活性铜的部位,开启活塞,用手挤压把洗耳球体内的空气排出,将洗耳球的尖嘴接在活塞的导管下口吸气,使整个装置形成负压,水流顺着活塞导管部位流出(可调节活塞控制水流的速度),乙醇蒸气随空气进入玻璃管,在活性铜催化剂作用下发生脱氢反应生成乙醛。一段时间后,拆除装置,将盛有水的具支试管中的液体与新制的碱性Cu(OH)2共热,有红色沉淀Cu2O生成,示有乙醛。
文献和实验表明,乙醇催化脱氢原本是一个可逆反应,反应是在温度为325℃的条件下进行的。
如果在脱氢时有空气存在,比如把乙醇和空气混合在一起时,脱去的H2即和氧结合成水,反应放热促使平衡移向右方,这才有如下的反应成立:
2CH3CH2OH+O2Cu, 600℃2CH3CHO+2H2O+热
文献指出,这里空气中的O2在反应中没有起氧化作用,而是作为氢的受体[5]。可见,三种教材版本所呈现的化学反应表达式:
2CH3CH2OH+O2Cu或Ag△2CH3CHO+2H2O
或2CH3CH2OH+O2催化剂△2CH3CHO+2H2O
它们是在满足上述条件下才能成立的。
4 几点认识
(1) 教材、教参、教辅和教学,长时期把红热螺旋铜丝氧化乙醇生成乙醛的反应视为铜的催化反应,或者习惯性地把它视为催化反应。这至少说明我们对这个反应的反应过程认识不足,是应该纠正的时候了。
(2) 我们虽然没有必要向学生辨析几种(如CuO作氧化剂、无氧参与的铜催化脱氢、有氧参与的铜催化脱氢)乙醇氧化反应的机理,但是如果我们教师不明其理,甚至张冠(乙醇Cu或Ag催化氧化制乙醛)李戴(加热螺旋Cu丝氧化乙醇到乙醛)了,这种科学性错误,应当杜绝在我们教材中出现。
(3) 乙醇在铜做催化剂有空气(氧气)条件下脱氢是否存在中间产物(CuO),至今没有明确的定论。在认识上,教师应当树立一个观点——化学反应是复杂的,乙醇的铜催化氧化反应机理也是复杂的,既有无氧条件下铜的催化脱氢,又有空气存在下的铜的催化脱氢,还有CuO作氧化剂而非铜起催化作用的氧化还原反应,反应时可能几者兼而有之,不能一概而论。
(4) 著名的英国生物学家、进化论的创始人达尔文曾风趣地说:“大自然是一有机会就要说谎的。确实,大自然总是把现象、假象呈现在人们的面前,而将真相,本质深深地隐藏起来,要揭示其规律谈何容易![6]”希望我们教材的编著、读者,多在事实的真伪上下一番功夫,去认识分析我们所讨论的问题,以期求得我们共同的进步。
参考文献:
[1]潘虹, 杜文敏, 朱华英, 刘怀乐. 乙醇氧化反应实验的再认识[J]. 化学教学, 2016, (5): 58~60.
[2]李先拴. 铜催化氧化乙醇生成醛的反应机理[J]. 化学教学, 2011, (9): 45~46.
[3]戴志群. 乙醇氧化乙醛实验中铜不是催化劑[J]. 化学教学, 1993, (3): 30.
[4]邢其毅, 徐瑞秋等. 基础有机化学(上册)(第二版)[M]. 北京: 高等教育出版社, 1993: 391.
[5]邢其毅编. 有机化学基础[M]. 北京: 高等教育出版社, 1965: 63~64.
[6]谢希德主编. 科学思想和科学方法[M]. 上海: 上海科学普及出版社, 1999: 104.

