植物生理与生态酵母菌促进铅和镉胁迫下麻疯树生长的研究
方志荣 徐莺 刘庆 陈放

摘要: 为了筛选对铅和镉具有抗性和吸附性的酵母菌,构建麻疯树根系-酵母菌联合修复体系,促进高浓度铅和镉胁迫下麻疯树的生长。该研究分别从麻疯树的根段、珙桐的茎段、珙桐的根段分离到3株具有铅、镉抗性的酵母菌,分别命名为Jc、Di1、Di2,测定了三者对铅、镉的抗性和吸附性,并将筛选出的2株能吸附铅、镉的酵母菌菌株接种到麻疯树幼苗,研究接种两种酵母菌的麻疯树植株对铅、镉胁迫的响应。结果表明:经形态学和生理生化特征观察,Jc初步鉴定红酵母属(Rhodotorula sp.),Di1为假丝酵母属(Candida sp.),Di2为德巴利酵母属(Debaryomyces sp.)。三种酵母菌对铅、镉都有一定的抗性,其抗性能力的大小为Jc>Di2>Di1。Di1和Jc对铅和镉都具有一定的吸附性将其用于接种麻疯树幼苗。与不接种酵母菌(CK)的麻疯树植株相比,接种Di1和Jc的麻疯树植株在根、茎、叶、全株干重方面显著增加,叶绿素、全株氮、全株磷浓度显著增加,SOD、POD、CAT的活性提高,丙二醛(MDA)浓度显著下降。从综合接种效应来看,Jc、Di1作为铅、镉的钝化剂,是铅、镉胁迫下促进麻疯树生长的备选菌株,这对于提高麻疯树对铅、镉污染土壤修复效率具有重要的意义。
关键词: 内生酵母菌, 铅和镉抗性的酵母菌, 促生效应, 植物修复, 麻疯树
中图分类号: Q945.78文獻标识码: A文章编号: 1000-3142(2019)12-1656-10
Abstract: In order to screen yeasts with resistance and adsorption to lead and cadmium, to construct a Jatropha curcas root-yeast phytoremediation system, and to promot the growth of J. curcas under high concentrations of lead and cadmium stresses, in this study, three endophytic yeasts with lead and cadmium resistance were isolated by surface-sterilized methods from the healthy J. curcas root, Davidia involucrata stem, D. involucrata root, named as Jc, Di1, Di2, respectively. The isolate were identified as Rhodotorula sp., Candida sp., Debaryomyces sp. based on morphologic, physiological and biochemical characteristics. They could grow on the PDA medium with a concentration of 500 mg·L-1 Pb(NO2)2 or 50 mg·L-1 CdCl2·2.5 H2O. Rhodotorula sp. (Jc) and Candida sp. (Di1) yeasts with adsorb ability of lead and cadmium were used to inoculate J. curcas seedling to study effects on the growth of J. curcas under cadmium and lead stresses; from morphological, biochemical and physiological characteristics, antioxidase of J. curcas plants inoculated yeasts under lead and cadmium stresses were also measured. The dry weights of J. curcas roots, shoots, leaves and whole plants showed a significant increase when the Rhodotorula sp. (Jc) and Candida sp. (Di1) yeasts were inoculated compared with non-inoculated CK plants. The plant growth-promoting effects of Rhodotorula sp. Jc and Candida sp. Di1 yeasts could be attributed to decreasing concentration of lead and cadmium in root, shoot and leaf; increasing activities of POD, SOD and CAT and concentration of chlorophyll, as well as concentration of nitrogen, phosphate in whole plant; and decreasing the concentration of malondialdehyde (MDA). Therefore, Rhodotorula sp. (Jc ) and Candida sp. (Di1) yeasts may act as passivator of lead and cadmium to promote the growth of J. curcas under lead and cadmium stresses. This study is very important to improve phytoremediation efficiency of lead and cadmium contaminated soil by Jatropha curcas.
Key words: endophytic yeast, lead and cadmium resistance yeasts, growth-promoting effect, phytoremediation,Jatropha curcas
铅和镉是农业和工业活动中释放到环境中的两种最常见的重金属污染物,对植物造成毒性效应影响植物的生长发育,也可通过生物链进入人体,对人体造成伤害,因此铅和镉污染引起了世界的广泛关注(Wong & Selvam,2006;Tchounwou et al., 2012)。污染土壤的植物修复技术与传统的化学、物理修复技术相比,具有非破坏性、安全性、原位性、无二次污染和經济性等优点,在污染土壤修复方面具有广阔的前景。成功的植物修复需要植物具有多种特征,如能生长在重金属污染土地上、快速生长、具有高的生物量、能在易于收获的部分累积重金属等(Bhargava,2012)。
麻疯树(Jatropha curcas)为大戟科麻疯树属植物,是一种分布于美洲、非洲和亚洲热带和亚热带地区的多用途抗旱落叶多年生灌木。麻疯树种子含有30%~35%的油,可以转化为优质和环保的生物柴油,是一种极具潜能的能源作物(Foidl et al.,1996)。此外,研究已经证明麻疯树是一种极好的环境修复植物材料,可用于铅和镉污染土壤的修复(Pandey et al., 2016; Jamil et al.,2009; Mangkoedihardjo, 2008)。然而,高浓度的铅和镉将降低麻疯树生长的速度,减少地上部分的生物量(Liang et al., 2012)。这将降低麻疯树的修复效率,并限制了其在环境修复中的应用。
重金属的微生物修复技术是一种利用微生物代谢功能固定重金属离子或将有毒的重金属离子转化成无毒或低毒状态的修复技术,但由于利用微生物去除土壤重金属的难度大,因而单一应用微生物修复技术的应用范围也受到限制(李韵诗等,2015)。在土壤微生态系统中,植物与根际微生物的作用功能可以结合在一起,由此而建立的植物-微生物联合修复体系,可发挥二者的优势,提高重金属污染土壤的修复效率(李韵诗等,2015)。酵母菌是一类以出芽繁殖为主的无性繁殖单细胞真菌。一些来源于根际和根际周围土壤中的酵母菌如Candida, Rhodotorula, Sporobolomyces, Trichospron, Williosis和Yarrowia能促进植物的生长(Cloete et al.,2009)。此外,一些来源于植物体内的酵母菌Williopsis saturnus, Rhodotorula graminis能产生生长素,促进植物的生长(Nassar et al.,2005;Xin et al., 2009)。Deng et al.( 2012)报道了一株对Cu、Zn、Pb和Cd具有抗性的内生酵母菌株Cryptococcus sp. CBSB78能促进Brassica alboglabra在Zn、Pb和Cd胁迫下的生长。因此,筛选出既对铅、镉具有抗性,又能促进麻疯树生长的酵母菌,对于构建麻疯树-微生物修复体系提高麻疯树对铅、镉污染土壤的修复效率具有重要意义。该研究通过从胁迫环境下生长的植株内分离具有铅、镉抗性的酵母菌,测定其对铅和镉的吸附能力,并将具有铅、镉吸附性的酵母菌接种麻疯树幼苗,观察其对麻疯树生长的影响,筛选出能促进麻疯树生长的酵母菌菌株,并探讨其促生机理,以期为构建麻疯树-酵母菌联合修复体系和提高麻疯树的修复效率提供理论基础和实践用的酵母菌菌株。
1材料与方法
1.1 所用的培养基
1.1.1 分离纯化培养基马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯(去皮)200 g,葡萄糖20 g,琼脂粉20 g,纯化水1 000 mL。
1.1.2 筛选培养基以PDA培养基为基础培养基,在培养基中加入50 mg·L-1的CdCl2·2.5H2O和500 mg·L-1的Pb(NO2)2。
1.1.3 糖-胨-酵培养基葡萄糖20 g,蛋白胨10 g,酵母粉5 g,琼脂20 g,蒸馏水1 000 mL。
1.1.4 抗性培养基以PDA为基础培养基,添加Pb(NO2)2或CdCl2,均为分析纯。培养基铅的浓度梯度为250、500、750、1 000 mg·L-1 [以Pb(NO2)2计],镉的浓度为25、50、75、100 mg·L-1(以CdCl2·2.5H2O计)。
1.1.5 吸附培养基以PDA为基础培养基,添加Pb(NO2)2或CdCl2,均为分析纯。液体培养基铅的浓度为250 mg·L-1 [以Pb(NO2)2计],镉的浓度为50 mg·L-1 (以CdCl2·2.5H2O计),铅、镉混合培养基含250 mg·L-1 Pb和50 mg·L-1 Cd。
1.2 铅、镉吸附菌的筛选、鉴定及抗性测定
1.2.1 酵母菌的分离、纯化以麻疯树两年生健康实生苗、珙桐两年生健康实生苗的根和茎段为材料,材料经自来水冲洗后用0.5%的升汞浸泡3 min,用无菌水漂洗4 次,再用75%的乙醇浸泡1 min,无菌水冲洗数次(邵爱娟, 2001)。把处理过的材料置于筛选培养基内,30 ℃生化培养箱中黑暗培养10 d。试验共设两个空白对照。最后一次漂洗液涂布于PDA培养基平板上作为对照。将表面灭菌处理的茎段、根压入马铃薯葡萄糖培养基平板内,使表面灭菌材料与PDA培养基接触2 min,移去灭菌植物材料作为另一对照(王利娟, 2006)。待组织下或边缘的培养基上长出菌落后,于PDA培养基上采用划线稀释法进行菌种的分离纯化。
1.2.2 酵母菌的鉴定将筛选到的菌株接种在糖-胨-酵培养基上,30 ℃黑暗培养5 d后观察菌落的形态,酵母菌用乳酸酚棉蓝染色液染色后在数码显微摄像系统下观察菌的形态并照相。采用酵母菌微量生化反应管(杭州天和微生物试剂有限公司)反应后进行酵母菌生理生化特征鉴定。
1.2.3 酵母菌铅、镉抗性及吸附性测定试验前,用PDA培养基活化菌种,将供试菌接种到斜面抗性培养基上,每个浓度3个斜面,放入30 ℃生化培养箱中黑暗培养,一周后观察斜面上菌落的生长情况。将三种酵母菌分别接入吸附培养的液体培养基中,同时做空白试验,接菌后的三角瓶放入恒温振荡器中30 ℃, 137 r·min-1振荡培养7 d。试样用硝酸酸化至pH1~2,用中速滤纸过滤,滤液用硝酸和高氯酸消解,消解完成后消解液用火焰原子吸收分光光度法测定铅和镉的浓度。
铅和镉的吸附率采用公式:吸附率(RE)=(初始浓度-终浓度)/初始浓度 × 100%进行计算。
1.3 接种酵母菌的麻疯树幼苗在铅、镉胁迫下的生长
1.3.1 供试土壤试验用土壤采自西昌学院北校区校园内林地边缘表层土壤,其理化性质为pH值6.10(水),有效磷浓度6.29 mg·kg-1,水解性氮浓度170.84 mg·kg-1,有效钾浓度787.16 mg·kg-1,有机质浓度12.34 mg·kg-1,Pb浓度49.7 mg·kg-1,Cd浓度0.94 mg·kg-1 。供试土壤试验前用500 mg·kg-1 Pb [以Pb(NO2)2计]和50 mg·kg-1 Cd(以CdCl2·5H2O 计)(Pb500-Cd50)处理,老化至少两周可移植麻疯树幼苗。
1.3.2 酵母菌的活化及接种采用固体培养基活化菌种后,将活化后的菌接种到PDA液体培养基中,恒温振荡器中振荡培养一周,培养温度30 ℃,转速100 r·min-1,以不接菌的培养基作为对照,摇菌7 d的菌液用于做接菌试验。
将麻疯树种子播种在盛有育苗基质(育苗基质经121 ℃高温高压灭菌2 h)的塑料钵内(种子用1%高锰酸钾浸泡1 h后再用自来水冲洗),每钵5粒种子。菌种培养1周后,用灭菌后的纯水将培养液稀释5倍后,浇灌已经开始萌发的麻疯树种子,每种菌设6个重复,对照用培养过的PDA对照培养基稀释5倍后浇灌。一周后再浇灌一次菌液。幼苗经接种处理30 d后移栽到铅、镉处理后的土壤中。
1.3.3 植株的培养采用盆栽试验法,将接菌后的麻疯树幼苗移栽到Pb500-Cd50处理后的土壤中,每钵3株,每种菌5钵,试验期间根據水分状况适当补充水分。接菌和幼苗培养试验均在人工气候箱内完成,人工气候箱的温度为30 ℃,光照时间为16 h,湿度为50%。
1.3.4 麻疯树幼苗相关生化指标的测定幼苗处理后的30 d采样,每一处理选取6株分为3组,将每组植株的根、茎、叶剪下并测其鲜重,将根、茎、叶分别放入恒温干燥箱105 ℃杀青30 min后于80 ℃烘干,取出分别测其干重。
将每处理烘干后的根、茎、叶分别混合,粉碎过筛后用于氮、磷浓度的测定。磷浓度的测定采用钼锑抗比色法(李会娟,2012);氮浓度的测定采用奈氏比色法(McDonald, 1978)。剩余植株的倒2叶或倒3叶,用于分析其他生理指标。叶绿素浓度的测定采用丙酮乙醇混合提取法(李合生,2003);丙二醛浓度的测定采用硫代巴比妥酸TBA法(李合生,2003);CAT活性的测定采用过氧化氢比色法(Aebi,1984);POD活性的测定采用愈创木酚法(Lagrimini,1991);SOD活性的测定采用氮蓝四唑(NBT)法(Beauchamp & Fridovich,1971);总铅和总镉浓度的测定采用原子吸收分光光度法(张辉和唐杰,2011)。
2结果与分析
2.1 铅、镉吸附菌的筛选、鉴定、抗性测定
本研究从初筛培养基中共筛选出三种酵母菌。三种酵母菌分别来自于麻疯树的根段(暂命名为Jc)、珙桐的茎段(暂命名为Di1)、珙桐的根段(暂命名为Di2)。
2.1.1 铅、镉吸附酵母菌的鉴定
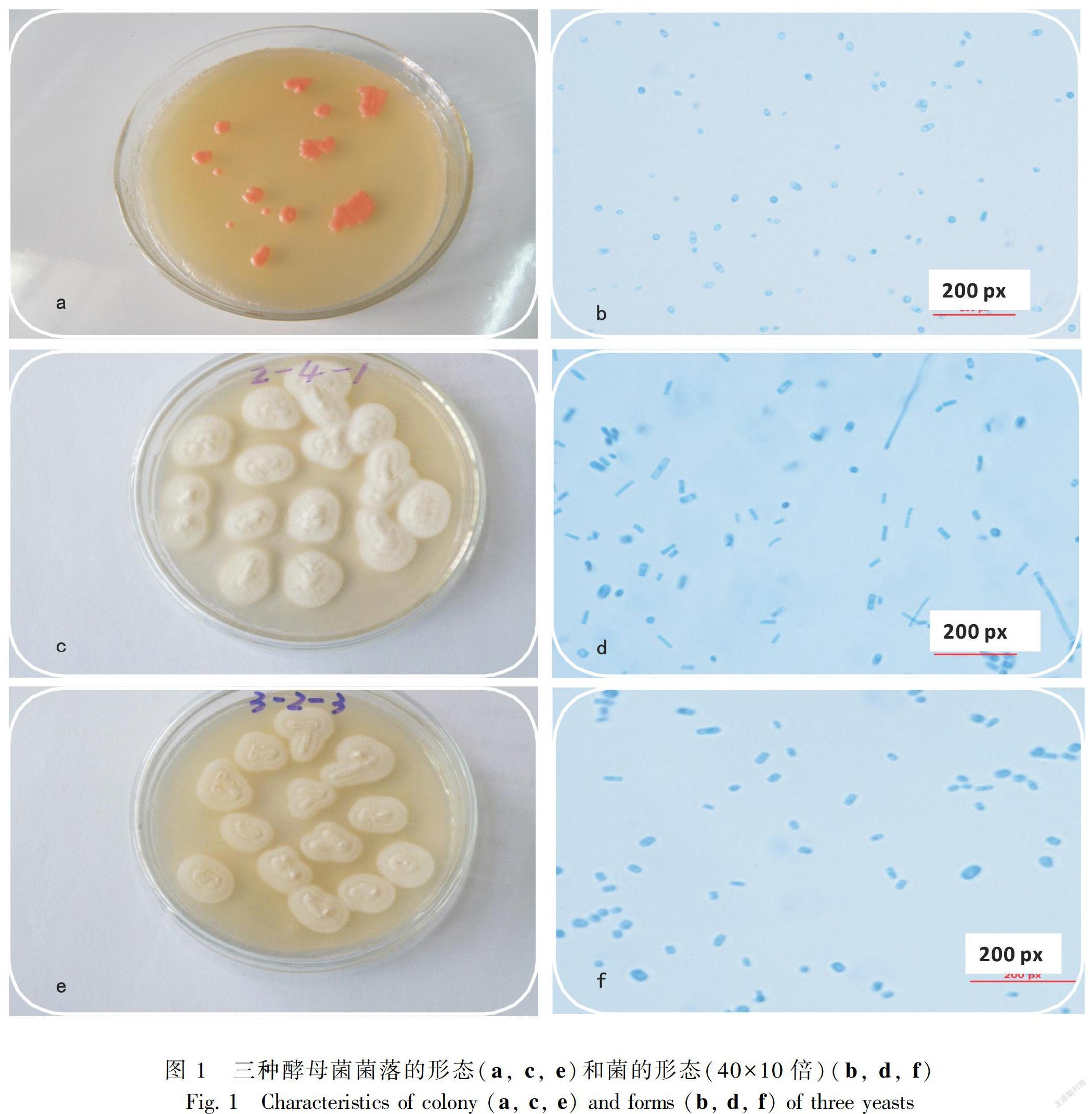
2.1.1.1 形态学特征Jc菌落表面成粉红色,表面湿润粘稠(图1:a),此菌在显微镜下呈蓝色椭圆状(图1:b),经初步观察,初步鉴定属于红酵母属,形状为圆形或椭圆状,菌落呈红色。Di1菌落表面呈纯白色,菌落中间有凸起,表面呈绒毛状(图1:c),此菌在显微镜下呈蓝色长椭圆形(图1:d)。Di2菌落表面呈乳白色,粉质状(图1:e),此菌在显微镜下呈蓝色椭圆状(图1:f)。
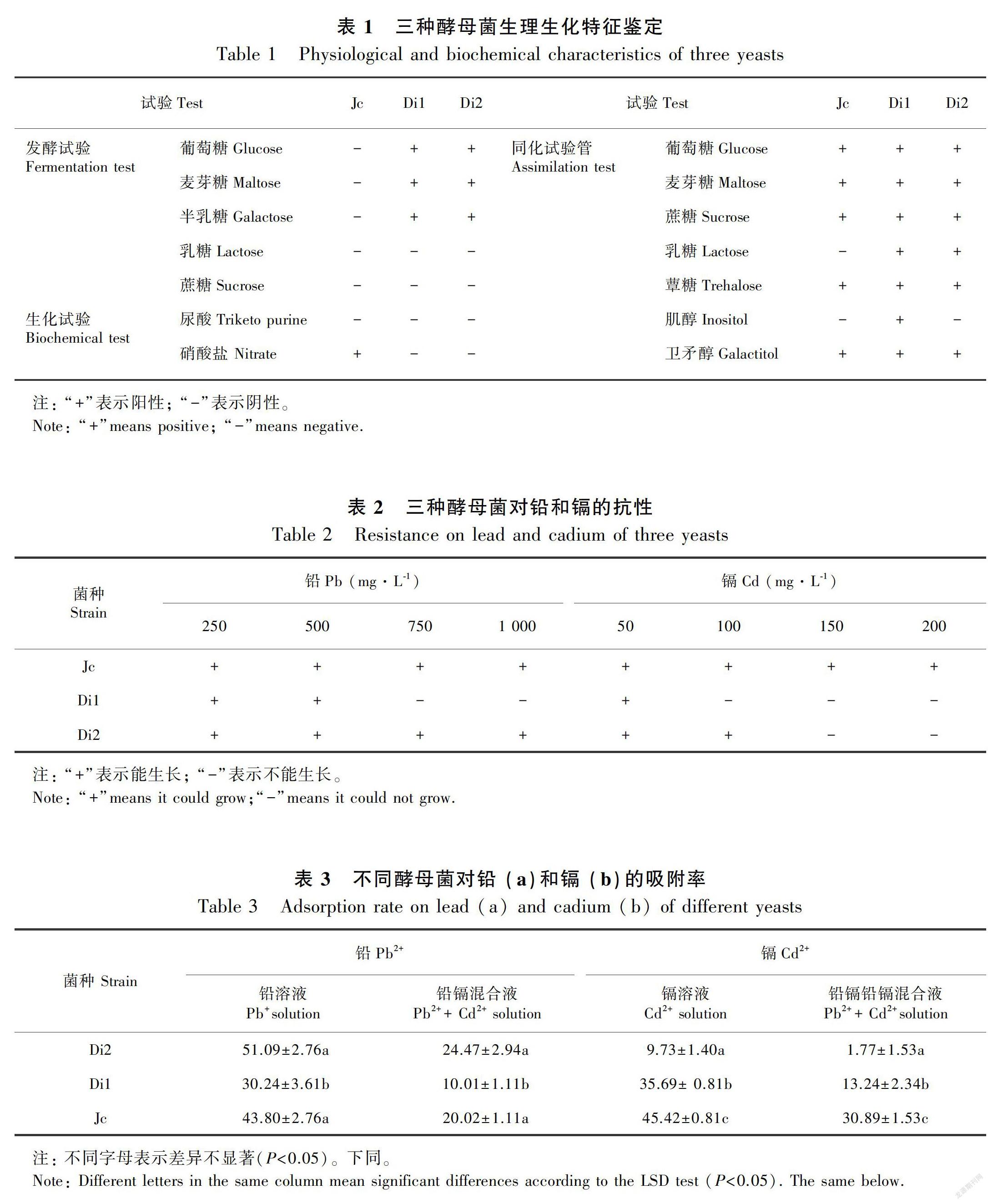
2.1.1.2 生化特征鉴定利用酵母菌微量生化反应管对三种酵母菌进行生理生化特征鉴定,参照《酵母菌的特征与鉴定手册》(胡瑞卿,1990),通过形态学和生理生化特征的分析,鉴定的结果见表1。Jc初步鉴定为红酵母属(Rhodotorula sp.)的流散红酵母,Di1为假丝酵母属(Candida sp.)的烃延胡索酸假丝酵母,Di2为德巴利酵母属(Debaryomyces sp.)的卡斯特德巴利酵母。
2.1.2 三种酵母菌对铅、镉的抗性分析由表2可知,三种酵母菌均能在500 mg·L-1 Pb 和50 mg·L-1 Cd下生长。其中Jc的铅和镉的抗性最强,分别能在1 000 mg·L-1 Pb和200 mg·L-1 Cd下生长。Di2 能在1 000 mg·L-1 Pb和100 mg·L-1 Cd下生长。结果表明,三种酵母菌对铅、镉都有一定的抗性,其抗性能力的大小为Jc>Di2>Di1。
2.1.3 三种酵母菌对铅、镉吸附性的分析三种酵母菌对铅和镉均有一定的吸附性。Di2和Jc对铅有较高的吸附率,Di1吸附铅的量与Di2和Jc存在明显差异(表3)。Di2 虽然能在50 mg·L-1 Cd2+,或250 mg·L-1 Pb和50 mg·L-1 Cd的液体培养基中生长,但是对Cd的吸附率非常低,在混合培养液中几乎不能吸附Cd。Di1和Jc对Cd、Pb具有一定的吸附性,Jc对Cd的吸附性明显高于Di1对Cd的吸附性,二者对Pb的吸附性无显著差异(表3)。铅、镉吸附性的研究结果表明:Jc和Di1对铅和镉都具有一定的吸附性,而Di2对Cd的吸附性几乎为0。因此本试验筛选出Di1和Jc作为菌种,接种到麻疯树幼苗中,并做盆栽观察接种两种酵母菌后的麻疯树植株对铅、镉胁迫的响应。
2.2 接种酵母菌的麻疯树植株在铅、镉胁迫下的生长情况
2.2.1 不同接菌处理对麻疯树植株生物量的影响
麻疯树植株经Di1和Jc接菌处理后, 其鲜重图 1三种酵母菌菌落的形态(a, c, e)和菌的形态(40×10倍)(b, d, f)和干重的变化见表4。与不接种酵母菌(CK)的麻疯树植株相比,接种Di1和 Jc的麻疯树植株根、茎、叶、全株鲜重显著增加,在接种Di1和 Jc 后根鲜重分别提高了29%和35%;茎鲜重分别提高了38%和47%;叶鲜重分别提高了74%和78%;全株鲜重分别提高了49%和56%。
与不接种酵母菌(CK)的麻疯树相比,接种Di1和Jc的麻疯树植株根、茎、叶、全株干重显著增加,在接种Di1和Jc后根干重分别提高了8%和27%;茎干重分别提高了30%和39%;叶干重分别提高了32%和55%;全株干重分别提高了29%和44%。这说明接种Di1和Jc后促进了铅、镉胁迫下麻疯树的生长。
2.2.2 不同接菌处理对麻疯树植株叶绿素及氮和磷浓度的影响接种Di1和Jc后的麻疯树植株叶绿素a、叶绿素b、叶绿素a+b及胡萝卜素浓度显著增加(表4), 在接种Di1和 Jc后植株叶片叶绿素a的浓度分别提高了46.3%和46.8%;叶绿素b的浓度分别提高了66%和55%;叶绿素a+b 的浓度分别提高了50%和48%;类胡萝卜素的浓度分别提高了28%和44%;同时由于叶绿素b浓度增加的比例增大,导致叶绿素/类胡萝卜素分别增加了8.5%和4.4%;叶绿素a/叶绿素b分别下降了9.7%和13.6%。
接种Di1和Jc后的麻疯树植株根、茎、叶和全株中氮和磷的浓度显著增加(表4)。在接种Di1和 Jc 后氮的浓度在根中分别增加了36.7%和86.9%;茎中分别增加了18.8%和62.5%;叶中分别增加了20.7%和64.6%;全株分别增加了57.8%和145.2%。在接种Di1和 Jc 后磷的浓度在根中分别增加了35.9%和60.7%;茎中分别增加了46.1%和63.3%;叶中分别增加了5.5%和6.3%;全株分别增加了56.3%和86.7%。
2.2.3 不同接菌处理对麻疯树植株铅和镉浓度的影响接种Di1和Jc后的麻疯树植株根、茎、叶中铅和镉的浓度显著降低(表4)。接种Di1和 Jc 后铅的浓度在麻疯树根中分别减少了20.1%和27.9%;茎中分别减少了22.5%和25.9%;叶中分别减少了33.5%和34.3%。接种Di1和 Jc 后镉的浓度在麻疯树根中分别减少了23.9%和29.5%;茎中分别减少了18.8%和25.2%;叶中分别减少了31.5%和33.5%。但接种Di1和Jc后的麻疯树全株中铅和镉的浓度与对照相比无显著差异。
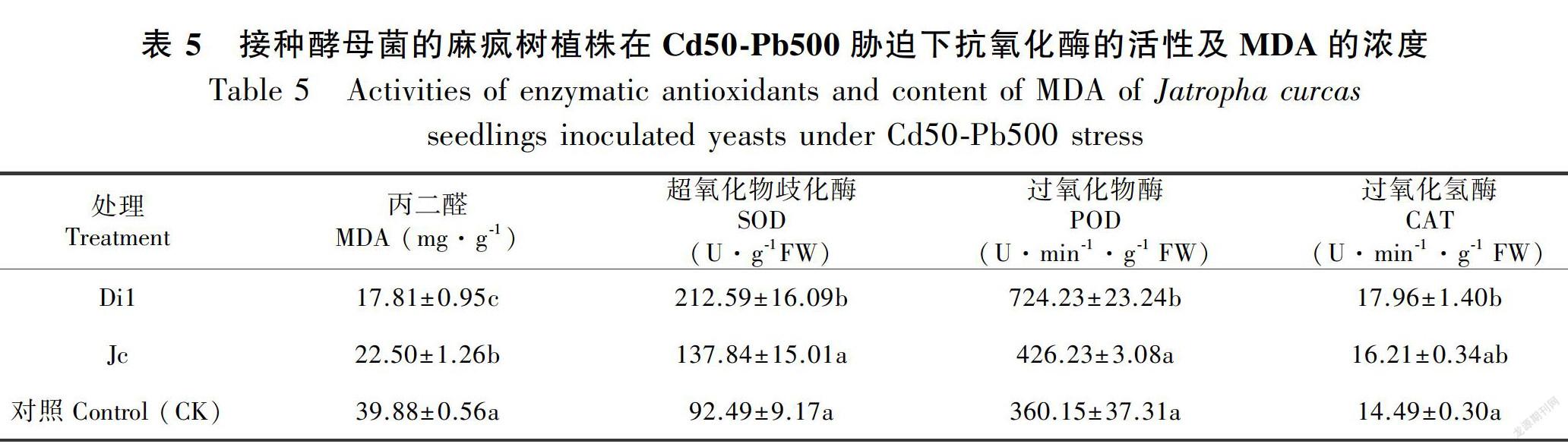
2.2.4 不同接菌处理对麻疯树植株酶和非酶的抗氧化物质的影响经Di1和Jc接菌处理的麻疯树提高了抗氧化酶SOD、POD、CAT的活性,Di1接种后的麻疯树与对照相比,三种抗氧化酶的活性均显著提高,脂过氧化产物丙二醛的浓度显著降低(表5)。在接种Di1和 Jc 后植株叶中丙二醛的浓度分别下降了55.34%和43.59%;过氧化氢酶CAT 的活性分别提高了23.9%和11.8%;过氧化物酶POD的活性分别提高了10.8%和18.3%;超氧化物歧化酶SOD的活性分别提高了129.8%和49.0%。接种Di1对后麻疯树的抗氧化性明显提高,尤其是SOD的活性,比对照增加了1.29倍。
3讨论与结论
复合污染Cd50-Pb500对麻疯树表现出毒性效应,抑制了麻疯树的生长,降低了根、茎、叶的鲜重和干重(Liang et al., 2012)。本研究中,我们发现与不接种酵母菌的麻疯树相比,接种Di1和 Jc的麻疯树植株根干(鲜)重、茎干(鲜)重、叶干(鲜)重、全株干(鲜)重显著增加,说明接种Di1和 Jc菌后减弱了复合污染Cd50-Pb500对麻疯树的毒性,促进了麻疯树植株的生长。麻疯树植株铅和镉浓度测定的结果表明:接种Di1和 Jc菌后,麻疯树植株根、茎、叶中铅和镉的浓度显著低于对照,但是由于根、茎、叶的干重增加,接菌后麻疯树植株全株铅镉浓度与对照并无显著差异。通过进一步的研究,我们发现Di1和 Jc菌并没有侵染到麻疯树幼苗的根内,但由于在幼苗移栽的過程中根部带有少量的育苗基质(Di1和 Jc菌作为麻疯树的根际菌而被转移到铅、镉污染的土壤),因此Di1和 Jc菌可能作为优良的铅和镉的钝化剂,使铅和镉在土壤中沉淀或被吸附固定,改变土壤中铅、镉的存在状态,“钝化”其生物有效性,从而降低麻疯树对铅、镉的吸收,促进麻疯树的生长。植物促生细菌作为优良的重金属钝化剂,可以改变根际微环境中重金属元素生物有效性,促进植物生长,调控植物对重金属的吸收和富集效率(Babu et al., 2015;韩辉等,2019)。因此Di1和 Jc菌亦可作为铅和镉的钝化剂,阻控作物吸收重金属,促进作物生长。
氮和磷是植物必需的两种大量元素,铅和镉对植物的毒性还包括导致氮和磷的吸收、转运受阻,植物体中的氮和磷吸收减少(Ramón et al.,2003;Kibria et al.,2009;Farouk et al.,2011)。接种Di1和 Jc菌后,由于其对麻疯树周围土壤铅和镉的钝化,减弱了其对麻疯树植株的毒害效应,麻疯树植株对氮和磷的吸收、转运增加。因此,与对照相比,接种Di1和Jc后麻疯树植株根、茎、叶和全株中氮和磷的浓度显著增加。
铅和镉的毒性效应还表现在通过诱导氧自由基产生或通过降低抗氧化酶的活性,产生氧化性压力(Benavides et al., 2005; 王马勃等,2019),破坏细胞壁、质膜、线粒体和叶绿体等细胞器(Liang et al., 2012)。活性氧自由基包括超氧自由基(O2·)或(OH·)是植物正常代谢的一种副产物,正常植物能产生一种抗氧化系统来清除这些自由基。但是当植物受到胁迫的时候,这些自由基就会增多。活性氧的累积是由于ROS的产生和ROS清除的平衡的改变而引起的(Mittler, 2002)。丙二醛(MDA),是不饱和脂肪酸氧化的最终产物,其浓度常常作为脂过氧氧化损伤程度的标志(Zhang et al., 2009)。麻疯树作为铅镉的抗性植物,可以通过提高抗氧化酶SOD、POD、CAT的活性清除自由基来提高对铅镉的抗性,但高浓度的铅镉如Cd50-Pb500胁迫下,抗氧化酶SOD、POD、CAT的活性相比较于Cd50 和 Pb500 处理反而有所下降(Liang et al., 2012)。与对照相比,经Di1和Jc接菌处理的麻疯树叶片中铅和镉的浓度显著下降,减弱了铅镉对麻疯树叶片的氧化性损伤,同时抗氧化酶SOD、POD、CAT的活性显著提高,清除了更多的自由基,说明Di1和Jc接菌处理的麻疯树叶片体内的自由基减少,自由基对植物的氧化性损伤降低,可由丙二醛的浓度显著下降反应出来。
复合污染Cd50-Pb500对麻疯树的毒性效应还表现在显著降低了光合色素的浓度,其中叶绿素b下降程度更为明显,导致叶绿素a/叶绿素b增加,叶绿素/类胡萝卜素比例下降(Liang et al., 2012)。与对照相比,经Di1和Jc接菌处理的麻疯树叶片中叶绿素a和叶绿素b浓度显著增加、叶绿素a/叶绿素b显著下降、叶绿素/类胡萝卜素比例增加。经Di1和Jc接菌处理的麻疯树叶片中叶绿素浓度增加可能是由于增加了植株对氮元素的吸收(Farouk et al., 2011)。
该研究从珙桐的茎段和麻疯树的根部分离出了两种对铅镉具有吸附效应的酵母菌Rhodotorula sp. (Jc)和 Candida sp. (Di1),这两种酵母菌可以与麻疯树根系以及土壤形成特殊根际微环境,降低土壤中铅和镉生物有效性,减弱高浓度铅和镉复合污染对麻疯树植株的毒性效应,促进了麻疯树的生长,增加了麻疯树在重金属修复方面的应用前景。
参考文献:
AEBI H, 1984. Catalase in vitro [J]. Method Enzymol, 105: 121-126.
BABU AG, SHEA PJ, SUDHAKAR D, et al., 2015. Potential use of Pseudomonas koreensis AGB-1 in association with Miscanthus sinensis to remediate heavy metal(loid)-contaminated mining site soil [J]. J Environ Manag, 151: 160-166.
BEAUCHAMP C, FRIDOVICH I, 1971. Superoxide dismutase: Improved assays and an assay applicable to acrylamide gels [J]. Anal Biochem, 44(1):276-287.
BENAVIDES MP, GALLEGO SM, TOMARO ML, 2005. Cadmium toxicity in plants [J]. Braz J Plant Physiol, 17(1): 21-34.
BHARGAVA A, CARMONA FF, BHARGAVA M, et al., 2012. Approaches for enhanced phytoextraction of heavy metals [J]. J Environ Manag, 105:103-20.
CLOETE KJ, VALENTINE AJ,STANDER MA, et al., 2009. Evidence of symbiosis between the soil yeast Crytococcus laurentii and as clerophyllous medicinal shrub,Agathosma betulina (Berg.) Pillans [J]. Microb Ecol, 57:624-632.
DENG Z, WANG W, TAN H, et al., 2012. Characterization of heavy metal-resistant endophytic yeast Cryptococcus sp. CBSB78 from rapes ( Brassica chinensis ) and its potential in promoting the growth of Brassica spp. in metal-contaminated soils [J]. Water Air Soil Poll, 223:5321-5329
FAROUK S, MOSA A, TAHA A, et al., 2011. Protective effect of humic acid and chitosan on radish (Raphanus sativus L. var. sativus) plants subjected to cadmium stress [J]. J Stress Physiol Biochem, 7(2):99-116
FOIDL N, FOIDL G, SANCHEZ M, et al.,1996. Jatropha curcas L. as a source for the production of biofuel in Nicaragua [J]. Bioresour Technol, 58(1):77-82.
GREB B, OLSEN S, 1967. Organic phosphorus in calcareous Colorado soils [J]. Soil Sci Soc Am J, 31(1):85-89.
HAN H, WANG XY, CAI H, et al., 2019. Isolated of heavy metal immobilized and plant growth-promoting bacteria and its effects on reducing heavy metal accumulation in wheat [J]. Environ Sci, 7:1-15. [韓辉,王晓宇,蔡红,等,2019. 重金属固定植物促生细菌的筛选及其阻控小麦富集重金属效应 [J]. 环境科学, 7: 1-15.]
HU RQ,1983.Yeasts: Characteristics and identification [M]. Qingdao: Qingdao Ocean University Press: 34;36;45;76-79; 112-115;164-167. [胡瑞卿, 1990. 酵母菌的特征与鉴定手册 [M]. 青岛:青岛海洋大学出版社:34;36;45; 76-79;112-115;164-167.]
JAMIL S, ABHILASH PC, SINGH N, et al., 2009. Jatropha curcas: A potential crop for phytoremediation of coal fly ash [J]. J Hazard Mater, 172(1):269-75.
KIBRIA MG , ISLAM M , OSMAN KT, 2009. Effects of lead on growth and mineral nutrition of Amaranthus gangeticus L. and Amaranthus oleracea L. [J]. Soil Environ, 28(1): 1-6.
LAGRIMINI LM, 1991.Wound-induced deposition of polyphenols in transgenic plants overexpressing peroxidase [J]. Plant Physiol, 96(2):577-83.
LI HJ, 2012. Comparative study on determination of phosphorus content in two kinds of plants [J]. Mod Agric Sci Technol, 11:16-17 [李会娟, 2012. 2种植物磷浓度的检测方法比较研究 [J]. 现代农业科技, 11:16-17.]
LI HS, 2000.The principle and measuring technique of plant physiology and chemistry [M]. Beijing: Beijing Higher Education Press:134-137;195-197;260-261. [李合生, 2000. 植物生理生化實验原理和技术 [M]. 北京:北京高等教育出版社:134-137;195-197;260-261.]
LIANG J, YANG ZH, TAN L, et al., 2012. Growth performance and tolerance responses of jatropha (Jatropha curcas) seedling subjected to isolated or combined cadmium and lead stresses [J]. Int J Agric Biol, 14: 861-869.
LI YS, FENG CL, WU XF, et al., 2015. A review on the functions of microorganisms in the phytoremediation of heavy metal-contaminated soils [J]. Acta Ecol, 35(20): 6881-6890. [李韵诗, 冯冲凌, 吴晓芙, 等, 2015. 重金属污染土壤植物修复中的微生物功能研究进展 [J]. 生态学报, 35(20):6881-6890.]
MANGKOEDIHARDJO S, 2008. Jatropha curcas L. for phytoremediation of lead and cadmium polluted soil [J]. World Appl Sci J, 4(4):519-522.
MCDONALD M, 1978. A simple and improved method for the determination of microgram quantities of nitrogen in plant material [J]. Ann Bot, 42(2):363-366.
MITTLER R, 2002. Oxidative stress, antioxidants and stress tolerance [J]. Trends Plant Sci, 7(9):405-10.
NASSAR AH, EL-TARABILY KA, SIVASITHAMPARAM K, 2005. Promotion of plant growth by an auxin-producing isolate of the yeast Williopsis saturnus endophytic in maize Zea mays L.) roots [J]. Biol Fert Soils, 42: 97-108.
PANDEY VC, BAJPAI O, SINGH N, 2016. Energy crops in sustainable phytoremediation [J]. Renew Sust Energ Rev, 54:58-73.
RAMON OC, SAUL V, ESTEBAN E, et al., 2003. Cadmium-stress in white lupine: Effect on nodule structure and function [J]. Plant Physiol, 161: 911-919.
SHAO AJ, LIN SF, ZHANG SJ, et al., 2001. Isolation of a kind of endophytic fungus which can produce toxol compounds [J]. Acta Acad Med Sin, 23(6):642-644. [邵爱娟, 林淑芳, 张思巨, 等, 2001. 一种能产生紫杉醇类化合物内生真菌的分离 [J]. 中国医学科学院学报, 23(6):642-644.]
TCHOUNWOU PB, YEDJOU CG, PALLOLLA AK, et al., 2012. Heavy metal toxicity and the environment [J]. Exp Suppl, 101: 133-164
WANG LJ, HE XS, 2006. Research methods of the isolation and sublimation of plant endophytical fungi [J]. J Microbiol, 26 (4): 55-60. [王利娟, 賀新生, 2006. 植物内生真菌分离培养的研究方法 [J]. 微生物学杂志, 26 (4): 55-60.]
WANG MB, CHAO JG, GU W, et al., 2019. Changes of physiological indexes,photosynthetic parameters and biomass of Atractylodes lancea(Thunb.)DC. under lead stress [J]. J S Agric, 50(1): 32-39. [王马勃, 巢建国, 谷巍, 等, 2019. 铅胁迫下茅苍术生理指标、光合参数及 生物量的变化 [J]. 南方农业学报, 50(1): 32-39.]
WONG JWC, SELVAM A, 2006. Speciation of heavy metals during co-composting of sewage sludge with lime [J]. Chemosphere, 63: 980-986.
XIN G, GLAWE D, DOTY SL, 2009. Characterization of three endophytic, indole-3-acetic acid-producing yeasts occurring in Populus trees [J]. Mycolog Res, 11(3): 973-980.
ZHANG H, TANG J, 2011. Determination of Fe, Mn, Cu, Pb and Cd in vegetables by atomic absorption spectrometry [J]. Chin J Spectrosc Lab, 28(1):72-74 [张辉, 唐杰, 2011. 原子吸收光谱法测定蔬菜中的铁、锰、铜、铅和镉 [J]. 光谱实验室, 28(1):72-74.]
ZHANG SS, ZHANG HM, QIN R, et al., 2009. Cadmium induction of lipid peroxidation and effects on root tip cells and antioxidant enzyme activities in Vicia faba L. [J]. Ecotoxicology, 18(7):814-823.

