30种滇西植物β-羟高铁血红素形成抑制活性
肖朝江 沈怡 徐伟 刘子琦 彭俊霖 张小东 董相 姜北


摘 要: 疟疾是严重危害人类健康的寄生虫病之一,据世界卫生组织报道每年有数十万人因疟疾而死亡,我国疟疾防治工作虽然取得了长足发展,但在中国云南边境地区和中国西藏林芝地区本地疟疾病例依然存在,再加上西藏自治区和云南省地理位置特殊,与周边疟疾高发的国家接壤,边民来往十分频繁,传染源输入无法杜绝。为了发现植物来源的新型抗疟疾天然产物,该研究依次用75%乙醇和蒸馏水对30种滇西植物进行回流提取,并采用β-羟高铁血红素形成抑制实验对这些样品进行抗疟活性筛选。结果表明:在供试的30种植物中,玉叶金花、回心草以及云南甘草等19种植物粗提物具有不同程度的β-羟高铁血红素形成抑制活性,具有抗疟活性的植物种类涉及17个科、19个属。其中,虾子花、东方紫金牛、姜花水提物以及反瓣老鹳草地下部分醇提物的活性较好,其IC50值分别为796.0、951.0、1 033.0、1 388.9 μg·mL-1,值得进一步深入研究。虾子花、东方紫金牛的HPLC分析结果显示,其活性成分应为酚性成分。
关键词: 滇西, 植物, 抗疟活性, β-羟高铁血红素形成抑制实验, HPLC
中图分类号: Q946, R285.5 文献标识码: A 文章编号: 1000-3142(2019)07-0863-10
Abstract: Malaria is a parasitic disease that seriously endangers human health. According to the world health organization, hundreds of thousands of people died due to malaria each year. Although the prevention and treatment of malaria in China has made great progress, the local malaria cases still exist in the border areas of Yunnan and Nyingchi of Tibet, China. In addition to the special geographical locations of Tibet and Yunnan, China shares borders with neighboring countries with high incidence of malaria, and the border residents have frequent contacts, so the source of infection cannot be eliminated. Therefore, the situation of malaria prevention and control in China is still not optimistic. To explore the novel antimalarial natural products from plant, thirty plants from West Yunnan were extracted by reflux method with 75% ethanol and water, successively. Then the antimalarial activities of the samples were tested by β-hematin formation inhibition assay. As a result, Mussaenda pubescens, Rhodobryum roseum, Glycyrrhiza pallidiflora and other 19 testing samples showed β-hematin formation inhibition activity in different degrees, which came from 17 families and 19 genera. Among the active samples, the water extracts of Woodfordia fruticosa, Ardisia elliptica and Hedychium coronarium, as well as the ethanol extract of Geranium refractum, showed significant inhibition activities with the IC50 values of 796.0, 951.0, 1 033.0, 1 388.9 μg·mL-1, respectively. HPLC analysis of Woodfordia fruticosa and Ardisia elliptica indicated that their active components should be phenolic constituents.
Key words: West Yunnan, plants, anti-malarial activity, β-hematin formation inhibition assay, HPLC
瘧疾是一种由疟原虫引起的严重危害人类健康的疾病之一。据世界卫生组织(WHO)统计,全世界91个疟疾流行国家和地区2016年共有2.16亿疟疾病例,因疟疾死亡人数达44.5万。其中,90%的疟疾病例和91%的死亡病例发生在撒哈拉以南的非洲地区,7%的疟疾病例和6%的死亡病例发生在东南亚地区(World Health Organization, 2017a)。另外,2014年全球疟疾病例为2.1亿例,2015年为2.11亿例,2016年为2.16亿例,明显呈现逐年上升的趋势(World Health Organization, 2017a)。在我国,经过几代人的努力,从建国初期疟疾发病人数高达3 000万例到2016年的3 321例来看,我国疟疾防治工作取得了显著成效(张丽等, 2017)。虽然我国疟疾防治工作取得了长足发展,并且2016年99.9%的疟疾病例为境外输入性病例,但在云南边境地区和西藏林芝地区本地疟疾病例依然存在(张丽等, 2017)。加上中国的西藏自治区和云南省地理位置特殊,与印度、尼泊尔、缅甸和越南等周边疟疾高发的南亚、东南亚国家接壤,边民来往十分频繁,传染源输入无法杜绝。因此,我国疟疾防控形势依然不容乐观。
目前,临床用于治疗疟疾的药物主要为奎宁和青蒿素两类(World Health Organization, 2010, 2015)。由于长期使用氯喹和青蒿素,其疟原虫抗药株已逐步显现(Imwong et al., 2017; Price et al., 2014; World Health Organization, 2017b)。因此,研发新一代抗疟药物对疟原虫病防治工作意义重大。研究发现,游离血红素对疟原虫有毒性,疟原虫通过将血红素转换成疟原虫色素(β-羟高铁血红素)的方式解毒(Orjih et al., 1981; Pagola et al., 2000; Slater et al., 1991)。与此同时,奎宁等红内期抗疟药可与血红素络合从而抑制β-羟高铁血红素形成,成为红内期抗疟药物的作用靶点之一(Chong & Sullivan Jr, 2003)。因此,本研究采用β-羟高铁血红素形成抑制实验对30种滇西植物进行抗疟活性筛选,并对活性较好的植物样品进行初步的HPLC分析,以期能发现若干种活性较强的植物,为寻找和开发继奎宁、青蒿素之后的第三代植物来源的新型抗疟天然产物奠定基础。
1 材料与方法
1.1 试剂和仪器
试剂:氯高铁血红素、氯喹二磷酸盐、HEPES均购于美国Sigma公司;吡啶、冰醋酸均购于上海申博化工有限公司;乙酸钠购于国药集团化学试剂有限公司;二甲基亚砜购于天津化学试剂有限公司;色谱甲醇购于Fisher Chemical公司;HPLC用水为市售娃哈哈矿泉水。
仪器:BioTek Synergy HT多功能酶标仪为美国BioTek仪器公司生产;MCO-18AIC CO2培养箱为日本三洋公司生产;AL204电子天平为梅特勒-托利多仪器(上海)有限公司生产;EYELA FDU-2100冷冻干燥机为日本东京理化器械株式会社生产;RE-5205旋转蒸发器为上海亚荣生化仪器厂生产;Agilent 1260高效液相色谱仪为美国安捷伦科技有限公司生产。
1.2 植物样品
30种植物样品(表1)均于2013年采自滇西地区,由大理大学药学与化学学院生药教研室张德全博士鉴定,植物标本均存放于大理大学药学与化学学院姜北教授研究组。
1.3 植物提取物的制备
取约50 g干燥的植物样品粉碎,依次用75%乙醇、蒸馏水热回流提取。处理过程:(1)用75%乙醇回流提取3次(每次250 mL),将3次提取的溶液合并后在50 ℃下用旋转蒸发器除去大部分溶剂,之后转移至冷冻干燥机上充分干燥。(2)经75%乙醇提取过的植物残渣继续用蒸馏水回流提取3次,合并提取液蒸馏近干,之后转移至冷冻干燥机上充分干燥。(3)精密称取上述植物提取物浸膏干粉5.0 mg,以1 mL蒸馏水溶解得相应溶液,之后用水按比例(1∶4)稀释成系列浓度溶液备用。植物提取率以冻干粉重量除以提取植物样品干重后乘以100%计算。
1.4 β-羟高铁血红素形成抑制实验
参照肖朝江等(2014)对30种滇西植物进行β-羟高铁血红素形成抑制活性测试的方法。将50 μL不同浓度的供试样品和50 μL氯高铁血红素储备液(1.0 mmol·mL-1,溶解于DMSO中)混合于96孔板中,一式3份;同时,设置蒸馏水阴性对照和氯喹二磷酸盐阳性对照。之后每孔加入80 μL的醋酸盐缓冲液(4 mol·mL-1,pH 5.0),置于50 ℃培养箱中孵育5 h;取出待室温后,每孔加入100 μL 30%(v/v)的吡啶-HEPES溶液(20 mmol·mL-1,pH 7.5)使微孔板中固体混悬;室温放置待未反应的羟高铁血红素溶解完全后,从每孔中精密移取50 μL上清液至另一96孔板中,之后均以200 μL上述吡啶-HEPES溶液稀释,并于405 nm波长处测定吸光值。由羟高铁血红素标准曲线得出未反应的羟高铁血红素的浓度,从而计算出供试品对β-羟高铁血红素形成的抑制浓度(以IC50表示)。
1.5 HPLC分析方法
色谱柱为phenomenex C18 (250 mm×4.60 mm, 5 μm),检测波长220 nm,体积流量1 mL·min-1,进样量20 μL,柱温30 ℃。虾子花提取物洗脱程序:水(A)-甲醇(B):0~40 min,0%~35% B;40~50 min,35%~70% B;50~60 min,70%~100% B;60~70 min,100% B。东方紫金牛提取物洗脱程序:水(A)-甲醇(B):0~30 min,0%~25% B;30~40 min,25%~50% B;40~50 min,50%~60% B;50~60 min,60%~100% B。
2 结果与分析
热回流提取实验(表1)表明,30种滇西产植物75%乙醇的平均提取率为21.7%,最高为39.0%(高河菜);水的平均提取率为5.1%,最高为9.2%(拔毒散)。
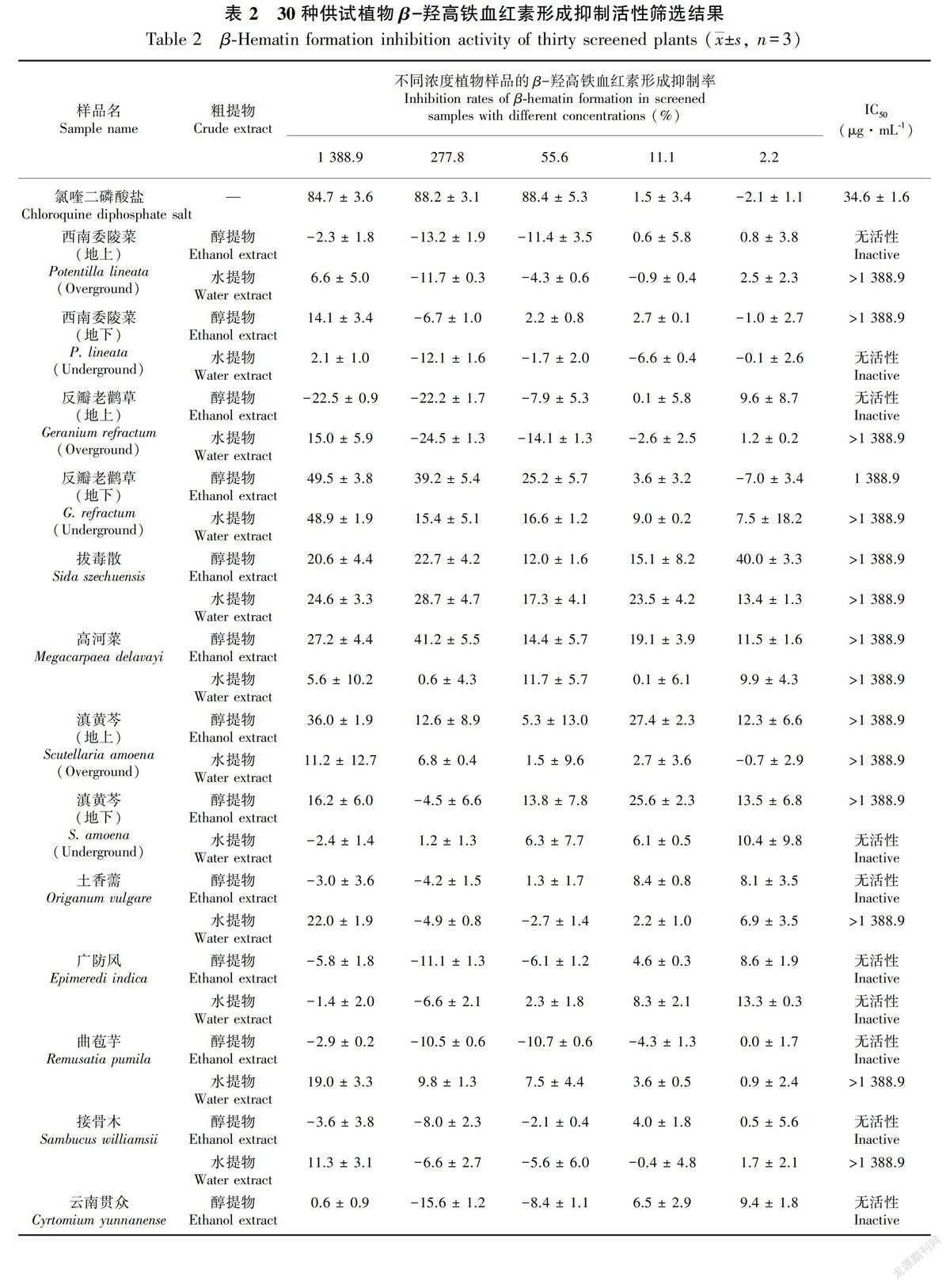
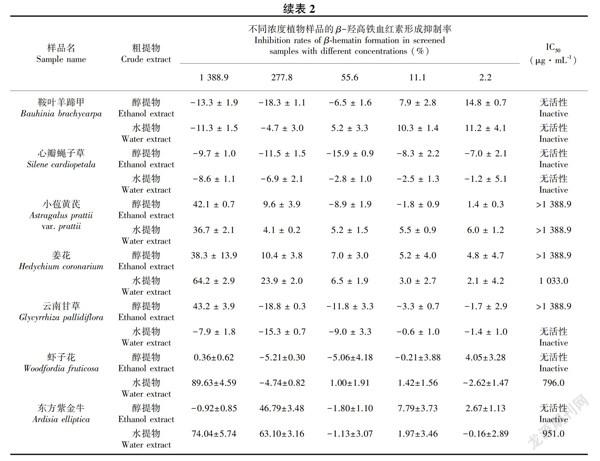
抗疟活性筛选结果(表2)表明,30种滇西植物中虾子花、东方紫金牛、姜花、反瓣老鹳草、拔毒散、高河菜、滇黄芩、土香薷、曲苞芋、接骨木、云南贯众、四翅月见草、西南委陵菜、玉叶金花、木芙蓉、回心草、瑞香狼毒、小苞黄芪和云南甘草19种植物具有不同程度的β-羟高铁血红素形成抑制活性。其中,虾子花、东方紫金牛、姜花水提物以及反瓣老鹳草地下部分醇提物的活性较好,其IC50值分别为796.0、951.0、1 033.0、1 388.9 μg·mL-1。此外,本實验筛选出来的活性植物涉及千屈菜科、紫金牛科、牻牛儿苗科等17个科,虾子花属、老鹳草属等19个属。
运用SPSS统计软件(版本19.0)进行两独立样本均数比较的t检验,玉叶金花和回心草水提物以及云南甘草醇提物与阳性对照氯喹二磷酸盐对β-羟高铁血红素形成抑制活性差异具有统计学意义(P < 0.01)。
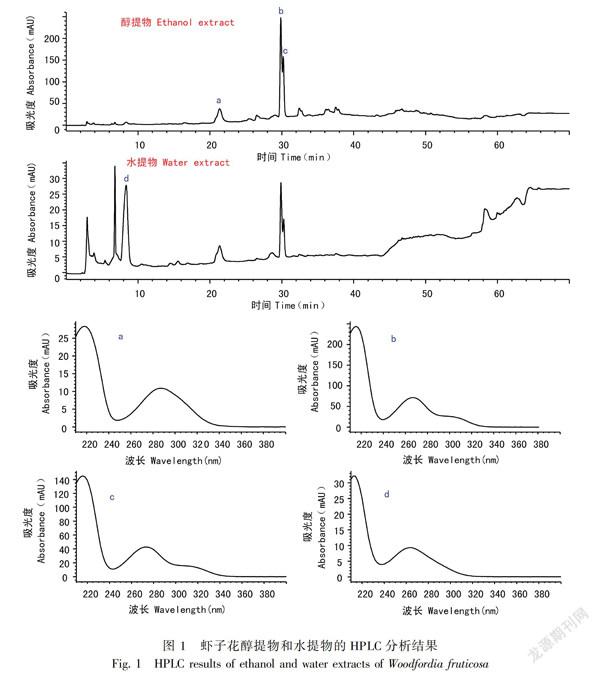
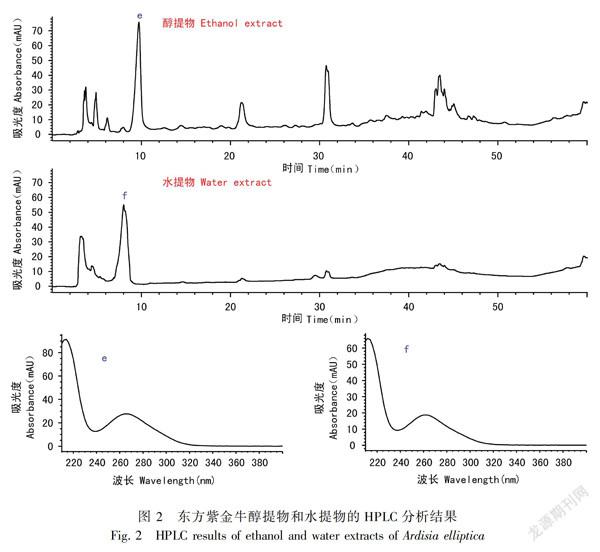
兩种活性较好的植物样品虾子花、东方紫金牛乙醇提取物、水提物的HPLC分析结果如图1和图2所示。根据图1和图2两个样品谱图中主要成分a-f峰的相关在线UV谱图,其为酚性成分的可能性极大,这与两种植物化学成分的研究报道结果相一致(Das et al., 2007; Mishra & Aeri, 2017; Okuda et al., 2006)。同时,鉴于两种植物样品水提物表现出较好的活性,d、f两个峰应为其重要的活性成分,值得注意。
3 讨论
随着疟原虫对奎宁类和青蒿素类抗疟药物耐药性的发现(Imwong et al., 2017; Price et al., 2014; World Health Organization, 2017b),研发全新的抗疟药物已刻不容缓。目前,抗疟疾药物的研发主要通过对活性先导化合物进行结构修饰,或者合成其结构类似的衍生物的方式进行(Jampilek, 2017; Vangapandu et al., 2007)。虽然这种研发模式有一定的效果,但由于人工合成的化合物往往具有较大的毒副作用或与先导化合物具有相似作用机制而容易产生耐药性等因素,致使最终能应用于临床的抗疟药物寥寥无几。尽管近些年来抗疟疫苗已问世,但要应用到临床还需要很长一段时间(Birkett et al., 2013; Matuschewski, 2017)。此外,一些植物来源的非奎宁类和青蒿素类天然产物陆续被发现具有抗疟疾活性(Kayser et al., 2002; Mojab, 2012; Pohlit et al., 2013; Xu & Pieters, 2013),且目前所筛选的植物种类与浩瀚的植物种类相比仅冰山一角。因此有理由相信,从植物中寻找、发现抗疟药物的可能性非常大,其前景必定广阔。
β-羟高铁血红素形成抑制活性很可能具有化学结构、官能团类型的选择关联性,羟基尤其是酚羟基为β-羟高铁血红素形成抑制实验的主要活性基团(肖朝江等, 2016)。近年来有研究显示,含有多个酚羟基的黄酮类成分芹菜素具有显著的体内抗疟活性,其体内抑制伯氏疟原虫(Plasmodium berghei)的活性在70 mg·kg-1·day-1时可达到70%,效果十分显著(Amiri et al., 2018);本研究对芹菜素的研究结果表明,该化合物抑制β-羟高铁血红素形成的活性十分显著,其IC50达到168 μg·mL-1,从一个侧面反映了β-羟高铁血红素形成抑制活性与酚羟基以及体内抗疟活性之间的内在联系,对本研究中活性最好的两种植物样品的HPLC分析结果显示,其主成分均应是酚性成分,这进一步印证了上述联系,值得深入研究。
分析本研究结果发现,供试的30种植物中有19个植物具有不同程度的β-羟高铁血红素形成抑制活性,显示出潜在的抗疟活性。这些活性植物醇提物的β-羟高铁血红素形成抑制活性总体弱于相应水提物的活性,提示抗疟活性较好的化合物可能为水溶性的、极性偏大的物质。本研究30种供试植物涵盖了21个科29个属,在植物科属分类范畴方面跨度较大,具有较高的代表性。所筛选出来的活性植物涉及17个科、19个属,进一步证实了从天然产物中发现奎宁、青蒿素等抗疟药物的合理性,以及今后从中发现新型抗疟先导化合物的可行性。因此,本研究为寻找、开发植物来源的新型抗疟天然产物奠定了一定的基础,并在一定程度上为进一步研究上述供试植物提供了参考。
参考文献:
AMIRI M, NOURIAN A, KHOSHKAM M, et al., 2018. Apigenin inhibits growth of the Plasmodium berghei and disrupts some metabolic pathways in mice [J]. Phytother Res, 32(9): 1795-1802.
BIRKETT AJ, MOORTHY VS, LOUCQ C, et al., 2013. Malaria vaccine R & D in the decade of vaccines: Breakthroughs, challenges and opportunities [J]. Vaccine, 31(Suppl. 2): B233-B243.
CHONG CR, SULLIVAN JR DJ, 2003. Inhibition of heme crystal growth by antimalarials and other compounds: Implications for drug discovery [J]. Biochem Pharmacol, 66(11): 2201-2212.
DAS P K, GOSWAMI S, CHINNIAH A, et al., 2007. Woodfordia fruticosa: Traditional uses and recent findings [J]. J Ethnopharmacol, 110(2): 189-199.
IMWONG M, SUWANNASIN K, KUNASOL C, et al., 2017. The spread of artemisinin-resistant Plasmodium falciparumin the Greater Mekong subregion: A molecular epidemiology observational study [J]. Lancet Infect Dis, 17(5): 491-497.
JAMPILEK J, 2017. Design of antimalarial agents based on natural products [J]. Curr Org Chem, 21(18): 1824-1846.
KAYSER O, KIDERLEN AF, CROFT SL, 2002. Natural pro-ducts as potential antiparasitic drugs [J]. Stud Nat Prod Chem, 26(Part G): 779-848.
MATUSCHEWSKI K, 2017. Vaccines against malaria—still a long way to go [J]. Febs J, 284(16): 2560-2568.
MISHRA S, AERI V, 2017. Biotransformation of lignan glycoside to its aglycone by Woodfordia fruticosa flowers: Quantification of compounds using a validated HPTLC method [J]. Pharm Biol, 55(1): 360.
MOJAB F, 2012. Antimalarial natural products: A review [J]. Avicenna J Phytomed, 2(2): 52-62.
OKUDA T, YOSHIDA T, HATANO T, et al., 2006. Fractionation of pharmacologically active plant polyphenols by centrifugal partition chromatography [J]. J Liq Chromatogr, 13(18): 3637-3650.
ORJIH A, BANYAL H, CHEVLI R, et al., 1981. Hemin lyses malaria parasites [J]. Science, 214(4521): 667-669.
PAGOLA S, STEPHENS PW, BOHLE DS, et al., 2000. The structure of malaria pigment β-haematin [J]. Nature, 404(6775): 307-310.
POHLIT AM, LIMA RBS, FRAUSIN G, et al., 2013. Amazonian plant natural products: Perspectives for discovery of new antimalarial drug leads [J]. Molecules, 18(8): 9219-9240.
PRICE RN, VON SEIDLEIN L, VALECHA N, et al., 2014. Global extent of chloroquine-resistant Plasmodium vivax: A systematic review and meta-analysis [J]. Lancet Infect Dis, 14(10): 982-991.
SLATER AFG, SWIGGARD WJ, ORTON BR, et al., 1991. An iron-carboxylate bond links the heme units of malaria pigment [J]. Proc Natl Acad Sci USA, 88(2): 325-329.
VANGAPANDU S, JAIN M, KAUR K, et al., 2007. Recent advances in antimalarial drug development [J]. Med Res Rev, 27(1): 65-107.
WORLD HEALTH ORGANIZATION, 2010. Guidelines for the treatment of malaria: 2nd ed [S]. Geneva: World Health Organization.
WORLD HEALTH ORGANIZATION, 2015. Guidelines for the treatment of malaria: 3rd ed [S]. Geneva: World Health Organization.
WORLD HEALTH ORGANIZATION, 2017a. World Malaria Report 2017 [R]. Geneva: World Health Organization.
WORLD HEALTH ORGANIZATION, 2017b. Artemisinin and artemisinin-based combination therapy resistance [R]. Geneva: World Health Organization.
XIAO CJ, DONG X, HAN BY, et al., 2016. Antimalarial activity of Isodon yuennanensis [J]. Chin Pharm J, 51(8): 612-615. [肖朝江, 董相, 韓冰洋, 等, 2016. 药用植物不育红抗疟活性研究 [J]. 中国药学杂志, 51(8): 612-615.]
XIAO CJ, XU W, LIU ZQ, et al., 2014. Evaluation of the antimalarial activity of 25 herbal medicines from West Yunnan [J]. J Pathog Biol, 9(6): 542-545. [肖朝江, 徐伟, 刘子琦, 等, 2014. 滇西地区25种药用植物抗疟活性研究 [J]. 中国病原生物学杂志, 9(6): 542-545.]
XU YJ, PIETERS L, 2013. Recent developments in antimalarial natural products isolated from medicinal plants [J]. Mini-Rev Med Chem, 13(7): 1056-1072.
ZHANG L, FENG J, ZHANG SS, et al., 2017. Malaria situation in the Peoples Republic of China in 2016 [J]. Chin J Parasitol Parasit Dis Dec, 35(6): 515-519. [张丽, 丰俊, 张少森, 等, 2017. 2016年全国疟疾疫情分析 [J]. 中国寄生虫学与寄生虫病杂志, 35(6): 515-519.]

