黄芩苷抗哮喘作用与HMGB1/TLR4传导通路的相关性研究
韩超 杨柳 张秋玲 梁慧玲 徐俊

摘要 目的:研究黄芩苷对支气管哮喘防治的作用及其可能的作用机制。方法:将54只SD大鼠按体质量随机分为正常组、哮喘模型组、地塞米松组及黄芩苷高、低剂量组。用卵清蛋白(OVA)诱发致敏大鼠建立支气管哮喘的动物模型,给予相应药物灌胃给药4周,1次/d,其中正常组及哮喘模型组药物以等量生理盐水代替。用药物干预性治疗后,观察各组药物对大鼠的哮喘程度及哮喘潜伏期的影响。实验结束后,24 h内处死大鼠,取材,测定并比较支气管壁厚度、气道上皮下胶原沉积程度;测定血中HMGB1浓度;免疫组织化学测定支气管平滑肌中α-SMA和气道组织TLR4的蛋白表达;RT-PCR法测定肺组织HMGB1 mRNA表达变化。结果:黄芩苷可明显改善病鼠的哮喘程度,延长哮喘潜伏期(P<0.05~0.01);可有效减轻病鼠支气管管壁增厚及气道上皮下胶原沉积程度(P<0.05);明显降低血浆中HMGB1的含量,肺组织中的HMGB1 mRNA表达呈下降趋势,但差异无统计学意义(P>0.05);可明显降低气道组织中的TLR4,气管平滑肌中α-SMA的蛋白表达及TLR4 mRNA的表达水平(P>0.05)。结论:黄芩苷具有抗哮喘作用,其作用可能与其影响HMGB1/TLR4通路的信号传导相关。
关键词 黄芩苷;哮喘;地塞米松;哮喘潜伏期;传导通路;大鼠
Abstract Objective:To study the effects of Baicalin on prevention and treatment of bronchial asthma and its possible mechanism.Methods:A total of 54 SD rats were randomly divided into a normall group,an asthma model group,a dexamethasone group,baicalin high and low dose groups by weight.Animal model of bronchial asthma was induced by ovalbumin (OVA).The corresponding drugs were given by orally intragastric administration once a day for 4 weeks.The normal group and the asthma model group were replaced by same volume of normal saline (NS).The effects on asthmatic degree and the latent period of asthma of each rats group were observed after treatment.After the experiment,the rats were killed within 24 h for collection of materials.The thickness of bronchial wall,the degree of collagen deposition in airway,the concentration of HMGB1 in blood,the expression of α-SMA in bronchial smooth muscle and TLR4 in airway were measured by immunohistochemistry.The expression of HMGB1 mRNA in lung tissue was determined by RT-PCR method.Results:Baicalin high and low dose groups could obviously improve the asthmatic degree and prolong the latent period of asthma (P<0.05-0.01),and could effectively reduce the thickness of bronchial wall and the degree of subcutaneous collagen deposition in airway (P<0.05).The content of HMGB1 in plasma was significantly decreased,and the expression of HMGB1 mRNA in lung tissue was decreased,but there was no significant difference (P>0.05).The protein expression of α-SMA and TLR4,the expression of TLR4 mRNA in tracheal smooth muscle were significantly decreased (P>0.05).Conclusion:Baicalin has an effect of anti-asthmatic,which may be related to its influence on signal transduction of the HMGB1/TLR4 pathway.
Key Words Baicalin;Asthma;Dexamethasone;Asthma latency;Conduction pathway;Rat
中圖分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.06.012
黄芩苷(Baicalin)是植物黄芩的主要有效成分之一,具有清热解毒、抗炎、抗变态反应等多方面的药理作用[1]。近年来随着国内外对黄芩苷研究的不断深入,其越来越多的作用如抗氧化、免疫调节、促细胞凋亡等多作用被发现。高迁移族蛋白B1(High Mobility Group Box 1,HMGB1)是一种高度保守的核蛋白,为重要的内源性炎性反应递质,既是早期炎性反应的触发因子,又是晚期炎性反应的启动因子[2]。研究[3]已表明Toll样受体4(Toll Like Receptors 4)是HMGB1促炎过程中的重要受体之一。现已有大量研究证实[4-7],HMGB1/TLR4信号通路在哮喘的发生发展过程中发挥着重要的作用,故对HMGB1/TLR4通路表达进行调控有望成为防治哮喘的新手段。本实验通过观察黄芩苷灌胃给药后对大鼠哮喘的改善作用,并探讨其对气道重塑的抑制作用及与HMGB1/TLR4信号通路的相关性,为防治哮喘气道重塑提供一个研究思路及新的干预方法。
1 材料与方法
1.1 材料
1.1.1 动物 健康的SPF级SD大鼠54只,雌性,体质量150~180 g,广东省医学实验动物中心购入,实验动物生产许可证:SCXK(粤)2013-0002;暨南大学实验动物中心饲养,实验动物使用许可证号:SCXK(粤)2012-0117。饲养条件为:温度20~26 ℃,湿度40%~70 %;给予常规饲料喂食,自由饮水。
1.1.2 药品 黄芩苷,西安藻露堂药业集团康复医药有限公司,纯度85%,批号:110715-201016;卵清蛋白(OVA),Sigma公司生产,产品批号:A5253);醋酸地塞米松片,浙江仙琚制药股份有限公司生产,批号:140692。
1.1.3 试剂与仪器 TLR4抗体,英国Abcam公司生产,批号:GR199098-6;HMGB1 ELISA试剂盒,武汉华美有限公司生产,批号:U13011773;Masson染色试剂盒,武汉谷歌生物科技生产,批号:G1005。超声雾化器,鱼跃医疗设备股份有限公司产品,型号402AI;凝胶电泳、电转仪,美国Bio-RAD公司产品;高速冷冻离心机,美国Thermo Sorvall公司产品,型号ST16R;显微镜,意大利OPTIKA公司产品,型号M-114。
1.2 方法
1.2.1 分组与模型制备 按照体质量将54只大鼠随机分为正常组、哮喘模型组、地塞米松干预组(2.7×104 mg/kg)和黄芩高、低剂量干预组(0.32、0.08 g/kg)。哮喘动物模型参照文献制备[8]:哮喘模型组、药物干预组大鼠分别于第1、8和15天腹腔注射OVA致敏液0.1 mL/只[含OVA 100 mg、Al(OH)3干粉100 mg,NaCl 1 mL]致敏,正常组用生理盐水代替。
1.2.2 给药方法 第15天开始,哮喘模型组、药物干预组每只大鼠用超声雾化机雾化吸入1% OVA进行哮喘激发,0.5 h/次,1次/d,连续雾化激发2周,共计14次;正常组以等量生理盐水雾化吸入。从致敏次日起,灌胃给予各组大鼠相应药物,自第15天起于雾化激发前0.5 h给药(其中地塞米松组隔天给药)。
1.2.3 检测指标与方法
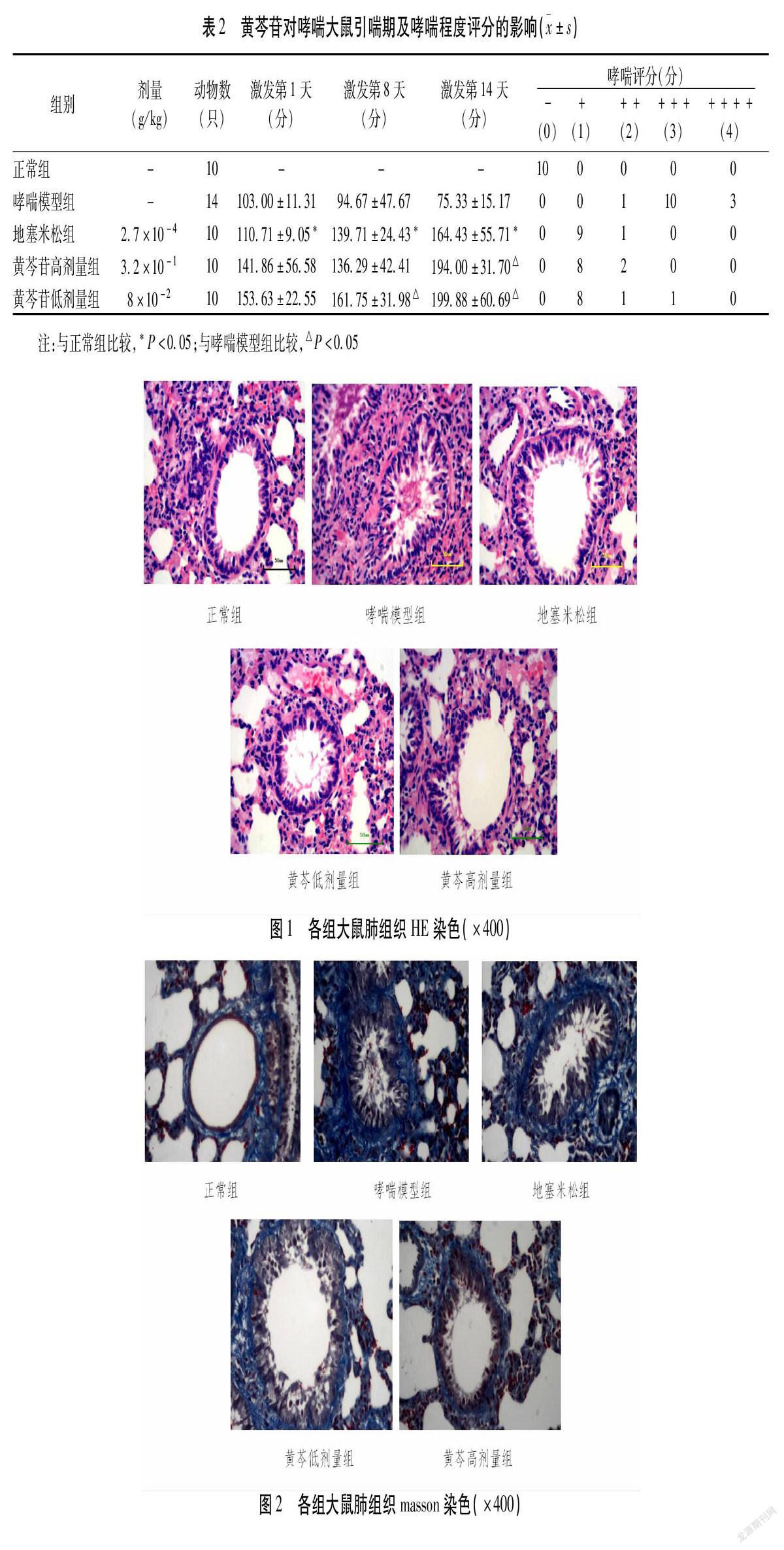
1)哮喘引喘期及喘息程度的测定:于激发的第1、8、14天,末次给药后0.5 h按上法对大鼠进行引喘,记录大鼠从激发开始至出现喘促、腹肌痉挛等症状的时间。从第15天进行激发哮喘开始,参照文献[9-10]根据大鼠喘息症状的程度进行评分。
2)肺、气道组织标本制备和HE、Masson及免疫组化染色:末次雾化激发后,各组大鼠均在24 h内取材。每只大鼠腹腔注射给予戊巴比妥钠麻醉(剂量为60 mg/kg),经腹主动脉采集约2~3 mL血样,注入肝素抗凝管中,12 000 r/min离心10 min,取上清液,-20 ℃保存,用于ELISA检测。取血后打开大鼠胸腔,取左肺组织-80 ℃保存,用于实时定量PCR检测。取右肺上、中叶,石蜡包埋固定,常规切片,分别进行HE、Masson及免疫组织化学染色。对HE及Masson染色切片进行显微图像采集分析,观察大鼠支气管壁厚度和支气管上皮下胶原沉积情况;对免疫组化染色肺组织,评估支气管平滑肌厚度。再小心分离颈部气管,剪取咽至肺之间的气道部分,每组随机选取3份常规石蜡包埋固定,用于免疫组织化学染色,其余于-80 ℃保存,待测。
3)免疫组织化学法测定气道组织中TLR4蛋白表达水平:将已固定24 h的大鼠气道组织进行包埋、切片、脱蜡后依次滴加TLR4一抗、辣根过氧化物酶标记的二抗、DBA显色、苏木素复染、脱水封片,然后进行免疫组化测定,观察大鼠气道组织阳性细胞中TLR4蛋白的表达。每张切片随机选取6个高倍视野,用Image-Pro Plus 6.0软件,测量IOD值,以此代表阳性蛋白表达程度。
4)Real-Time PCR检测HMGB1及TLR4 mRNA 表达水平:按照Trizol方法分别测定肺及支气管组织中的目标总RNA表达水平。引物序列见表1。PCR反应条件:95 ℃ 5 s,60 ℃ 30 s,40个循环。融解曲线:65 ℃ 30 s。每个样品重复3次,扩增结束,记录Ct值,按照2-△△Ct方法对检测结果进行统计分析,结果用2-△△Ct均值±标准差(±s)表达。
5)ELISA法测定大鼠血浆中HMGB1的含量:按照ELISA试剂盒操作方法說明书进行检测。
1.3 统计学方法 采用GraphPad Prism 6.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,组间比较采用双尾不配对t检验(Student′s test),各组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 黄芩苷对哮喘大鼠引喘期及哮喘程度评分的影响 大鼠用OVA诱发哮喘后,哮喘模型组大鼠随即表现出明显的哮喘症状,哮喘潜伏期随着激发天数增加而逐渐缩短。结果显示,给药后地塞米松组,黄芩苷高、低剂量组均可明显减轻病鼠的哮喘症状,且随给药时间的延长,药物组大鼠的哮喘潜伏期也随之延长。实验第15 d,各药物组大鼠的哮喘潜伏期均较哮喘模型组明显延长(P<0.05),且黄芩苷组与地塞米松组比较,差异无统计学意义(P>0.05)。见表2。
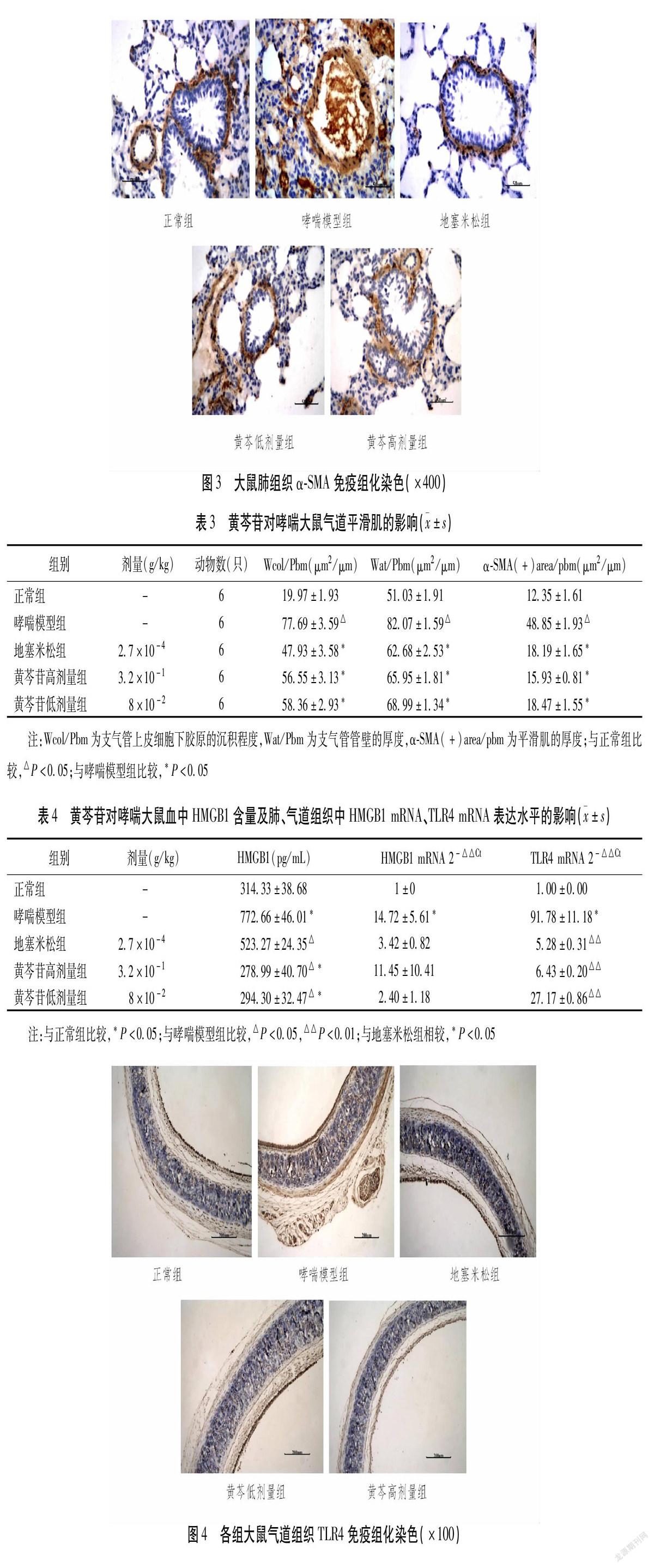
2.2 黄芩苷对哮喘大鼠气道平滑肌的影响 大鼠肺组織HE染色结果显示,哮喘模型组支气管壁厚度较正常组明显增厚。Masson染色结果显示,气道上皮下胶原沉积明显增多,支气管平滑肌厚度明显增加(P<0.05);与哮喘模型组比较,黄芩苷高、低剂量组均可减轻支气管管壁增厚和气道上皮下胶原沉积程度及减缓大鼠气道平滑肌增生(P<0.05)。见图1-3、表3。
2.3 黄芩苷对哮喘大鼠血中HMGB1含量及肺、气道组织中HMGB1mRNA、TLR4 mRNA表达水平的影响 哮喘模型组血中HMGB1含量明显比正常组升高(P<0.05);与哮喘模型组比较,地塞米松、黄芩苷高剂量组、低剂量组均可明显降低血浆HMGB1含量(P<0.05)。哮喘模型组气道组织中的TLR4蛋白阳性表达,TLR-4 mRNA及肺组织中的HMGB1 mRNA表达量比正常组升高(P<0.05);与哮喘模型组比较,地塞米松组、黄芩苷高、低剂量组的HMGB1 mRNA较哮喘模型组均有一定下降趋势,但差异无统计学意义(P>0.05)。气道组织TLR4 蛋白表达水平和TLR-4 mRNA水平则明显降低(P<0.05)。见图4、表4。
3 讨论
支气管哮喘是一种以气道炎性反应细胞浸润、炎性反应细胞增多、气道重塑(Airway Remodeling,AR)为重要特征的常见呼吸道慢性炎症性疾病,有学者[11]认为AR与气道炎性反应可能并行存在,并导致慢性炎性反应的发生及持续。众所周知,AR是哮喘的重要病理特征之一。研究表明[12],AR不仅在哮喘的晚期出现,也出现在哮喘的早期,对AR的研究将有利于早期防治哮喘的发生、发展,但目前临床通用的哮喘诊治方案,重点均放在气道炎性反应的控制方面,而对AR的防治不够重视,因此目前对加强防治哮喘AR药物的研究的呼声也越来越大。
黄芩为我国传统中药,临床应用历史悠久。黄芩苷是其主要活性成分之一,经研究证实有着抗炎、调节免疫、抗病毒等多种药理活性[1]。近年来,关于黄芩苷在哮喘防治方面的作用已引起学者们的关注,相关研究也不断增加,但其对哮喘作用机制尚不明确。目前已有研究证实,黄芩苷可明显减轻哮喘豚鼠的肺部炎性反应及减缓和阻止哮喘大鼠的AR[13-14],对过敏性哮喘小鼠失衡的Th1/Th2也有着有良好的调节作用[15-16]。本研究发现,大鼠经OVA雾化激发后,哮喘模型组大鼠即出现明显的哮喘症状。给予药物干预后,各药物组大鼠的哮喘症状均得到显著改善;哮喘潜伏期亦随着给药时间的延长而明显延长,至给药第2周末,黄芩组对哮喘引喘期的效果已与地塞米松组相当。由此可证明,黄芩苷对由OVA诱发的大鼠哮喘模型气道痉挛具有良好的保护作用。
α-SMA是气道平滑肌的主要标志物,具有很强的胶原合成和收缩能力,观察α-SMA的表达水平可评估平滑肌细胞的数量及其收缩功能的变化,气道平滑肌收缩时可致支气管管腔狭窄而诱发哮喘。α-SMA表达水平的增加,与哮喘的发作及哮喘AR可能有着密切的关系。我们实验中病鼠的肺组织HE、Masson染色及α-SMA免疫组化染色分析结果均显示,黄芩苷组均可有效减轻气道炎性反应,改善气道管壁增厚和上皮下胶原沉积程度,减缓病鼠气道平滑肌增生。
HMGB1作为一种免疫调节因子和炎性因子参与了气道炎性反应的发生和发展。TLR4已被证实是一种重要的免疫识别受体,可连接天然和获得性免疫,在引起和调节支气管气道炎性反应过程中发挥了重要作用。研究[17-18]已证实:TLR4是HMGB1促炎过程中的重要受体,并在HMGB1的信号传导过程中发挥了重要作用。HMGB1在与TLR4结合过程中相互作用,并由此引起下游炎性反应递质的释放,炎性反应递质与HMGB1又相互诱导激活,从而形成恶性循环,引发炎性反应的级联效应,使炎性反应逐级放大[17]。已有动物研究证实,哮喘时支气管气道上皮细胞和炎性细胞中的HMGB1呈高表达,哮喘小鼠肺组织中的HMGB1和TLR4从基因及蛋白水平的表达均呈显著增加[19]。在本实验中,我们通过OVA诱导制备了哮喘大鼠模型,通过ELISA、免疫组化染色、PCR等方法,得出的结果与文献报道基本一致:哮喘模型组大鼠血浆中的HMGB1含量、肺组织中的HMGB1 mRNA、气道组织中的TLR4蛋白及TLR4 mRNA表达均显著升高。用药干预后,各药物组均可明显降低病鼠血浆中的HMGB1含量,气道组织细胞中的TLR4蛋白表达和TLR4 mRNA表达水平也明显下降,但肺组织中的HMGB1 mRNA的表达水平虽较哮喘模型组下降,但差异无统计学意义。
本实验结果进一步确认了HMBG1/TLR4信号传导通路可能与哮喘气道炎性反应及AR的发生、过程密切相关,与研究文献报道一致。黄芩苷的干预性治疗可有效减轻哮喘大鼠气道炎性反应,还可改善哮喘大鼠的AR,这一作用可能与其对HMBG1/TLR4信号通路的调控相关。黄芩苷可能作用于HMGB1-TLR4信号通路,影响其信号传导,抑制下游炎性反应递质的释放,阻断炎性反应的级联效应,从而发挥抗哮喘的作用。同时,我们也发现,除黄芩苷高剂量组外,其他药物组均能明显下调HMGB1 mRNA的表达量,但与哮喘模型组比较,差异均无统计学意义,这一结果可能因检测的标品量不足够大、数据标准差大、结果分布离散所导致。此外,从本实验结果可以发现,黄芩苷高、低剂量组在对哮喘大鼠的指标改善作用方面并无明显差异,我们推断黄芩苷治疗哮喘的作用与剂量可能并无依赖关系,提示以后在做相关研究时,须注意黄芩苷的有效浓度的选择。
参考文献
[1]辛文妤,宋俊科,何国荣,等.黄芩素和黄芩苷的药理作用及机制研究进展[J].中国新药杂志,2013,22(6):647-653.
[2]欧阳军,彭心宇,李锋.晚期炎症介质-高迁移率族蛋白B-1[J].现代生物医学进展,2010,10(5):968-971.
[3]Yang H,Hreggvidsdottir HS,Palmblad K,et al.A critical cysteine is required for HMGB1 binding to Toll-like receptor 4 and activation of macrophage cytokine release[J].Proc Natl Acad Sci U S A,2010,107(26):11942-11947.
[4]Yang H,Hreggvidsdottir HS,Palmblad K,et al.A critical cysteine is required for HMGB1 binding to Toll-like receptor 4 and activation of macrophage cytokine release[J].Proc Natl Acad Sci USA,2010,107(26):11942-11947.
[5]李菡,姜宝珍,刘泽玉,等.HMGB1/TLRs信号通路在大鼠机械通气肺损伤中的作用[J].安徽医科大学学报,2015,50(4):458-462.
[6]吴国荣,王发龙,陈文,等.重组高迁移率族蛋白B1对肺上皮细胞细胞因子释放的影响及其机制[J].南京医科大学学报:自然科学版,2012,32(5):641-644.
[7]崔勇,李世明,金燕,等.人参皂苷Rh2抗小鼠哮喘模型气道炎性反应的作用研究[J].中华中医药杂志,2016,31(7):2807-2811.
[8]韩超,杨柳,张秋玲,等.黄芩苷对哮喘大鼠p38 MAPK信号通路影响初探[J].广州医药,2016,47(4):5-9.
[9]徐叔云.药理实验方法学[M].2版.北京:人民卫生出版社,1991:122-125.
[10]刘金保,钟南山,李树浓,等.Ppd对豚鼠实验性哮喘气道炎症的作用[J].免疫学杂志,2002,18(5):350-352.
[11]Bush A.How early do airway inflammation and remodeling occur[J].Allergol Int,2008,57(1):11219.
[12]邹璐,孙祝美,郭春荣,等.中医药防治支气管哮喘气道重塑相关信号通路研究进展[J].中华中医药杂志,2018,33(11):5057-5060.
[13]陈宝生,莫耀南.支气管哮喘气道重塑动物模型的制作[J].河南科技大学学报:医学版,2004,22(4):316-318.
[14]刘中成,张艳芬.一种大鼠慢性哮喘模型的建立与评价[J].药学学报,2010,45(6):718-723.
[15]黄丰,童晓云,邓华明,等.黄芩苷调节哮喘模型小鼠Th1/Th2反应机制初探机[J].中药材,2009,32(9):1407-1410.
[16]Ma C,Ma Z,Fu Q,et al.Anti-asthmatic effects of baicalin in a mouse model of allergic asthma[J].Phytcrtherapy Research,2014,28(2):231-237.
[17]Wang H,Bloom O,Zhang M,et al.HMGB1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248-251.
[18]喬俊英,宋丽,张艳丽,等.哮喘小鼠HMGB1/TLR4/NF-κB信号通路及维生素D的作用[J].中国现代儿科杂志,2017,19(1):95-103.
[19]乔俊英,张艳丽,宋丽,等.高迁移率族蛋白B1和Toll样受体4与哮喘气道炎症的关系及维生素D的作用[J].西安交通大学学报:医学版,2017,38(4):529-535.
(2019-04-23收稿 责任编辑:芮莉莉)

