陆地棉转GR79与GAT基因对草甘膦抗性的鉴定及其遗传规律分析
赵龙飞 赵亮 狄佳春 陈旭升




摘要:本研究采用特异引物对陆地棉种质系GGK-2的抗草甘膦基因进行PCR鉴定,结果显示:GCK-2不仅扩增出488 bp的GR 79基因的特征条带,同时还扩增出379 bp的GAT基因特征条带。而后采用草甘膦对陆地棉与陆地棉杂交F2分离群体进行浸种抗性鉴定,结果显示CGK-2对草甘膦表现出良好抗性,其抗草甘膦性状分离符合抗性株:非抗性株=3:1的质量性状分离规律,显示抗草甘膦性状是受孟德尔单显性基因控制的质量性状。同时,利用陆地棉与陆地棉杂交F:群体对抗性基因GR79和GAT的分离进行PCR检测,显示目的基因GR79和GAT导人棉花后,以共有的方式在棉花杂交后代稳定地遗传传递,共有比率高达97.9%。而后,采用海岛棉与陆地棉杂交F2群体作为定位群体,利用SSR分子标记对外源基因进行遗传定位,结果显示GR79和GAT2个基因均被定位于棉花第20号染色体上,并表现为连锁遗传,其遗传距离为3.3 cM。在GR79基因位点一侧有7个SSR分子标记,与其最近的标记为相距7.1 cM的NAU2579;在GAT基因位点一侧也有7个SSR分子标记,与其最近的标记是相距3.9 cM的NAU3137。本研究为品系GGK-2在抗除草剂棉花育种中的应用提供了理论依据。
关键词: GGK-2;抗草甘膦基因;GR79;GAT;遗传规律
中图分类号: Q78
文献标识码:A
文章编号: 1000-4440( 2019) 03-0531-06
棉花是十分重要的经济作物,与国民生活以及国家的农业经济息息相关。中国棉花集约化生产水平相对落后,其中杂草对棉花的危害是导致棉花综合生产效益较低的一个重要因素。杂草不仅与农作物竞争水、肥、光和空间等,而且容易滋生病虫害,严重影响棉花个体的生长发育,造成棉花产量降低与品质的下降[1]。草甘膦是世界公认的优良除草剂之一,其除草范围广,高效、低毒、无残留,并且价格低廉,因此草甘膦尤其适合在作物大面积种植地区推广使用。这就需要种植的作物对草甘膦具有抗性,这样在使用草甘膦时不至于对作物造成药害[2]。
当今世界,作物生产逐渐向机械化和集约化方向发展。抗除草剂品种的培育将成为中国棉花机械化生产的一种迫切需求。棉花对草甘膦的抗性可通过以下2种主要途径获得:一是通过诱变或向棉株体内导人对草甘膦不敏感的基因,进而提高植物对草甘膦的耐受性。二是通过向棉株体内导人草甘膦降解基因,在草甘膦发挥作用前将其降解,使棉株对草甘膦产生抗性。Comai等[3-4]在鼠伤寒门氏菌中筛选并分离出了抗草甘膦的突变基因aroA,并成功在大肠杆菌中获得抗草甘膦特性的表达。Nida等[5]将在土壤农杆菌变种CP4菌株中发现的莽草酸羟基乙烯转移酶基因( EPSPS),通过农杆菌介导的方法转移到棉花中,成功培育出具有抗草甘膦除草剂特性的棉花品种。中国在自主培育抗草甘膦棉花新种质系方面已有不少研究报道[6-10],特别在自主筛选与克隆抗草甘膦基因方面已取得长足进步[ll]。中国农业科学院生物技术研究所科研团队在草甘膦严重污染的土壤微生物中克隆到抗草甘膦新型EPSP合酶GR79及N-乙酰转移酶GAT,并进行植物偏爱性密码子改造,构建含GR79或GAT单基因和同时含有双基因的植物表达载体,并将这2种基因同时导入到棉花中,获得了双抗草甘膦基因的棉花新种质系,通过分子检测和功能鉴定发现,转基因种质系的抗草甘膦能力达生产用量的5倍以上[12-14]。
本试验利用中国农业科学院生物技术研究所提供的抗草甘膦棉花新品系GGK-2作为试验材料,通过对这一抗草甘膦棉花新品系进行抗性基因的PCR鉴定和抗性遗传分析,并对抗性基因进行连锁遗传定位,旨在为国产抗除草剂棉花新材料育种提供科学依据。
1 材料与方法
1.1 试验材料
国产抗草甘膦陆地棉新种质系GGK-2由中国农业科学院生物技术研究所郭三堆研究员提供,胜利1号(V-1)为非抗草甘膦的海岛棉品种,YK1107为非抗草甘膦的陆地棉种质系。
以GGK-2为母本,配置杂交组合:GGK-2×YK1107、GGK-2xV-1。其F.代自交获得F2代群体[GGK-2xYK1107] F2、[GGK-2xV-1] F2.
1.2 试验方法
1.2.1 目的基因的PCR检测 本试验所采用的特异引物是根据郭三堆等[12]公布的GR79和GAT基因序列自行合成。GR79特异性引物序列如下,其目标条带总长488 bp;F:5’-GATGCGAGCACGGCCTG-CTACTT-3’: R:5’-ATGCGAATGTGCGGAACCTTG-AC-3’;GAT基因的特异性引物序列如下,其目标条带总长为379 bp;F:5’-CCTATGAGTTGAGGCACC-GTATT-3’:R:5’-TGAGGTCCCACAGGAGGAGTGT-C-3’。
取GGK-2、V-1與YK1107的种子,提取DNA,方法参照匡猛等[15]的方法。PCR扩增产物在恒压90 V条件下,使用1%琼脂糖凝胶进行电泳,在凝胶成像系统中观察目的基因片段。
1.2.2 草甘膦抗性的生物学鉴定 棉种对草甘膦的抗性鉴定参照陈旭升等报道的棉籽浸种鉴定法[16]。取GGK-2种子50粒,YK1107种子50粒,GGK-2xYK1107 F,种子100粒,将41%浓度的农达试剂稀释到0.3%,在150 ml锥形瓶中用稀释后的农达试液浸没种子24 h,取出棉种做沙基发芽试验。然后放入25℃恒温培养箱中培养7d后,计数各群体对草甘膦的抗性苗与非抗性苗。
1.2.3 GR79和GAT基因的染色体定位取GGK-2xV-1 F2的种子提取DNA,方法同上。在F'分离群体中随机选取含有目的基因GR79和GAT个体各10个,对应不含有目标基因的个体10个,分别建立GR79和GAT的近等基因池。然后利用我们前期筛选获得的分布于棉花26对染色体上的234对SSR核心引物[17],对双亲和近等基因池进行PCR扩增,筛选有多态性的引物。PCR扩增反应体系为10.0μl,反应程序为,GR79基因:94 cC预变性10 min;94℃变性15 s,63 ℃退火30 s,72 cC延伸1 min,35个循环,最后72℃延伸10 min;GAT基因:94 cC预变性10 min;94℃变性15 s,55 ℃退火30 s,72℃延伸1 min,35个循环,最后72 cC延伸10 min。扩增产物在8.0%的非变性PAGE凝胶上电泳,电压为恒压220V,电泳缓冲液为lxTBE。电泳结束后,参照张军等[18]的方法进行银染,在胶片观察灯下筛选多态性引物。用获得的多态性引物检测F'代分离群体单株的标记基因型,统计多态性条带,将与V-1带型相同的个体基因型记为1,与GGK-2带型相同的个体基因型记为2,共显性杂合带型的基因型记为3,条带为空或无法辨识的记为0。采用Join Map4.0软件进行连锁分析,以锁定目标引物以及目的染色体。然后合成目的染色体上的其他SSR引物对图谱进行加密,绘制连锁遗传图谱。
2 结果与分析
2.1 GGK-2抗性基因的PCR鉴定
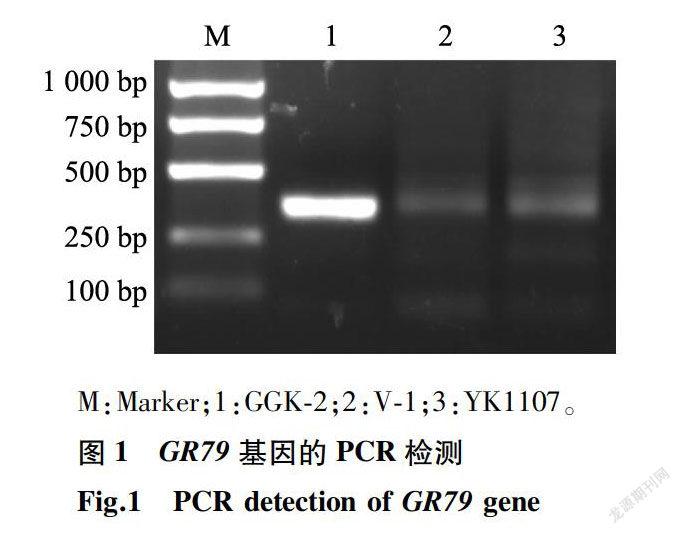
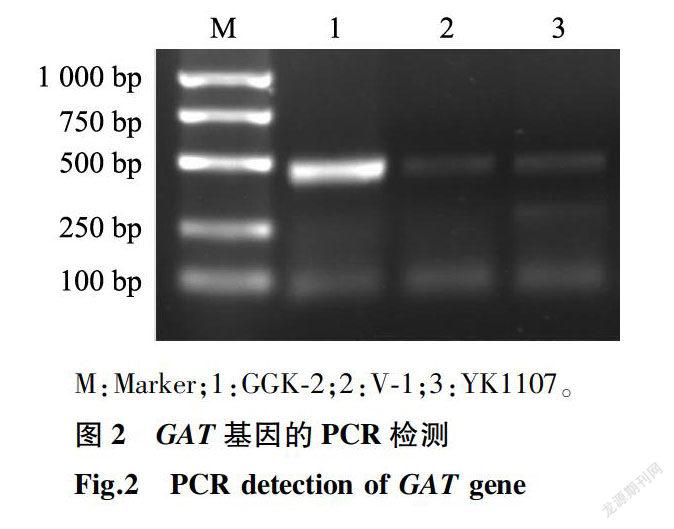
本试验依据GR79和GAT基因序列设计了2个基因的特异检测引物,其PCR扩增结果分别见图1、图2。两图中泳道1均为品系GGK-2,它不仅扩增出GR79基因的特征条带(大小488 bp),同时还扩增出GAT基因379 bp大小的特征条带。两图中的泳道2、泳道3分别为2个对照品系:V-1(海岛棉)、YK1107(陆地棉),二者均不含GAT与GR79基因;因此都没有扩增出488 bp与379 bp大小的特征条带。以上结果表明,外源抗性基因GR79和GAT已成功转入品系GGK-2。
2.2 棉苗对草甘膦生物学抗性鉴定
用质量浓度为0.3%的草甘膦浸种,在温光培养箱培养7d后取出棉苗,比较抗性苗与非抗性苗的表型差异(图3)。由图3可见,GGK-2棉苗发育正常,根系长出许多须根,表现出对草甘膦的良好抗性;而同等条件下的对照品系YK1107的棉苗发育矮小,根部未见须根,幼苗长势差,并有发黑坏死的症状,对草甘膦表现为不抗。杂交F,分离群体的抗性苗与非抗性苗的发育情况见图3C和图3D。
统计2个亲本与F2群体的抗性苗与非抗性苗数,其结果列于表1。由表1可见,GGK-2棉苗全部表现为抗性苗;YK1107全部表现为非抗性苗。通过卡方检验,F2代分离群体抗性苗和非抗性苗的比例符合孟德尔经典遗传学的3:1分离比例,说明GGK-2的抗草甘膦性状是受单个孟德尔显性基因控制的质量性状。
2.3 GR79和GAT基因在F2群体的分离特性
将GGK-2xYK1107 F,群体用于目的基因GR79和GAT在杂交分离后代遗传表达特性的分析,通过对分离群体2个目的基因的PCR检测,其分离情况见表2。由表2可知,GGK-2×YK1107 F2群体中GR79基因的显性隐性个体通过卡方检验符合3:1的分离比例;对GAT基因的检测也是同样的结果。这说明,这2个目的基因都呈显性表达特征,都符合单基因控制的质量性状遗传规律;而且F2分离群体中的GR79基因与GAT基因呈现明显的共有分离现象,总共检测F2群体137颗种子个体,其中有94个个体表现为GR79与GAT基因的共有分离现象,只有2个个体未出现GR79和GAT的共有分离现象,共有比例高达97.9%。至于2个个体为什么未能出现GR79和GAT的共有分离现象,其内在原因尚需进一步研究探讨。
2.4 GR79和GAT基因的染色体定位
相比于陆地棉与陆地棉杂交分离群体GGK-2xYK1107 F,,海岛棉与陆地棉杂交群体GGK-2xV-1F,的凝胶电泳的多态性条带更加丰富,故将GGK-2xV-1 F2群体用于目的基因的定位。通过对F2分离群体2个目的基因做PCR检测,其分离情况见表3。表3中显示:在海岛棉与陆地棉杂交F2分离群体中,外源基因GR79和GAT均符合3:1的孟德尔分离规律,因此可以利用SSR分子标记对它们进行基因定位。
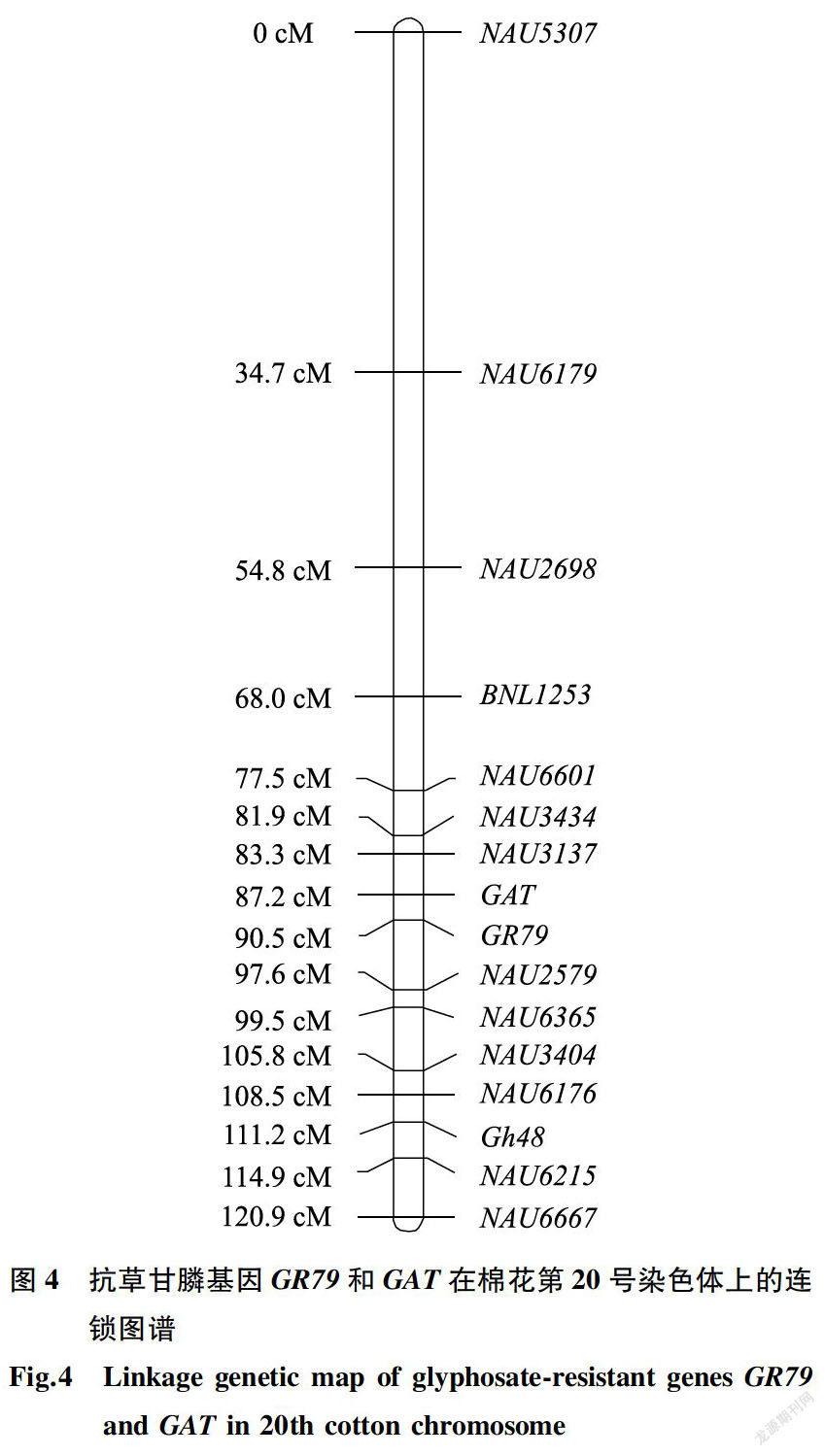
利用近等基因池筛选核心引物,率先获得的连锁标记是NAU2579,这是一个位于棉花20号染色体上的SSR标记。外源基因GR79和GAT初步定位的目标染色体是相同的,2个基因均连锁于棉花20号染色体上。而后查找棉花20号染色体上的其他连锁分子标记,以丰富其遗传图谱。最后通过JoinMap4.0进行连锁分析,获得抗草甘膦基因GR79和GAT的染色体定位图谱(图4)。由图4可以看出,GR79和GAT基因表现连锁,两者遗传距离为3.3cM。共有14个SSR引物与这2个基因相连,在GR79 -侧有7个SSR分子标记,在GAT -侧也有7个。与GAT相距最近的SSR标记是相距3.9 cM的NAU3137,与GR79最近的分子标记是相距7.1 cM的NAU2579。整个遗传图谱的遗传距离为120.9cM。值得指出的是,GR79和GAT基因虽然表现连锁,但因采用的定位群体较小,只有181个个体,因此获得两目的基因的连锁遗传距离较大。
3 讨论
外源基因導人棉花会产生不同的遗传转化事件,燕树锋等[IO]分析转基因抗草甘膦棉花的遗传情况,曾检测26个抗草甘膦棉花转化事件,只有20个转化事件分离符合3:1的分离规律,其他6个转化事件出现了偏分离,不符合1对基因的分离规律,表明转基因植株中外源基因的整合和遗传机制相当复杂。本研究通过鉴定陆地棉抗草甘膦品系GGK-2外源基因类型以及抗草甘膦基因的遗传方式发现,抗草甘膦性状符合1对孟德尔显性基因控制的质量性状遗传规律。同时利用陆地棉与陆地棉杂交F,群体以及海岛棉与陆地棉杂交F2群体,分别检测基因GR79与GAT在杂交后代的分离,也均符合3:1的理论比例。前人研究结果表明,通过与某一染色体的多个SSR分子标记的连锁关联分析,可实现外源基因的染色体定位[19-21]。本研究依据Guo等[22]、Zhao等[23]公布的四倍体棉花分子标记遗传图谱,并利用自主筛选的分布在棉花26对染色体上的234对SSR核心引物,将基因GR79和GAT连锁定位在棉花第20号染色体上。该定位结果相当于多次SSR分子标记连锁重复验证,具有极高的可靠性。
对于棉花育种者来说,鉴定转基因种质系外源基因类型并探明其杂交后代的遗传规律,可以有效指导育种者依据育种目标来配置不同的杂交组合,从而有目的地实现不同外源基因的互补与整合。本研究为国产转抗草甘膦基因棉花新种质系GGK-2在育种中的应用提供了理论依据。
致谢: 本研究使用的抗草甘膦陆地棉品系GGK-2,由中国农业科学院生物技术研究所郭三堆研究员提供。在此谨表衷心感谢!
参考文献:
[1]郭三堆,王远,孙国清,等.中国转基因棉花研发应用二十年[J].中国农业科学,2015,48( 17):3372-3387.
[2]陈旭升.抗除草剂棉花研究进展[J].江西农业学报,2006,18(1):94-98.
[3] COMAI L,SEN L,STALKER D.An altered aroA gene productconfers resistant to the herbicide glyphosate[J].Science, 1983,221:370-371.
[4] COMAI L,FACCIOTTI D. HIATT W R, et al-Expression inplants of a mutant aroA gene from Salmonella typhimurium conferstolerance to glyphosate[J].Nature, 1985, 371:741-744.
[5]NIDA D L,KOLACZ K H. LEEMAN M. et al-Glyphosate-tolerantcotton: genetic characterization and protein expression[J].AgricFood Chem. 1996 ,44(7):1960-1966.
[6]祝水金,汪静儿,俞志华,等.棉花抗草甘膦突变体筛选及其在杂种优势利用中的应用[J].棉花学报,2003,15(4): 227-230.
[7]谢龙旭,李云锋,徐培林.根癌农杆菌介导的转aroAM12基因棉花植株的草甘膦抗性[J].植物生理与分子生物学学报,2004,30(2):173-178.
[8] 赵福永,谢龙旭,田颖川,等.抗草甘膦基因aroAM12及抗虫基 因BtsJm的转基因棉株[J].作物学报,2005,31(1):108-113.
[9] 马燕斌,王霞,吴霞,等.新的抗草甘膦转基因棉花获得的初报[J].山西农业科学,2013,41( 10):1046-1049.
[10]燕树锋,祝水金,刘海芳,等.转EPSPS基因抗草甘膦棉花的遗传分析[J].华北农学报,2015,30(3):54-57.
[11]王慧,闫晓红,徐杰,等.我国抗草甘膦基因的发掘现状[J].农业生物技术学报,2014,22(1):109-118.
[12]郭三堆,孙豹,张锐,等.一种含有草甘膦抗性基因的表达载体及其应用:201410204703.6[P].2014-05-15.
[13]郭三堆,孙豹,孟志刚,等.转抗虫、抗除草剂基因棉花分子育种[C]//中国农学会棉花分会.中国棉花学会2015年年会论文汇编.安阳:中国棉花杂志社,2015: 50.
[14]梁成真,孫豹,孟志刚,等.CR79-epsps和CAT协同增效培育新型低残留高抗草甘膦棉花[C]//中国农学会棉花分会.中国农学会棉花分会2017年年会暨第九次会员代表大会论文汇编.安阳:中国棉花杂志社,2017:52.
[15]匡猛,杨伟华,许红霞,等.单粒棉花种子DNA快速提取方法[J].分子植物育种,2010,8(4):827-831.
[16]陈旭升,刘新民,狄佳春,等.陆地棉抗草甘膦性状的遗传规律分析[J].江苏农业科学,2009(1):76-78.
[17]景超,马晓杰,狄佳春,等.陆地棉超矮秆突变体基因的初步定位[J].遗传,2011(12):1393-1397.
[18]张军,武耀廷,郭旺珍,等.棉花微卫星标记的PACE/银染快速检测[J].棉花学报,2000 .21(5):267-269.
[19]刘吉焘,马晓杰,狄佳春,等.棉花草甘膦抗性基因CP4-EPSPS的初步定位[J].江苏农业学报,2013,29(3):480484.
[20]安百伟,赵亮,狄佳春,等.陆地棉Bt抗虫基因类型鉴定与染色体定位[J].江苏农业学报,2016,32(2):262-266.
[21]周向阳,赵亮,狄佳春,等.抗虫杂交棉苏杂6号抗虫亲本的Bt基因鉴定与染色体定位[J].江苏农业学报,2016.32(5):987-991.
[22] GUO W, CAI C, WANC C, et al.A microsateLlite-based, gene-rich linkage map reveals genome structure, function and evolutionin Gossypium[J].Cenetics. 2007, 176(1):527-541.
[23] ZHAO L,LV Y D. CAI C P. et al-Toward allotetraploid cottongenome assembly: integration of a high-density molecular geneticlinkage map with DNA sequence information[J].BMC Cenomics.2012. 13:539-570.

