miR-429对乳癌细胞增殖和迁移影响及其靶基因初步鉴定
陈凤婷 侯琳 韩清昕 于超 吴琍

[摘要]目的探讨miR-429在人乳癌细胞系中的表达及其对细胞增殖和迁移的影响,初步鉴定miR-429的靶基因。方法采用实时荧光定量PCR(qPCR)方法检测miR-429在人乳癌细胞系中的表达。通过MTT实验和划痕实验确定miR-429对人乳癌细胞系MDA-MB-231细胞增殖和迁移的影响。采用生物信息学分析、qPCR和蛋白质印迹方法鉴定miR-429的靶基因。结果miR-429在人乳癌细胞系MDA-MB-231和MCF-7中低表达。上调miR-429表达后,MDA-MB-231细胞增殖能力被显著抑制(F=33.106,P<0.05),迁移能力明显减弱(F=57.59,P<0.05)。过表达和抑制miR-429后,预测靶基因金属蛋白酶2组织抑制剂(TIMP2)、环磷腺苷效应元件结合蛋白1(CREB1)mRNA表达水平均无明显变化;然而,过表达miR-429后,TIMP2蛋白的相对表达量显著降低(F=33.74,P<0.05)。结论在MDA-MB-231细胞中,过表达miR-429可抑制细胞增殖和迁移。miR-429的过表达可能通过转录后翻译抑制TIMP2蛋白在MDA-MB-231细胞中的表达,初步鉴定TIMP2是miR-429的靶基因。
[关键词]微RNAs;乳房肿瘤;细胞增殖;细胞运动;金属蛋白酶2组织抑制剂
[中图分类号]R737.9[文献标志码]A[文章编号]2096-5532(2019)03-0325-05
[ABSTRACT]ObjectiveTo investigate the expression of microRNA-429 (miR-429) in human breast cancer cell line and its effect on the proliferation and migration of human breast cancer cell, and to preliminarily identify the target genes of miR-429. MethodsQuantitative real-time PCR (qPCR) was used to measure the expression of miR-429 in human breast cancer cell line. MTT assay and wound healing assay were used to investigate the effect of miR-429 on the proliferation and migration of human breast cancer MDA-MB-231 cell line. bioinformatics analysis, qPCR, and Western blot were used to identify the target genes of miR-429. ResultsMiR-429 showed low expression in human breast cancer MDA-MB-231 and MCF-7 cell lines. After upregulation of miR-429 expression, MDA-MB-231 cells had significant reductions in proliferative capacity (F=33.106,P<0.05) and migration ability (F=57.59,P<0.05). There were no significant changes in the mRNA expression of the predicted target genes TIMP2 and CREB1 after miR-429 overexpression or inhibition; however, there was a significant reduction in the relative expression of TIMP2 protein after miR-429 overexpression (F=33.74,P<0.05). ConclusionOverexpression of miR-429 may inhibit the proliferation and migration of MDA-MB-231 cell line and reduce the expression of TIMP2 protein in MDA-MB-231 cell line through post-transcriptional translation, and therefore, TIMP2 is preliminarily identified as the target gene of miR-429.
[KEY WORDS]microRNAs; breast neoplasms; cell proliferation; cell movement; tissue inhibitor of metalloproteinase-2
在世界范圍内,乳癌发病率位列女性恶性肿瘤之首,居癌症死亡原因的第6位。目前乳癌的确诊主要依靠空芯针穿刺和手术活检,对病人创伤较大。影像学检查和血液检验主要用于检查乳癌病人肿瘤的复发转移和耐药,其灵敏度和特异度欠佳。因此,寻找在乳癌发生和进展过程中起关键作用的特异肿瘤标志物对于乳癌的诊断治疗至关重要。微RNAs(miRNAs)是单链非编码RNAs,20~25个核苷酸长度,属于一类新的内源性干扰RNAs[1]。其通过与靶基因mRNA 3′非编码区结合,对转录后基因沉默具有重要作用。miRNAs及其靶基因作为肿瘤标志物在乳癌发生和进展中的作用是目前研究的热点。miR-429作为癌基因或抑癌基因在多种肿瘤的发生发展中起重要作用[2]。已有研究显示,乳癌组织miR-429的表达较癌旁组织明显减低。miR-429在不同人乳癌细胞系中的表达存在差异[3]。关于miR-429在人乳癌组织中的靶基因及其生物学功能研究较少,且存在一定的争议。有研究结果证实,在人乳癌组织中,miR-429通过下调ZEB1、CRKL、LIMK1、PLCG1等靶基因的表达,参与肿瘤细胞增殖、凋亡、迁移、侵袭等恶性生物学行为[4-6],发挥抑癌作用。因此,探讨miR-429在乳癌中的作用机制,关键是研究miR-429及其靶基因的作用。本研究旨在探讨miR-429在人乳癌细胞系中的表达情况,以及miR-429过表达和抑制对人乳癌MDA-MB-231细胞增殖和迁移的影响,并初步鉴定miR-429的靶基因,为明确miR-429参与乳癌的作用机制及寻找乳癌诊断、治疗的标志物提供实验依据。现将结果报告如下。
1材料与方法
1.1实验材料
人乳癌细胞系MCF-7(青岛大学附属医院中心实验室);人乳房上皮细胞系MCF-10A、人乳癌细胞系MDA-MB-231(青岛大学医学部中心实验室);miR-429 mimics、mimics NC、inhibitors NC、miR-429 inhibitors、Cy3标记的mimics NC(上海吉玛公司);RIPA裂解液、BCA蛋白质定量试剂盒(北京索莱宝科技有限公司);BI胎牛血清(青岛博康生物科技有限公司);DMEM/High Glucose培养液(美国Hyclone公司);MTT试剂(Sigma公司);Trizol Reagent(Invitrogen公司);TransIntroTM EL Trans-fection Reagent、荧光定量PCR Mix、反转录试剂盒、鼠抗人GAPDH抗体(北京全式金生物技术有限公司);引物(上海桑尼生物科技有限公司);兔抗人金属蛋白酶2组织抑制剂(TIMP2)和环磷腺苷效应元件结合蛋白1(CREB1)抗体(恩晶生物);辣根过氧化物酶标记山羊抗兔IgG、山羊抗鼠IgG(北京博奥森公司)。
1.2实验方法
1.2.1细胞培养细胞用含体积分数0.10胎牛血清、10 g/L青链霉素混合液的DMEM/High Glucose培养液,在37 ℃、含体积分数0.05 CO2的培养箱内培养,培养至对数生长期时用于后续实验。
1.2.2细胞转染和分组取生长状态良好的细胞按每孔2×105接种于6孔板,待细胞汇合度达40%~60%时进行转染。根据miRNA mimics和Trans-IntroTM EL Transfection Reagent转染操作说明,用Cy3标记的mimics NC和TransIntroTM EL Transfection Reagent转染试剂优化转染条件。转染后12 h更换含血清培养液并于荧光显微镜下观察转染效率。最佳转染条件为:mimics NC 12.5 μL、TransIntroTM EL Transfection Reagent 5 μL。細胞按转染不同分为miR-429 mimics组(A组)、mimics NC组(B组)、control组(C组)、inhibitors NC组(D组)和miR-429 inhibitors组(E组)。细胞继续培养24~48 h用于后续实验。
1.2.3MTT法检测细胞增殖活力取对数生长期细胞消化后接种于96孔板,每孔约6 000个细胞,每组设置5个复孔,共铺4块板。待细胞汇合度达到40%进行转染。每天取一板细胞用MTT法检测细胞增殖活力。从转染12 h后开始检测,每孔加入5 g/L的MTT 10 μL,放入培养箱中孵育4 h,然后弃去培养液,加入100 μL DMSO溶解甲瓒颗粒。酶标仪设置震板5 min溶解甲瓒颗粒,检测490 nm波长处各孔吸光度(A)值,以转染后培养时间为横轴、A值为纵轴制作细胞增殖曲线。
1.2.4细胞划痕实验取对数生长期细胞接种于6孔板,待细胞汇合度达到40%~60%时进行转染,待细胞汇合度达到90%时进行划痕实验。分别于划痕0、24 h时观察细胞迁移情况并拍照。应用Image-Pro Plus 6.0软件计算划痕面积,结果取3次重复实验的均值。计算24 h划痕愈合率[(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%]。
1.2.5生物信息学方法预测并筛选miR-429靶基因以miR-429为检索词,分别在miRanda、Targetscan和Pictar数据库中筛选miR-429可能的靶基因,将至少两个软件都能预测到的基因作为其可能的靶基因。为了深入了解miR-429对乳癌细胞生物学功能的影响,将预测得到的miR-429靶基因进行GO富集分析,选择富集了参与调控癌细胞增殖、凋亡、迁移、侵袭等生物学行为的靶基因。通过miRNA CancerMap数据库和文献分析排除已验证过的靶基因,最终选取TIMP2、CREB1、EDNRA、TUBB、DUSP1、MED13、LRP1、GDI2、GABPA、UBE2B、EPS8、MYCN、PLK2、OCLN等作为待测的miR-429靶基因。
1.2.6实时荧光定量PCR(qPCR)检测细胞miR-429表达水平和预测靶基因mRNA表达水平将转染miR-429 mimics、mimics NC、inhibitors NC、miR-429 inhibitors的MDA-MB-231和MCF-7细胞以及只加TransIntroTM EL Transfection Reagent的control组细胞分别用Trizol法提取总RNA,测定各组RNA浓度,根据A260/280值判断RNA纯度。各组RAN A260/280均在1.8~2.0区间内,纯度较高。按照逆转录试剂盒说明将RNA逆转录为cDNA。逆转录条件如下:65 ℃、5 min,冰上孵育2 min;42 ℃、15 min,85 ℃、5 s。根据qPCR试剂盒说明配制反应体系。反应条件为:94 ℃、30 s; 94 ℃、5 s,60 ℃、30 s,40个循环。各待测基因引物序列见表1。每组样品至少设置3个复孔,实验至少重复3次。以2-△△Ct计算目的基因的相对表达量。
1.2.7Western blot方法检测细胞TIMP2蛋白的相对表达量将上述5组细胞弃培养液,用PBS冲洗3次,加入RIPA裂解,提取总蛋白。采用BCA法测定蛋白浓度。加入6×Protein Loading Buffer后煮沸5 min。在120 g/L SDS-PAGE分离胶+50 g/L浓缩胶的凝胶系统中电泳分离蛋白,然后将蛋白电转转移至0.45 μm的PVDF膜上。条带用50 g/L的脱脂奶粉在摇床上室温封闭2 h,用对应的1∶1 000稀释的鼠抗人GAPDH抗体、兔抗人TIMP2抗体、兔抗人CREB1抗体在摇床上室温孵育2.5 h,4 ℃孵育过夜。TBST洗膜3次,每次10 min。用对应的二抗室温孵育1 h,重复TBST洗膜步骤,按说明配制ECL发光液并显影。应用Fusion FX7成像系统拍照并分析,目的蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。
1.3统计学方法
采用SPSS 20.0和Graphpad Prism 5软件进行统计学处理,计量资料数据以±s表示,样本间比较采用析因设计的方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2结果
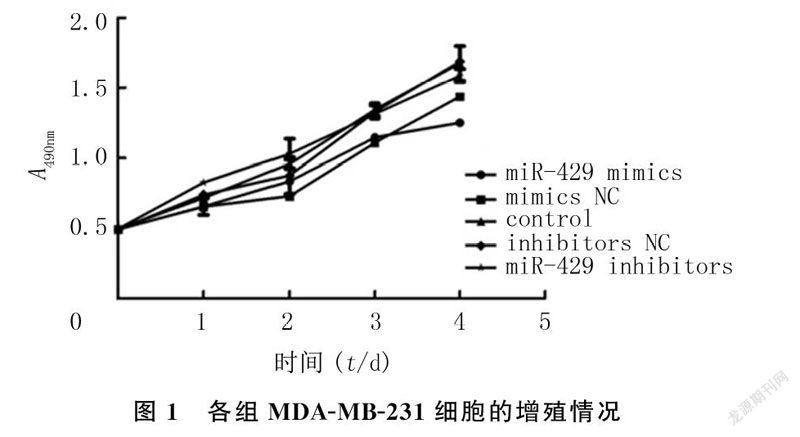
2.1miR-429对MDA-MB-231细胞增殖活力影响
miR-429表达情况与培养时间存在交互效应(F=5.941,P<0.05),miR-429表达对细胞增殖有显著影响(F=33.106,P<0.05),从培养3 d开始各组的增殖水平开始出现差异(F=24.468、19.130,P<0.05)。培养3、4 d时miR-429 mimics组细胞增殖能力较control组、inhibitors NC组、miR-429 inhibitors组明显减低(t=5.193~7.338,P<0.05),而miR-429 mimics组和mimics NC组细胞增殖能力无显著差异(t=1.243、3.121,P>0.05)。见图1。
2.2miR-429对MDA-MB-231细胞迁移能力影响
miR-429 mimics组、mimics NC组、control组、inhibitors NC组、miR-429 inhibitors组细胞的划痕愈合率分别为0.101±0.043、0.139±0.010、0.413±0.020、0.416±0.066和0.361±0.064,miR-429的表达对MDA-MB-231细胞迁移能力有显著影响(F=57.59,P<0.05)。组间两两比较,miR-429 mimics组和mimics NC组细胞迁移能力差异无显著意义(t=1.199,P>0.05),miR-429 mimics组细胞迁移能力较control组、inhibitors NC组、miR-429 inhi-bitors组明显减低(t=9.708~11.640,P<0.05)。
2.3miR-429在人乳癌細胞系MDA-MB-231和MCF-7中的表达
与非致瘤的上皮细胞系MCF-10A相比,人乳癌细胞系MDA-MB-231和MCF-7中miR-429的相对表达量分别为0.009±0.002(n=3)和0.007±0.002(n=4),差异均有统计学意义(t=921.264、1 233.490,P<0.05),结果表明miR-429在人乳癌MDA-MB-231和MCF-7细胞系中低表达。
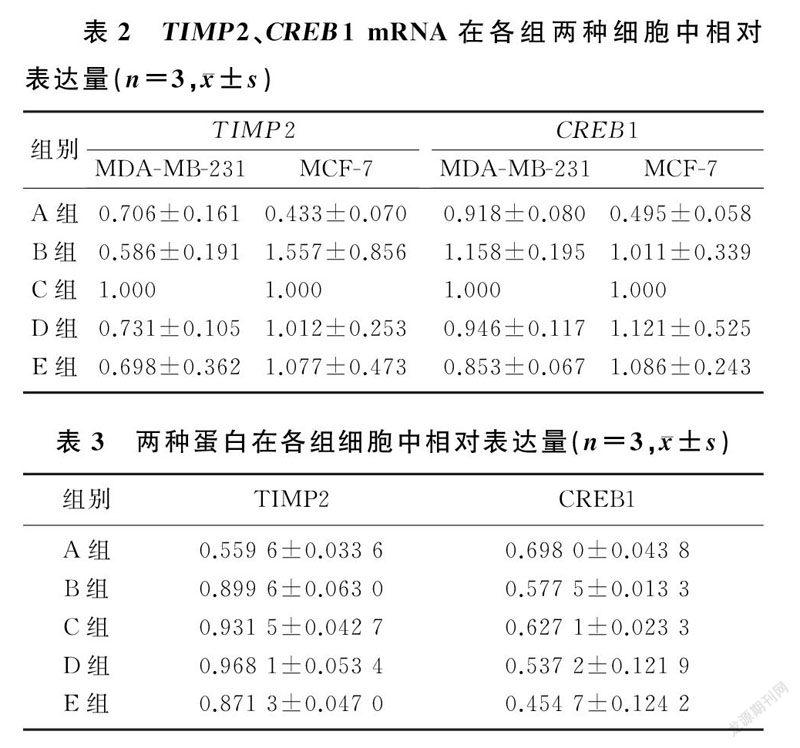
2.4过表达或抑制miR-429后预测靶基因mRNA水平的变化
通过生物信息学结合文献分析的方法得到预测靶基因TIMP2和CREB1。在MDA-MB-231细胞和MCF-7细胞中分别过表达和抑制miR-429,采用qPCR检测各靶基因的mRNA表达水平变化。与control组相比,在MDA-MB-231和MCF-7细胞中过表达和抑制miR-429,TIMP2和CREB1 mRNA相对表达水平无明显变化(P>0.05)。见表2。
2.5miR-429对MDA-MB-231细胞中TIMP2蛋白表达的影响
miR-429 mimics组TIMP2蛋白表达明显低于mimics NC组、control组、inhibitors NC组和miR-429 inhibitors组,差异有统计学意义(F=33.74,P<0.05);而CREB1蛋白在各组细胞中的表达差异无统计学意义(F=2.557,P>0.05)。见表3。
3讨论
目前,miR-429在乳癌中的生物学功能的研究较少。LI等[4]的研究结果表明,miR-429-5p通过LIMK1/CFL1通路显著抑制人乳癌MDA-MB-231和HCC1937细胞的增殖、迁移、侵袭和转移。秦科宇等[3]的研究表明,miR-429能够显著促进人乳癌Bcap37细胞的增殖和迁移。本研究采用qPCR方法检测显示,miR-429在人乳癌MDA-MB-231、MCF-7细胞系中特异性表达下调。miR-429 mi-mics组较control组和inhibitors NC组细胞增殖、迁移能力减低,说明过表达miR-429可明显抑制人乳癌MDA-MB-231细胞增殖和迁移。这与LI等[4]的研究结果相一致。本文MTT和划痕实验结果显示,miR-429 mimics组和mimics NC组细胞增殖和迁移能力无显著差异,可能是因为mimics NC样品不纯。外源性补充miR-429 inhibitors对人乳癌MDA-MB-231细胞增殖和迁移能力无明显影响,可能是由于单链miR-429 inhibitors对内源性miR-429抑制作用不显著。miR-429在不同人乳癌细胞系中发挥不同作用,可能与该细胞系中miR-429及其靶基因表达谱相关,也可能与其所处的肿瘤微环境不同有关。
miR-429对TIMP2的靶向调控作用已经在肺癌A549细胞系中得到证实[7]。该研究结果显示,miR-429在A549细胞中高表达,外源性过表达miR-429可显著促进细胞增殖、迁移和侵袭。本文研究结果显示,过表达miR-429的人乳癌MDA-MB-231细胞中,TIMP2蛋白表达水平明显减低,而TIMP2 mRNA表达水平则无明显变化,间接说明TIMP2是miR-429的靶基因,miR-429在蛋白质翻译过程中下调TIMP2的表达。
TIMP2是一种基质金属蛋白酶(MMP)抑制剂,被认为是肿瘤转移的抑制因子。目前已在多种恶性肿瘤中发现了TIMP2的表达失调[8-11]。有研究表明,TIMP2在乳癌[12-13]、卵巢癌[14]、肺癌[15]中呈高表达。TIMP2在体外降低生长因子介导的细胞增殖水平[16],抑制新生血管生成和肿瘤生长[17],不是通过抑制MMP的活性[16]。miR-429在肿瘤中的作用取决于TIMP2的多功能作用[18]。关于TIMP2在乳癌中抑癌作用的研究较少。本研究通过蛋白质印迹实验证明,miR-429对TIMP2的抑制作用显著。由本文MTT和划痕实验结果可推测,miR-429抑制细胞增殖和迁移并不全是通过下调TIMP2的表达而实现。
已有研究對miR-429在癌症中的作用机制进行了探讨。WANG等[19]研究结果表明,miR-429通过靶向TRAF6抑制NF-κB途径进而抑制肝癌的进展。TANG等[20]研究表明,miR-429通过靶向抑制PTEN的表达,激活PI3K/AKT/GSK-3β信号转导,导致β-连环蛋白的核转位,降低β-连环蛋白的磷酸化水平,促进肝癌细胞的侵袭和迁移。CHEN等[21]研究结果表明,miR-429的过度表达通过抑制Wnt/β-catenin通路,抑制卵巢上皮癌细胞的侵袭和化学耐药。生物信息学预测结果显示,miR-429调控多个靶基因及信号通路。miR-429参与乳癌发生发展的机制尚不明确,乳癌中miR-429更多的靶基因及miR-429调控TIMP2发挥抑癌作用的机制尚需进一步研究。
[1]BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function (reprinted from cell, vol 116, pg 281-297, 2004)[J]. Cell, 2007,131(4,S):11-29.
[2]CROCE C M. Causes and consequences of microRNA dysregulation in cancer[J]. Nature Reviews Genetics, 2009,10(10):704-714.
[3]秦科宇,李恒宇,许鹿,等. 微RNA-429调控人乳腺癌Bcap37细胞系的增殖和迁移能力[J]. 中华乳腺病杂志(电子版), 2015,9(2):89-95.
[4]LI Dengfeng, WANG Hong, SONG Hongming, et al. The microRNAs miR-200b-3p and miR-429-5p target the LIMK1/CFL1 pathway to inhibit growth and motility of breast cancer cells[J]. Oncotarget, 2017,8(49):85276-85289.
[5]UHLMANN S, ZHANG J D, SCHWGER A, et al. miR-200bc/429 cluster targets PLCgamma1 and differentially regulates proliferation and EGF-driven invasion than miR-200a/141 in breast cancer[J]. Oncogene, 2010,29(30):4297-4306.
[6]YE Zhibin, MA Gang, ZHAO Yahui, et al. miR-429 inhibits migration and invasion of breast cancer cells in vitro[J]. International Journal of Oncology, 2015,46(2):531-538.
[7]LANG Yaoguo, XU Shidong, MA Jianqun, et al. MicroRNA-429 induces tumorigenesis of human non-small cell lung cancer cells and targets multiple tumor suppressor genes[J]. Biochemical and Biophysical Research Communications, 2014,450(1):154-159.
[8]BAJRACHARYA D, SHRESTHA B, KAMATH A A, et al. Immunohistochemical correlation of matrix metalloproteinase-2 and tissue inhibitors of metalloproteinase-2 in tobacco asso-ciated epithelial dysplasia[J]. Disease Markers, 2014, 2014(3):197813.
[9]ELLINA M I, BOURIS P, ALETRAS A J, et al. EGFR and HER2 exert distinct roles on colon cancer cell functional pro-perties and expression of matrix macromolecules[J]. Biochimica et Biophysica Acta, 2014,1840(8):2651-2661.
[10]GURGEL D C, VALENCA-JUNIOR J T, DORNELAS C A, et al. Immunoexpression of metalloproteinases 2 and 14 and TIMP-2 inhibitor in main types of primary gastric carcinomas and lymph node metastasis[J]. Pathology & Oncology Research, 2015,21(1):73-81.
[11]NAGASE H, VISSE R, MURPHY G. Structure and function of matrix metalloproteinases and TIMPs[J]. Cardiovascular Research, 2006,69(3):562-573.
[12]BEN NEJIMA D, BEN ZARKOUNA Y, GAMMOUDI A, et al. Prognostic impact of polymorphism of matrix metalloproteinase-2 and metalloproteinase tissue inhibitor-2 promoters in breast cancer in Tunisia: case-control study[J]. Tumor Biology, 2015,36(5):3815-3822.
[13]ZHANG Ming, TENG Xiaodan, GUO Xinxin, et al. Expression of tissue levels of matrix metalloproteinases and their inhibitors in breast cancer[J]. Breast, 2013,22(3):330-334.
[14]HAO A, NOWAK-MARKWITZ E, DONIZY P, et al. Enhanced immunoreactivity of TIMP-2 in the stromal compartment of tumor as a marker of favorable prognosis in ova-rian cancer patients[J]. The Journal of Histochemistry and Cytochemistry, 2012,60(7):491-501.
[15]ZHU Lin, YU Hong, LIU Shiyuan, et al. Prognostic value of tissue inhibitor of metalloproteinase-2 expression in patients with non-small cell lung cancer: a systematic review and meta-analysis[J]. PLoS One, 2015,10(4):e0124230.
[16]CHOWDHURY A, BRINSON R, WEI B A. Tissue inhibitor of metalloprotease-2(TIMP-2):bioprocess development, phy-sicochemical, biochemical, and biological characterization of highly expressed recombinant protein[J]. Biochemistry, 2017,56(49):6423-6433.
[17]STETLER-STEVENSON W G, SEO D W. TIMP-2: an endogenous inhibitor of angiogenesis[J]. Trends in Molecular Medicine, 2005,11(3):97-103.
[18]BAKER A H, EDWARDS D R, MURPHY G. Metalloproteinase inhibitors: biological actions and therapeutic opportunities[J]. Journal of Cell Science, 2002,115(Pt 19):3719-3727.
[19]WANG Peng, CAO Jia, LIU Shihai, et al. Upregulated microRNA-429 inhibits the migration of HCC cells by targeting TRAF6 through the NF-κB pathway[J]. Oncology Reports, 2017,37(5):2883-2890.
[20]TANG Jing, LI Liang, HUANG Wentao, et al. MiR-429 increases the metastatic capability of HCC via regulating classic Wnt pathway rather than epithelial-mesenchymal transition[J]. Cancer Letters, 2015,364(1):33-43.
[21]CHEN Hong, XIA Bairong, LIU Tianbo, et al. KIAA0101, a target gene of miR-429, enhances migration and chemoresistance of epithelial ovarian cancer cells[J]. Cancer Cell International, 2016,16:74.
(本文編辑 马伟平)

