中药制剂新的药品不良反应与不规范说明书分析*
周歧骥 ,莫巧凤 ,刘承统 △
(1.右江民族医学院附属医院,广西 百色 533000; 2.右江民族医学院药学院,广西 百色 533000)
随着中药制剂品种的增多和应用范围的扩大,药品不良反应(ADR)报告日益增多[1]。2017年,国家药品不良反应监测年度报告数据显示,由中药引起的ADR达25.3万例次,占总ADR的16.1%;其中严重报告1.7万例次,占总ADR严重报告的10.6%。因此,中药制剂的安全性问题越来越受到关注和重视。当前我国中药制剂药品说明书存在的诸多问题,是导致其安全性事件的重要因素[2-5]。完整的药品说明书应包含药品的安全性和有效性等重要信息和结论,以指导临床安全、合理用药。但我国中药制剂药品说明书内容笼统,欠缺临床研究内容、药物使用警告等重要信息,导致医护人员和患者不能全面了解药物的特性及注意事项,安全隐患极大[6]。为此,本研究中通过统计我院5年中药制剂“新的药品不良反应”报告情况,分析其药品说明书不规范情况,为相关部门的药品说明书管理提供借鉴。
1 资料与方法
资料收集:收集医院2013年1月至2017年12月成功上报国家药品不良反应中心的ADR报告。通过Excel 2010软件筛选出中药制剂“新的一般”及“新的严重”ADR报告157份,对比ADR报告症状,查看药品说明书ADR描述情况,判断是否符合“新的ADR”报告标准。并根据“新的ADR”占总ADR的比例进行排序,取排名前10位的中药制剂,从发生ADR的症状、说明书ADR描述情况、是否有临床研究内容、说明书更新时间等方面进行统计与分析。
“新的ADR”判定标准:根据原卫生部令81号《药品不良反应报告和监测管理办法》,“新的ADR”是指药品说明书中未载明的ADR,说明书中已有描述,但ADR发生的性质、程度、后果或频率与说明书描述不一致或更严重的,按新的ADR处理。
2 结果
结果见表1至表3。
3 讨论
中药制剂“新的ADR”较多,许多常见症状也被冠以“新的ADR”,其原因与中药制剂说明书ADR的表述过少、更新时间慢或无有效更新有关。
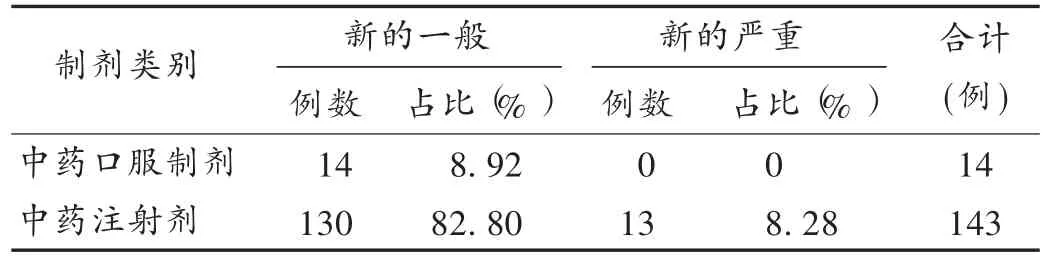
表1 157例中药制剂新的ADR分布情况(n=157)
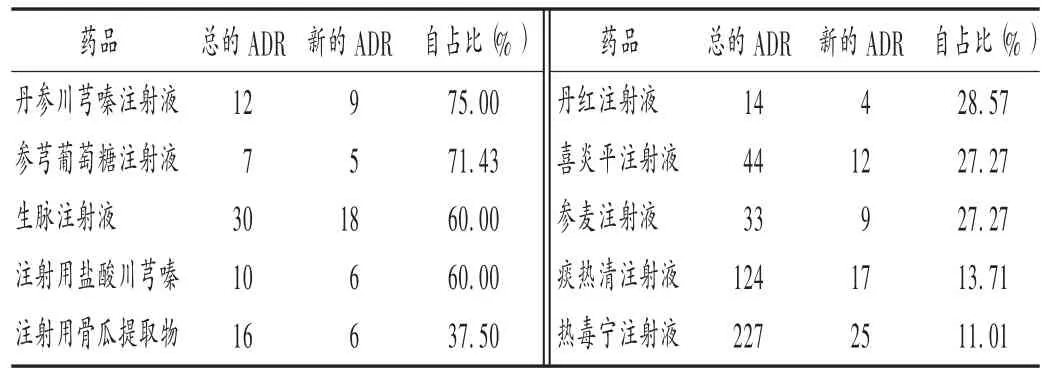
表2 中药制剂新的ADR占自身总ADR比例排名前10位的中药制剂

表3 新的ADR占总ADR比例前10位的ADR中药制剂症状及其说明书情况
药品说明书是指导医师开具处方和患者用药的具有法律效力的文本[7],应包含药品安全性、有效性的重要科学信息和结论,其内容是在上市前相对少量病例研究的基础上制订出来的,包含的信息并非一成不变,随着药品上市后的广泛使用和ADR的进一步监测,必然会积累更多相关信息,需要生产厂家及时对药品说明书进行补充和完善。纵观上述10种中药制剂ADR说明书,在安全性方面含糊其词,尽量避免提及,甚至不提及ADR,造成中药制剂“新的ADR”偏多,影响了国家ADR监测数据的真实性,给临床用药带来很大困扰,易误导医护人员及患者对该药的安全性认识,隐患极大。
在临床研究内容方面,除了痰热清注射液和热毒宁注射液有相关研究数据外,其他均无临床研究内容。药品上市前的临床研究是保证药品上市后安全性的重要环节,虽然中药来源于几千年的中医经验,相对安全,但毕竟中药汤剂经过炮制、煎煮等工序,且传统中医大部分采用口服汤剂,安全性相对较好,而现代中药制剂来源于对中药饮片的提取纯化,特别是注射剂直接注入体内,其安全性和疗效应通过临床研究予以确定[8]。国家中医药相关政策鼓励中医药创新,经典名方制剂在申请药品批准文号时,可仅提供非临床安全性研究资料,但上市后的安全性监测仍可反映药品的安全性和有效性,这些都是药品生产厂家必须及时跟进,并在药品说明书上有所体现的。由表3可见,大部分药品说明书更新的时间间隔为5~7年,且更新质量差,尤其在安全性方面并无实质性更新,这可能与药品生产厂家担心安全性资料影响销量有关[9]。
中药制剂与其他药品一样,均存在ADR,中药无毒副作用的错误观点仍在部分医师和患者中存在[10]。为更安全地使用中药制剂,发挥我国传统优势,在注重其有效性的同时,更应加强对其安全性的监测和研究,并及时在说明书进行标示和完善,从而起到有效预警和提早监测的作用[11]。
针对我国中药制剂说明书的管理现状建议如下:1)尽快在国家层面建立药品说明书的专业管理团队,全面负责我国药品说明书的管理,并与各药品监督管理部门协作[12],特别是国家药品不良反应监测中心,对经常发生的中药制剂ADR,应督促相关生产企业及时更新药品说明书[13]。2)完善中药制剂药品说明书相关的法律法规,制订明确、可操作性强的中药制剂药品说明书
修订流程。应由中药说明书专业管理团队起草,结合我国实际情况,并参照欧美经验,制订详细的中药说明书审核技术规范和管理流程,并在实践过程中不断完善相关制度和流程[12-15]。3)强化企业责任,明确药品申请人为药品说明书第一责任人,降低中药企业修订药品说明书的成本,并加大对不主动修改药品说明书行为的处罚力度,促使中药企业及时、主动修订说明书,从制度上推动中药企业加强对说明书的修订[12-13]。4)加强对药品使用环节的信息收集,医护人员是使用药品说明书最多的群体,清楚药品说明书存在的问题。说明书相关管理部门应设立专门的网络途径收集医师、护士、临床药师等对现有中药说明书的意见和建议,集思广益,才能不断完善对我国药品说明书的管理。
——南方医科大学广东省中药制剂重点实验室团队介绍

