萝卜缨有效成分含量及抗氧化活性研究
段树成,管桂林,曲珊珊,彭新颜,柳全文,金成武*
(1.鲁东大学 食品工程学院,山东 烟台 264025;2.青岛农业大学 食品科学与工程学院,山东 青岛 266109)
萝卜属于十字花科萝卜属,是我国重要的蔬菜作物之一[1]。目前我国萝卜的主要食用部位是萝卜根部,通常,萝卜缨在收获萝卜时被丢弃在田间地头,只有很少一部分被用作调味品来腌制泡菜、咸菜等[2]。萝卜缨性味甘苦平,富含精油、多种维生素和抗病毒成分,其蛋白质、维生素及微量元素含量远远高于萝卜根部,具有保肝、促进胃肠蠕动、保护心血管活性等功能[3,4]。在韩国,萝卜缨资源作为调味品得到了广泛的研究与发展,将萝卜缨粉末添加到面粉中对于松糕或者其他传统糕点,可使其具有良好风味,并且明显提高糕点的品质[5,6]。
本研究结合萝卜缨叶柄粗大、咀嚼困难、不易消化的现实问题,对萝卜缨叶柄和叶片有效成分含量及抗氧化活性差异进行研究,旨在改善萝卜缨浪费严重,利用率低的现状,为萝卜缨资源在调味品中的合理发展提供了理论参考价值。
1 实验材料与设备
1.1 实验材料
本实验使用的样品为青萝卜缨,品种为小缨萝卜(RaphanussativusL.),购于烟台。
1.2 实验试剂
无水乙醇、95%乙醇、甲醇、氯化亚铁、乙酸钾、过硫酸钾、三氯化铝、铁氰化钾、无水碳酸钠、三氯化铁、福林酚、没食子酸、槲皮素:均为分析纯。
1.3 实验设备
主要设备的名称与生产厂家见表1。
表1 实验设备与生产厂家Table 1 Experimental equipments and manufacturers
2 实验方法
2.1 样品前处理和提取物制备
2.1.1 样品前处理2.1.1.1 萝卜缨清洗后干燥
将萝卜缨清洗干净,放入65 ℃恒温鼓风干燥箱中干燥直至重量不变。
2.1.1.2 样品分离、粉碎
将干燥后的萝卜缨的叶柄和叶片分离,分别粉碎,装入密封容器中备用。
2.1.2 样品提取物制备2.1.2.1 样品提取
分别取一定量的叶柄和叶片粉末,加入80%的乙醇溶液,用超声波清洗机辅助多次提取至滤液变澄清为止。
2.1.2.2 样品浓缩与干燥
用真空旋转蒸发仪对滤液进行浓缩,直到浓缩成浓稠状半固体物。将浓缩后的叶柄和叶片样品放入-80 ℃的超低温冰箱中冷冻12 h,取出后放入真空冷冻干燥机中进行干燥,干燥品低温保藏备用。
2.2 有效成分含量测定
2.2.1 总酚含量测定
采用福林酚法进行样品总多酚含量测定[7]。配制不同浓度没食子酸标准溶液,分别吸取没食子酸标准溶液和叶柄、叶片样品反应液,依次加入反应试剂。为减小误差,实验时做3组平行实验,取平均值。以没食子酸的浓度为横坐标、吸光度A为纵坐标,绘制标准曲线图(y=0.0121x-0.0047,R2=0.9998)。
2.2.2 总黄酮含量测定
吸取蒸馏水2.8 mL、95%的乙醇1.5 mL,再加入各槲皮素标准溶液和样品反应液0.5 mL、10% AlCl3溶液0.1 mL和1 mol/L的乙酸钾溶液0.1 mL,混合均匀后在黑暗环境下反应40 min。在415 nm波长下测量其吸光度。为减小误差,实验时做3组平行实验,取平均值。以槲皮素的浓度为横坐标、吸光度A为纵坐标,绘制得到标准曲线(y=0.0068x+0.0036,R2=0.9996)。
2.2.3 HPLC分析2.2.3.1 Shimadzu 20A 型HPLC
由在线脱气机(DGU-20A5)、四元输液泵(LC-20AT)、进样器(SIL-20A)、紫外检测器(SPD-20A)、柱恒温控制箱(CBM-20A)组成。
2.2.3.2 HPLC分析条件
流速:1 mL/min;柱温:35 ℃;检测波长:280 nm;进样量:10 μL。色谱柱:Inertsil ODS-SP(4.6 mm×250 mm,5 μm);流动相:A:0.1%三氯乙酸的水溶液;B:乙腈;梯度洗脱程序:0~15 min,10%~15% B;15~40 min,15%~30% B;40~55 min,30%~50% B;55~65 min,50%~75% B;65~70 min,75%~90% B;液相色谱使用浓度为10000 mg/L的样品溶液,使用之前样品用孔径为0.22 μm针筒式滤膜过滤器过滤。
2.3 抗氧化活性测定
在抗氧化活性测定的实验中,均使用浓度为1000 mg/L的样品溶液。为减小误差,实验时均做3组平行实验。
2.3.1 DPPH自由基清除能力测定
分别取1 mL的叶柄提取液和叶片提取液于试管中,取1 mL 80%的甲醇溶液代替样品提取物作为对照。然后向所有试管中加入3 mL浓度为0.15 mmol/L的DPPH溶液。暗反应30 min测定各溶液在517 nm波长下的吸光度。对于样品的DPPH自由基清除能力用清除率表示:
DPPH自由基清除率(%)=(A对照-A样品)/A对照×100%。
式中:A对照为80%的甲醇溶液与DPPH混合溶液的吸光度;A样品为各样品提取液与DPPH混合溶液的吸光度。
2.3.2 ABTS自由基清除能力测定[8]
分别吸取叶柄和叶片溶液0.5 mL于不同的试管中,加入5 mL经稀释后A734 nm=0.70±0.02的ABTS溶液混合均匀,对照组用80%的甲醇溶液代替样品,其他条件不变。室温环境下静置反应10 min,在732 nm波长下测各样品的吸光度。对于样品的ABTS自由基清除能力用清除率表示:
ABTS自由基清除率(%)=(A对照-A样品)/A对照×100%。
式中:A对照为80%的甲醇溶液与ABTS混合溶液的吸光度;A样品为各样品提取液与ABTS混合溶液的吸光度。
2.3.3 铁离子螯合能力测定
分别吸取2 mL叶柄和叶片样品提取液于试管中,以蒸馏水作为空白组。依次加0.1 mL浓度为2 mmol/L的氯化亚铁、0.4 mL浓度为5 mmol/L的Ferrozine溶液、0.4 mL蒸馏水,用漩涡混合仪混匀。在黑暗环境下反应10 min后用分光光度计进行测定,波长设定为562 nm。吸光度值越小,表示铁离子螯合能力越强。样品对铁离子的螯合能力用螯合率表示:
螯合率(%)=(A0-A1)/A0×100%。
式中:A0为水与其他试剂混合溶液的吸光度;A1为各样品提取液和其他试剂混合溶液的吸光度。
2.3.4 还原能力测定
采用普鲁士蓝法测定萝卜缨不同部位的还原能力[9]。
3 结果
3.1 萝卜缨不同部位总酚含量的差异
在干燥的萝卜叶片样品中,含有6.54 mg/g总酚类物质;萝卜叶柄样品中,含有3.40 mg/g总酚类物质,见图1。萝卜叶片多酚类物质含量约为叶柄的1.9倍。
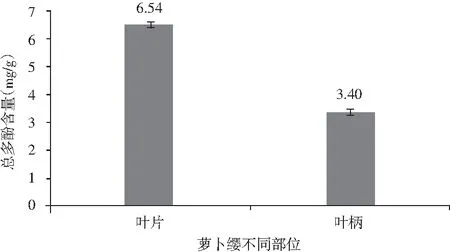
图1 萝卜缨不同部位干物质中总多酚含量Fig.1 The content of total polyphenols in different parts of radish leaves
3.2 萝卜缨不同部位总黄酮含量的差异
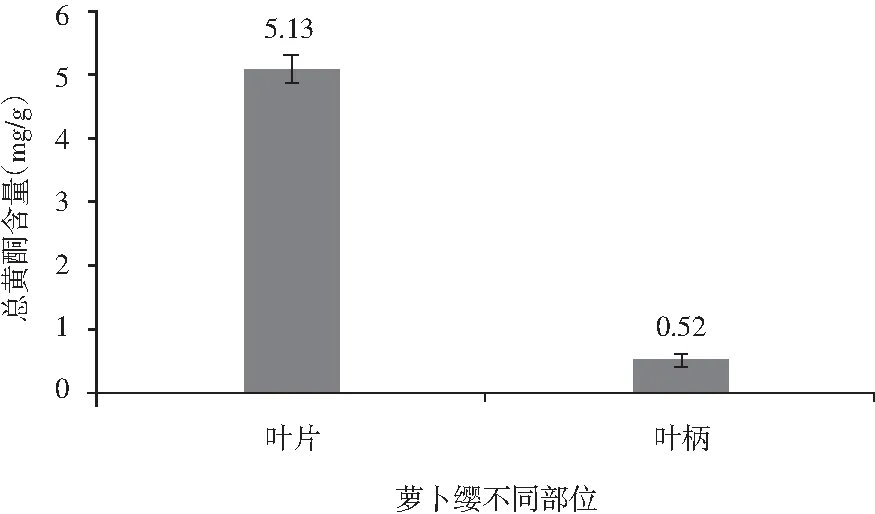
图2 萝卜缨不同部位干物质中总黄酮含量Fig.2 The content of total flavonoids in different parts of radish leaves
由图2可知,萝卜缨不同部位的总黄酮含量有较大的差异。每克萝卜叶片干物质中,总黄酮的含量约为5.13 mg;萝卜叶柄干物质中总酮物质的含量为0.52 mg/g。萝卜缨中的总黄酮主要集中在叶片部位,含量为叶柄的10倍之多。
3.3 萝卜缨不同部位HPLC 分析对比
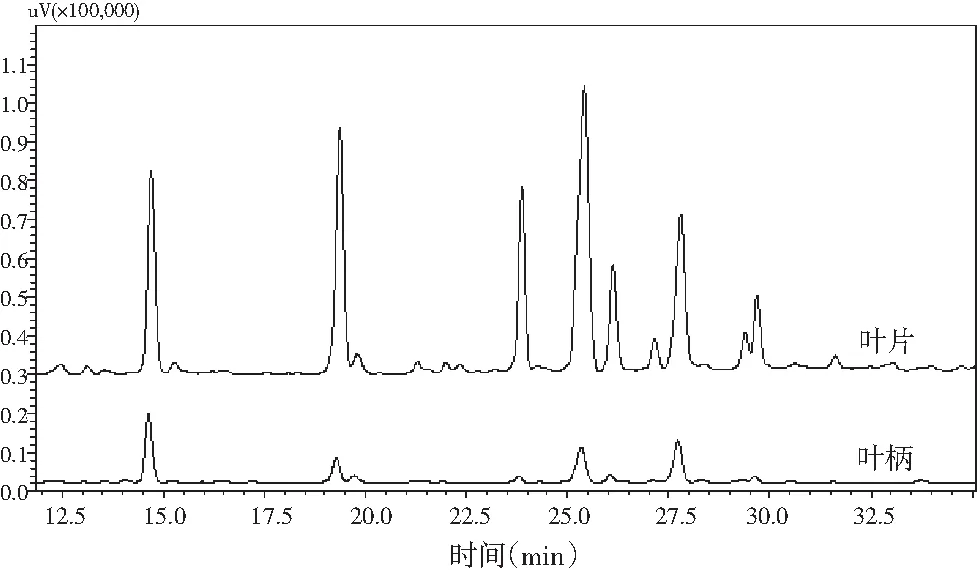
图3 萝卜缨不同部位HPLC分析 Fig.3 HPLC analysis of different parts of radish leaves
在图3高效液相色谱图中,出峰时间与物质的种类有关,峰面积与物质的含量成正比,通过高效液相色谱分析结果可以看出,萝卜缨叶片和叶柄的较大峰的出峰时间基本相同,为14.5,19.2,23.5,25.5,27.5,29.5 min等。换言之,在280 nm波长处萝卜叶片和叶柄中的化合物种类总体相同,但含量差别较大,同种物质在萝卜叶片中的含量比在萝卜叶柄中的含量高。猜测这可能会导致叶柄和叶片的抗氧化活性的差异,且叶片的抗氧化能力要高于叶柄。
3.4 抗氧化活性分析
3.4.1 萝卜缨不同部位DPPH自由基清除能力的差异
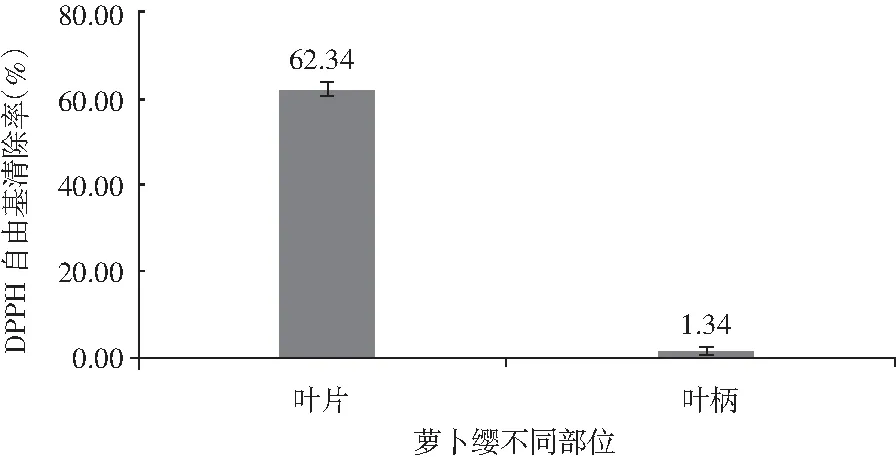
图4 萝卜缨不同部位DPPH自由基清除率Fig.4 DPPH radical scavenging rate in different parts of radish leaves
由图4可知,萝卜叶柄和叶片的DPPH自由基清除能力相差非常大,萝卜叶片的DPPH自由基清除率为62.34%,萝卜叶柄的DPPH自由基清除率仅为1.34%,其结果低于萝卜叶片近47倍。所以,萝卜缨中具有DPPH自由基清除能力的有效物质主要集中在叶片部位,且清除能力较高。
3.4.2 萝卜缨不同部位ABTS自由基清除能力的差异
由图5可知,萝卜叶片的ABTS自由基清除率超过50%,而萝卜叶柄的ABTS自由基清除率不到4%,不及萝卜叶片的1/10,可见萝卜叶片部分具有较强的抗氧化作用。
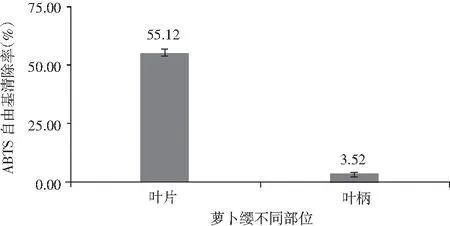
图5 萝卜缨不同部位ABTS自由基清除率Fig.5 ABTS radical scavenging rate in different parts of radish leaves
3.4.3 萝卜缨不同部位铁离子螯合能力的差异
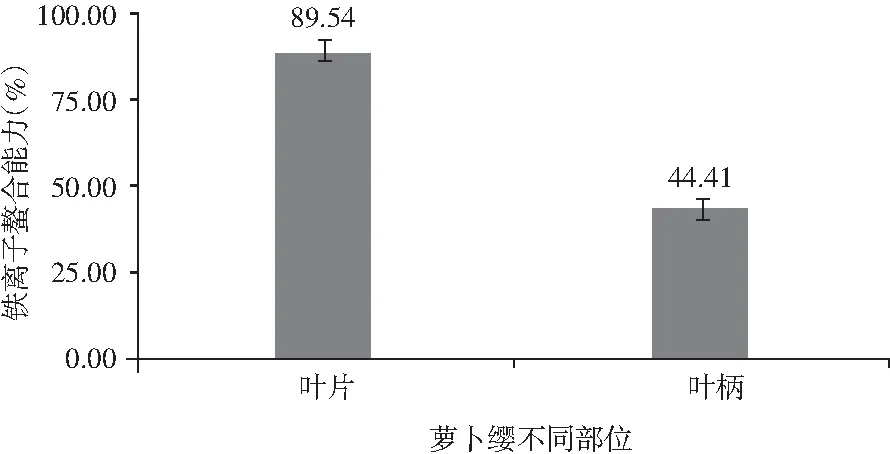
图6 萝卜缨不同部位铁离子螯合能力Fig.6 The chelating ability of iron ions in different parts of radish leaves
由图6可知,萝卜叶柄的铁离子螯合率为44.41%,叶片的铁离子螯合率为89.54%。萝卜叶片的铁离子螯合能力比较高,其铁离子螯合率是叶柄的2倍多,而萝卜叶柄的铁离子螯合能力不突出。
3.4.4 萝卜缨不同部位还原能力的差异
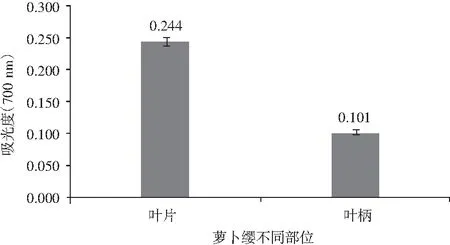
图7 萝卜缨不同部位还原能力Fig.7 The reducmg ability in different parts of radish leaves
由图7可知,萝卜叶柄和叶片都有一定的还原能力。叶柄在700 nm条件下的吸光度为0.101,叶片为0.244。萝卜叶柄和叶片相比较,叶片的还原能力高于叶柄的还原能力,是叶柄的2倍多。
4 讨论与结论
萝卜作为家喻户晓的蔬菜,已得到广泛种植与培育,而萝卜缨资源常常被丢弃。通过本研究发现,萝卜叶片、叶柄中总酚含量分别为6.54,3.4 mg/g,与Park等[10]研究中萝卜根的总酚含量0.24~0.27 mg/g、青萝卜的总酚含量0.40 mg/g相比可知,萝卜叶片和叶柄均比萝卜根、青萝卜的总酚含量高出数十倍,尤其是叶片中含量高达萝卜根的27倍,且萝卜叶片多酚含量约为萝卜叶柄的1.9倍之多。同时,与张皓月[11]研究发现的青萝卜根皮中黄酮含量0.85 mg/g、根肉中0.28 mg/g相比,萝卜叶片中黄酮含量约是根肉中的18倍,而萝卜叶柄中总黄酮含量为0.52 mg/g,介于根皮、根肉二者之间。因此,萝卜缨比萝卜根含有更多的有效成分,尤其是软而嫩的叶片部位含量最高,对萝卜叶片、叶柄的分离利用能获取更多的营养成分。通过进一步对萝卜叶片和叶柄的抗氧化活性研究,发现叶片具有更高的抗氧化活性,DPPH自由基清除能力、ABTS自由基清除能力、铁离子螯合能力以及还原能力等均显著优于叶柄。叶片的DPPH自由基清除率约为叶柄的46倍;ABTS自由基清除能力为叶柄的15倍之多。萝卜缨的抗氧化活性远高于萝卜根,与黑胡椒、山楂等物质接近[12-14]。可见,萝卜叶片抗氧化活性较高,具有极高的食用价值。多酚、黄酮类物质对氧化损伤有重要保护作用,同时大多数与抗氧化生理活性相关的化合物在280 nm波长处有较强的吸收[15-17]。通过该波长下进行的高效液相色谱分析结果可以看出,萝卜叶片与叶柄化合物种类相近,但同种物质在萝卜叶片中的含量远高于叶柄。总的来看,萝卜叶片总多酚、总黄酮含量远高于叶柄,抗氧化活性也呈现同种表现,这与Ziani等、Rafaela等[18]的研究中总黄酮、总多酚含量与抗氧化活性呈显著正相关的结果一致,从而证实了叶片多酚、黄酮类物质含量高,使其抗氧化活性明显优于叶柄。
本研究为开发萝卜缨资源的合理利用提供了理论基础,为调味品产业发展注入了新的血液。因叶片的风味优于叶柄且具有较高的营养价值,我们可以分而取之,为我们食品产业发展提供更有价值的食用方法,在鲜食的同时,还可以将原料腌制成咸菜、泡菜等,更可以以风味改善品质的方式加入到面粉、饮料等产品中,给日常生活带来新的体验。

