穿山甲属动物的DNA条形码及在穿山甲商品鉴定中的应用△
李婵,谢雪那,蔡炫,张秋楠,田恩伟,晁志
南方医科大学 中医药学院,广东 广州 510515
穿山甲为鲮鲤科动物穿山甲ManispentadactylaLinnaeus的鳞甲,始载于《名医别录》[1],具通经下乳、消肿排脓、搜风通络之功,可用于经闭癥瘕、乳汁不通、痈肿疮毒、风湿痹痛、中风瘫痪、麻木拘挛[2]。现代药理研究表明,穿山甲在降低血液黏度、升高白细胞、镇痛、抗炎和促使炎症修复等方面也有重要作用[3]。
穿山甲以白蚁为食,生活习性特殊,繁育困难,迄今未能成功实现人工养殖,供应完全依赖野生资源。近二三十年来,由于乱捕滥猎和栖息地的破坏,野生资源急剧减少,穿山甲药材的供应量大幅下降,价格日益增长,市场上出现从东南亚和非洲走私其他穿山甲属物种的甲片替代入药,以及多种其他掺假行为[4]。调查发现,药材市场上,中华穿山甲M.pentadactyla、马来穿山甲M.javanica、印度穿山甲M.crassicaudata、南非穿山甲M.temminckii、大穿山甲M.gigantea、树穿山甲M.tricuspis和长尾穿山甲M.tetradactyla均有发现[5-6]。其他用于掺假的有猪、牛、羊的蹄甲等。为保证临床用药的安全有效,有必要对穿山甲的来源进行准确鉴定。
目前,过度捕猎和走私猖獗使穿山甲属所有物种均濒临灭绝。世界自然保护联盟《濒危物种红色名录(2017)》将中华穿山甲和马来穿山甲列为“极度濒危”物种,将其他穿山甲物种列为“濒危”或“易危”物种。2017年,8种穿山甲均被列入《濒危野生动植物种国际贸易公约》(CITES)附录一。穿山甲的准确鉴定也是保护穿山甲的必要条件。
目前,穿山甲常用的鉴别方法为性状鉴别法,某些种类的穿山甲甲片的性状极相似,即使有专业的技术与丰富的经验,也难以对其基原进行准确鉴定。另外有薄层色谱法、红外光谱法、荧光分析法、离子色谱法、高效液相色谱法、高效毛细管电泳法等,这些方法多用在鉴别掺杂穿山甲、塑料制品、猪蹄甲等掺伪品[6-13]。与上述鉴别方法相比,DNA 分子技术不受样品形态、数量等限制,对于其基原鉴定具有独特的优势,因此近年来有不少研究者开始利用DNA分子鉴定法对穿山甲进行研究,如尹艳等[14]建立了穿山甲特异性多聚酶链式反应(PCR)鉴别方法,邢亚琳等[15]运用cytb基因、12S rRNA基因、随机扩增多态性DNA标记(RAPD)引物及微卫星引物对穿山甲进行鉴定等。
DNA条形码是目前公认可以对生物物种进行准确鉴定的技术。部分研究者应用此方法对穿山甲进行了研究,如邢亚琳[16]的DNA条形码研究中对3种穿山甲进行了分析;贾静等[17]对中华穿山甲及混伪品猪、牛、羊进行分析,但均缺乏对穿山甲属所有种及混伪品的全面分析。鉴于我国药材市场穿山甲来源复杂多样,利用DNA条形码技术鉴别穿山甲药材的基原,了解其商品流通的情况,对加强其质量控制具有一定的意义。因此,为进一步充实穿山甲DNA条形码鉴定的内容,本研究基于COI序列探讨DNA条形码鉴定穿山甲属及其他混伪品的可行性。
1 材料与方法
1.1 仪器
高速冷冻离心机(HC-3018R,安徽中科中佳科学仪器有限公司);电热三用水箱(BOS2,北京市医疗设备厂);电泳仪(DYY-6C,北京市六一仪器厂);多功能暗箱式紫外分析仪(CBIO-UV6A1,北京赛百奥科技有限公司);分析天平(ALC-210.4,ACCULAB);自动振荡器(MX-S,SCILOGEX);PCR仪(2720,Applied Biosystem);Nanodrop分光光度计(ND2000C,Thermo Fisher Scientific);迷你笔型电磨笔(18 V,上海辰灵贸易有限公司)。
1.2 试剂
琼脂糖(VetectM REAGENT grade Sigma-Aldrich,111860);无水乙醇(天津市大茂化学试剂厂,20180801);Proteinase K(TI ANGEN BIOTECH,R6830);血液/细胞/组织基因组DNA提取试剂盒(离心柱型)(TIANGEN BIOTECH,R6725);SuperRed/GelRed(Biosharp,68110160);D2000(TIANGEN BIOTECH,MD114);6×DNA loading buffer(TIANGEN BIOTECH,R6116);2×TaqPCR MasterMix(TIANGEN BIOTECH,R6525)。
1.3 材料
本研究收集了中华穿山甲及其混伪品共计11个物种38份样品,并从NCBI上下载了37条序列(均经质量检验,以确定下载序列与物种对应关系的准确性[18-19]),具体信息详见表1~2。中华穿山甲来自广州市野生动物救护中心。实验样品均经广州市野生动物救护中心邹洁建工程师和作者鉴定。另外,从各地药店及药企收集了35份穿山甲生甲片商品,具体商品信息详见表3。
1.4 方法
1.4.1 DNA提取 穿山甲甲片和蹄甲类伪品用无水乙醇浸泡12 h,每3 h将乙醇换一遍,同时通过振荡器轻轻振荡清洗;之后以去离子水重复以上步骤。在60 ℃烘干,在紫外灯下正反面分别各照射灭菌30 min。[16]然后用已灭菌的刀片刮去角质层的外层污染,取内层,用小型电磨机磨成细粉。取细粉约0.2 g,在裂解步骤中加500 μL GA、100 μL二硫苏糖醇(DTT)[20]、50 μL蛋白酶K,56 ℃水浴过夜,12 000 r·min-1离心2 min后取上清液,其余步骤按照血液/细胞/组织基因组DNA提取试剂盒(TIANGEN)说明书步骤提取样品DNA。
舌头及其他肌肉组织取约25 mg,按照血液/细胞/组织基因组DNA提取试剂盒(TIANGEN)说明书步骤提取样品DNA。

表1 穿山甲及其混伪品样品信息
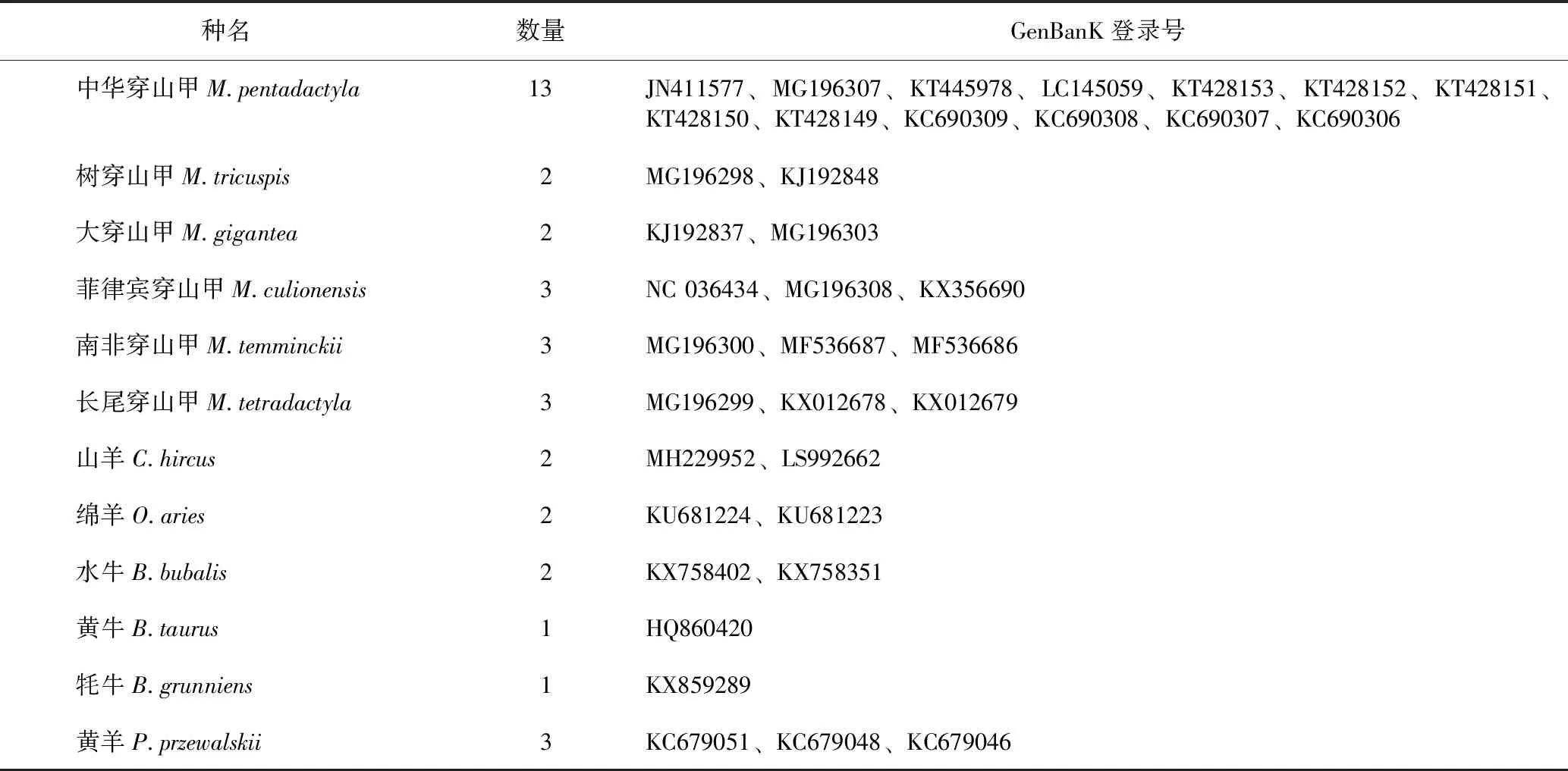
表2 GenBanK下载的穿山甲及其混伪品的序列信息

表3 穿山甲商品信息表
1.4.2 PCR扩增及测序 采用COI序列通用引物MCOI-F(CAACAAATCACAAAGACATCGG)、MCOI-R(TTCTGGGTGTCCGAAAAATCA)[16],对提取的DNA进行PCR扩增。扩增程序:95 ℃ 5 min;94 ℃ 30 s,50 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR反应体积为15 μL,包含6 μL 2×TaqPCR Mix(TIANGEN),正反向引物各0.5 μL[生工生物工程(上海)股份有限公司],模板DNA 2 μL,ddH2O 6 μL补足体积至15 μL。实验中设置无DNA模板的空白对照组。将PCR扩增产物送至上海美吉生物医药科技有限公司进行双向测序。
1.4.3 序列分析 用DNASTAR软件中的Seqman对所得序列进行拼接,去除引物区,并对碱基进行人工校对。将所有序列在MEGA(6.0版本)中对齐后,分析序列碱基组成和变异位点。
1.4.4 单倍型分析 用DNAsp v5软件对COI序列进行单倍型分析,并计算中华穿山甲的平均核苷酸多样性(pi)[21],将中华穿山甲中数量最多的序列规定为核心单倍型,其他序列则为稀有单倍型。以正品核心单倍型为标准序列,以稀有单倍型和其之间的相似度为正品的相似度范围,考察伪品所有单倍型与正品核心单倍型的相似度范围,确定正品的相似度鉴别指标。
1.4.5 种内、种间遗传距离分析及Barcode gap分析 将所有序列用MEGA软件进行K2P(Kimura 2-parameter)遗传距离分析。并利用TAXON DNA/Species identifier软件计算种内及种间遗传距离的分布频率,并在Excel中画出频率分布直方图,进行条形码间隙(barcode gap)分析[22]。
1.4.6 系统发育树的聚类分析 在MEGA软件中用邻接法(neighbor joining method,NJ)构建系统聚类树。系统树各分支的置信度用自举检验法(bootstrap test),检验各分支的支持率,共进行1000次循环。
1.4.7 ABGD划分 ABGD(Automatic barcode gap discovery)基于遗传距离对样品进行划分,划分在同一组的样品被认定为是一个种[23]。将样品对齐的序列在线提交到ABGD网站(http://wwwabi.snv.jus-sieu.fr/public/abgd/abgdweb.htm),参数设置为:种内差异先验值(prior intraspecific divergence)P为0.001到0.1,最小相对gap宽度值(Minimum relative gap width)X为1.0(K80)。
1.4.8 商品的鉴定 基于穿山甲及其混伪品的COI序列的单倍型信息及物种信息建立比对数据库,穿山甲商品序列可通过DNAMAN软件与自建穿山甲条形码数据库中的序列进行比对,从而确定商品的物种。通过邻接法与数据库的序列构建系统聚类树,系统树各分支的置信度用自举检验法(bootstrap test),检验各分支的支持率,共进行1000次循环。并用ABGD划分法对商品序列与数据库序列一起进行划分,参数设置与1.2.7一致。
2 结果
2.1 DNA条形码特征
2.1.1 COI序列碱基组成和变异位点 测序结果拼接且去除引物后得到658 bp的序列,所有序列对齐后长度为600 bp,其中变异位点有232个,碱基T、C、A、G平均含量分别为28.9%、27.6%、26.8%、16.7%。其中A+T含量(55.7%)明显高于G+C含量(44.3%),核苷酸碱基构成的偏倚是线粒体蛋白质编码基因的一个显著特征。
2.1.2 单倍型分析 穿山甲及其混伪品的75条600 bp的COI序列,分为了45种单倍型。中华穿山甲不同来源样品序列有16条,种内变异位点有12个,GC含量为0.44~0.45,共获得6种单倍型(Hap1~Hap6)。中华穿山甲COI基因片段的平均核苷酸多样性(pi)为0.003 78,单倍型多样性(Hd)为0.743。COI基因片段中,正品的稀有单倍型与其核心单倍型之间的相似度为98.83%~99.67%,而伪品所有单倍型与正品核心单倍型的相似度为79.50%~95.17%。表4和图1显示了中华穿山甲的单倍型类型及核心单倍型的序列。

表4 中华穿山甲单倍型类型

图1 中华穿山甲核心单倍型(Hap2)序列
2.1.3 种内及种间遗传距离分析 穿山甲及其混伪品的种内遗传距离为0~0.012,种内平均遗传距离为0.003 7,最大值出现在南非穿山甲Manistemminckii。种间遗传距离值为0.044~0.334,种间差异净值的最小值出现在马来穿山甲M.javanica与菲律宾穿山甲M.culionensis之间,为0.044;最大值出现在猪Susscrofadomesticus与黄羊Procapraprzewalskii之间,达到了0.334。种间平均遗传距离为0.255,远大于Hebert所推荐的物种鉴定最小种间遗传距离0.020[24-25]。种间平均遗传距离约为种内平均遗传距离的69倍,说明COI序列能够对穿山甲及其混伪品进行有效的鉴定。
2.1.4 Barcode Gap检验 Barcode gap检验结果(见图2)显示,穿山甲及其混伪品的种内遗传距离为0%~2%,种间遗传距离>3%,存在GAP区,即种内遗传距离最大值<种间遗传距离最小值,说明穿山甲及其混伪品的COI序列具有较高的种内稳定性和种间差异性,具有一定的遗传间隔。
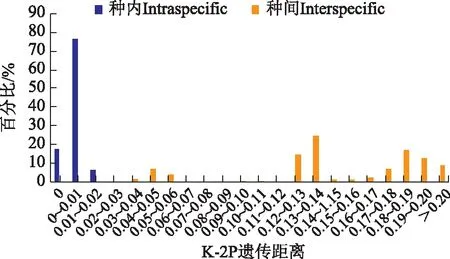
图2 种内和种间遗传距离的分布
2.1.5 系统发育树的聚类分析 由邻接法构建的系统聚类树(见图3)可知,中华穿山甲与其他混伪品均单独聚为一支,支持率均大于95%,各物种可以区分开。其中,这75条序列分成了2大支系,为穿山甲属和其他混伪品。穿山甲属又分成了2个支系:第一个支系为产于亚洲的种类,即马来穿山甲、菲律宾穿山甲、印度穿山甲、中华穿山甲,这个支系中又分为2个支系,马来穿山甲与菲律宾穿山甲聚为一支,印度穿山甲与中华穿山甲聚为一支。第二个支系为产于非洲的大穿山甲、南非穿山甲、树穿山甲、长尾穿山甲,在这个支系中也出现2个分支,大穿山甲、南非穿山甲为一分支,树穿山甲、长尾穿山甲为另一分支。
2.1.6 基于距离的分类分析 用ABGD对75个样品进行划分,结果包括初始划分和递归划分2种情况(见图4):初始划分较稳定,75个样品被分成12组。递归划分把75个样品分成1~31组;P值介于0.01~0.03时,75个样品被稳定地划分成15个组;这15个分组分别代表了研究的15个物种,与聚类分析结果呈一一对应关系(见图3)。
2.2 穿山甲商品的鉴定
35批穿山甲甲片商品COI序列与自建的穿山甲条形码数据库比对结果见表5。在商品序列与自建数据库的序列通过邻接法构建的系统聚类树中,A114、B103与中华穿山甲聚为一支;A101~A113、A115、A116、A130与印度穿山甲聚为一支;A117~A128、B101、B104与马来穿山甲聚为一支;A129、B102与大穿山甲聚为一支;A131与树穿山甲聚为一支。同样地,ABGD递归划分将35个样品分别划分进中华穿山甲组(A114、B103)、马来穿山甲组(A117~A128、B101、B104)、印度穿山甲组(A101~A113、A115、A116、A130)、大穿山甲组(A129、B102)和树穿山甲组(A131)。3种方法结果一致。

图3 基于COI序列构建中华穿山甲及其混伪品的NJ树及ABGD递归划分结果
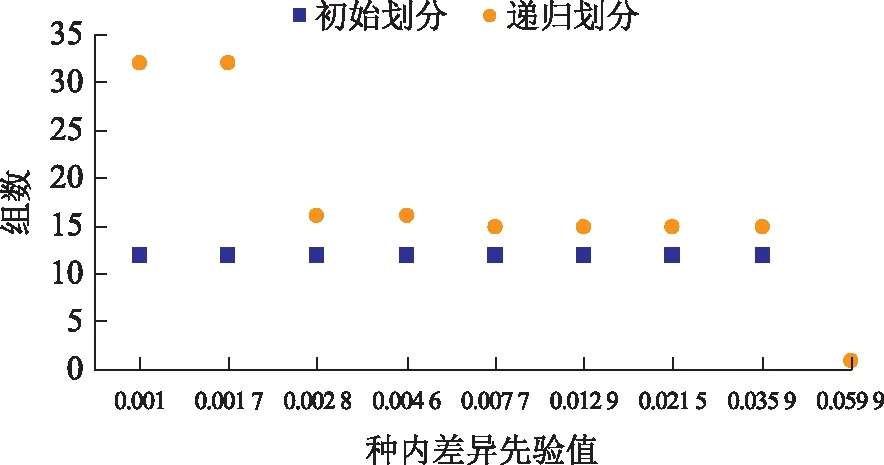
图4 75个样品的ABGD划分结果
综合以上结果可知,35份穿山甲商品中,仅有A114与B103为中华穿山甲(5.7%),其他样品均为伪品。其中,以印度穿山甲(45.7%)、马来穿山甲(40%)为最多。
2.3 印度穿山甲甲片性状特征
印度穿山甲甲片(见图5)因生长部位不同,形状大小也不一致。一般多呈扇面形,长1.8~6.2 cm,宽2.1~6 cm,厚1.76~4.66 mm。甲片外表呈褐色。背面宽端较厚,窄端较薄,中央较厚,边缘较薄。边缘圆滑整齐或被磨损,有的有皮肉残留。背面有多数纵向排列的线纹及在靠近顶端边缘的地方会有数条横线纹,背面的窄端较光滑,常有零乱与砂石摩擦的痕迹。内表面色较浅,中部有一条明显突起的弓形横向棱线,其下方有数条与棱线相平行的细纹,偶有残留皮脂飞边或毛,纵向凸起纹理的面向上隆起呈弧形。角质质地较轻(平均密度为1.57 g·cm-3),半透明。气微腥,味淡。

表5 35批穿山甲甲片商品比对结果

图5 印度穿山甲甲片
3 讨论
成功DNA提取是分子鉴定的基础。穿山甲甲片及混伪品蹄甲为高度角质化的材料,一般方法难以提取DNA。在本研究中,曾尝试用结合酶消化的酚-三氯甲烷法提取[24],耗时近一周;而用DTT结合试剂盒[26]的方法提取,仅需1 d即可提取成功。前者提取的DNA浓度高于后者,但因后者效率更高且扩增效率也好,最终选择DTT结合试剂盒的方法进行提取。在DNA提取之前,甲片及蹄甲应用无水乙醇浸泡消毒,再用无菌水浸泡,充分烘干后在紫外灯下照射消毒。在取样时,需刮去甲片及蹄甲表层,取内层,否则容易出现外源DNA的污染的情况,影响测序结果甚至出现扩增出菌的现象。
本研究利用COI通用引物对穿山甲及其混伪品的DNA进行扩增,均得到了100%的扩增效率与测序效率。采用Kimura-2-parameter模型计算遗传距离,发现种间平均遗传距离为种内平均遗传距离的69倍,满足种间差异是种内差异的10倍的条件,并且种间最小遗传距离大于种内最大遗传距离。Barcoding gap检验表明,穿山甲及其混伪品的COI序列具有一定的遗传间隔。
从构建的NJ树可以看出,15个物种75份样品均得到了较好的区分,各物种形成相对独立的支。其中,产于亚洲的穿山甲物种和产于非洲的穿山甲物种形成两个明显的分支,说明亚洲产穿山甲和非洲产穿山甲有明显分化,亲缘关系较远,将其区分成不同的属是合适的。亚洲支和非洲支又分别形成两个分支,即中华穿山甲与印度穿山甲、马来穿山甲与菲律宾穿山甲、大穿山甲与南非穿山甲、树穿山甲与长尾穿山甲。在新的分类系统中,穿山甲属仅包括4种亚洲产穿山甲。其中中华穿山甲与印度穿山甲能爬树,但主要营地栖生活,有观点将两者列为指名亚属Manis;马来穿山甲和菲律宾穿山甲均倾向树栖,后者以前一直作为前者的亚种,2005年才上升为独立的种;两者为另一亚属Paramanis。大穿山甲和南非穿山甲形体大,地栖,几乎不上树,在新的分类系统中归属于地穿山甲亚属,或另立地穿山甲属Smutsia。树穿山甲和长尾穿山甲则为树栖,基本不下地,分别代表树穿山甲亚属Phataginus和长尾穿山甲亚属Uromanis,或组成树穿山甲属Phataginus[26]。
ABGD法是一种基于barcode gap对序列进行分类的方法,它的优点是快速、简单,即便出现种内和种间遗传距离分布重叠的现象,也可以对数据集进行有效的划分[23]。在本研究中将ABGD法作为对数据分类的一种补充方法,与聚类分析结合,可为分类结果的正确性提供支持,使得研究更加完善。用ABGD法进行划分,初始划分只能对80%(12/15)的物种进行解析。在递归划分中,P值介于0.01~0.03时,为较可靠的分组[22];本研究中,15个物种在P值为0.01~0.03时,得到了稳定的划分,结果与形态鉴定结果、聚类分析结果呈对应关系。
综合以上结果可知,基于COI序列的DNA条形码是穿山甲属物种鉴定的有效手段,能够为穿山甲的快速鉴定提供可靠依据。
近年来已有穿山甲COI条形码研究的报道[14-17]。本研究中,除增加了大穿山甲实体样本外,更为重要的是建立的数据库中包含了目前全球穿山甲属物种所有的COI单倍型序列。另外,采取了序列相似性分析、系统发育树构建和ABGD递归划分3种方法进行综合鉴定。全面的数据库和综合鉴定手段,提高了穿山甲的鉴定效率和准确性。
应用DNA条形码的方法在穿山甲商品的鉴定中发现正品穿山甲甚少,主流商品为马来穿山甲和印度穿山甲。印度穿山甲以前较少报道,目前市场上逐渐增多。我们对印度穿山甲的性状特征进行了详细描述,发现其与中华穿山甲、马来穿山甲在形态上极为相似(树穿山甲和大穿山甲有比较明确的性状鉴别特征[6])。我们又对3种穿山甲甲片密度进行了测定,发现马来穿山甲、印度穿山甲、中华穿山甲的平均密度分别为1.49、1.57、1.60 g·cm-3;马来穿山甲质地较轻,而印度穿山甲与中华穿山甲的质地接近。虽然三者从性状上难以区分,但用DNA条形码可准确鉴定其基原。
基于COI序列的DNA条形码鉴别方法,可从分子水平实现对穿山甲的有效鉴定,为穿山甲的市场监管、打击非法贸易及保护穿山甲资源提供技术支持,具有重要的实用价值。目前,这种方法在市售鹿茸粉、僵蚕、海马等药材中也取得了成功,说明DNA条形码技术在动物药商品鉴定中是行之有效的,值得推广应用[27-29]。

