蚯蚓黏液促进玉米秸秆分解及其机理分析
陈玉香,赵婷婷,姚 月,徐立新
蚯蚓黏液促进玉米秸秆分解及其机理分析
陈玉香1,赵婷婷1,姚 月1,徐立新2
(1. 吉林大学生物与农业工程学院,长春 130022;2. 吉林大学生命科学学院,长春 130022)
为探究“蚓触圈”黏液对还田后玉米秸秆分解的作用,将玉米秸秆与烧灼过的石英砂混合,模拟还田后玉米秸秆分解过程。分别向该混合物中添加赤子爱胜蚓黏液、葡萄糖和谷氨酸。黏液总糖质量浓度为1.3 mg/mL,粗蛋白质量浓度为3.4 mg/mL。整个试验期间,黏液组碳氮矿化速率始终高于对照组,表明蚯蚓黏液对碳氮矿化具有促进作用,黏液的促进作用出现时间迟于葡萄糖和谷氨酸。对于细菌群落,黏液组ACE、Chao和Shannon-Wiener指数分别为630.24、640.08和4.90,对照组相应值分别为240.70、215.75和3.41。对于真菌群落,黏液组ACE、Chao和Shannon-Wiener指数分别为171.43、165.80和2.42,对照组相应值分别为71.56、70.58和0.50。表明黏液组微生物丰度和多样性均高于对照组。该研究结果表明,“蚓触圈”黏液对还田后玉米秸秆分解起着重要作用。
秸秆;分解;蚯蚓黏液;微生物组成
0 引 言
全世界作物秸秆年产量达74×109t[1],对如此大量的生物质进行恰当管理是环境保护的基本要求。作物秸秆还田能够提供可被植物利用的碳、氮和其他营养物质[2],因此秸秆还田不仅是一种有益的农业废弃物管理方法,也是一种提高土壤肥力的可行策略[3]。此外,秸秆还田也使农田土壤碳蓄积潜能增大[4],同时还增加了表层土壤(0~20 cm)的有机碳储存[5-6]。
蚯蚓是土壤生态系统中有益土壤动物之一,就生物量和活力而言,它也是土壤动物中最重要的食碎屑者[7]。蚯蚓与其周围环境构成“蚓触圈”[8]。据报道,一克生物量蚯蚓平均每天能产生5.6 mg黏液[9]。因此黏液是蚓触圈的重要组成部分。许多研究发现,蚯蚓黏液加速了堆肥过程中有机物的分解[10]。还有研究证实,添加简单易被微生物利用的有机物可促进土壤有机质矿化,释放二氧化碳,从而产生激发效应[11]。蚯蚓黏液是低分子量水溶性碳水化合物、氨基酸、糖苷和糖蛋白的混合物[12-13],黏液可以作为微生物的易同化碳源[14]。蚯蚓的黏液促进了新鲜植物残余物的矿化[9]。表明蚯蚓黏液对激发效应有一定的诱导作用,但是目前尚不清楚蚯蚓黏液如何影响还田后玉米秸秆的分解作用。
玉米秸秆是一种木质纤维素类作物残余物,由复杂聚合物组成,难以被降解。本研究中将玉米秸秆与烧灼过的石英砂混合,以模拟玉米秸秆还田。由于微生物在分解有机物过程中起主要作用,因此本研究对底物中微生物群落的组成进行了研究。纤维素酶与有机碳分解相关,蛋白酶和脲酶参与氮循环,脱氢酶是土壤生态系统微生物种群代谢活力的指标,且与氧化磷酸化过程有关[15]。本文研究了纤维素酶、蛋白酶、脲酶和脱氢酶活力随时间变化情况。本研究旨在认识蚯蚓黏液对玉米秸秆分解作用的影响;比较黏液和葡萄糖、谷氨酸对玉米秸秆分解作用的影响。
1 试验材料及方法
1.1 黏液和玉米秸秆
本研究中使用的黏液收集于赤子爱胜蚓,并且选择成蚓收集黏液。用蒸馏水冲洗蚯蚓至少4次。将蚯蚓放置于潮湿滤纸上,6 ℃暗环境中3 d以排除肠内容物。随后用无菌水冲洗蚯蚓,将其置于盛有20 mL无菌水的培养皿中,每皿放入3条蚯蚓,6 ℃暗环境中24 h,用20个培养皿收集黏液[9]。黏液用无菌水稀释10倍。风干玉米秸秆粉碎过0.25 mm筛。秸秆的C:N为75.45。
1.2 试验设计
将玉米秸秆粉与预先700 ℃烧灼过的石英砂(1:10)充分混合,混合物总有机碳质量分数为26.04 g/kg,pH值7.5。在试验开始时,添加上述方法所获取的蚯蚓黏液。每495 g混合底物添加20 mL黏液。为对比黏液与葡萄糖、谷氨酸的作用,也设置了葡萄糖、谷氨酸试验组,其中葡萄糖、谷氨酸溶液浓度与上述蚯蚓黏液中的总碳水化物含量或粗蛋白含量相当。本研究有4种处理方法:对照组CK(495 g混合底物+20 mL无菌水),Glc(495 g混合底物+20 mL 0.13 mg/mL葡萄糖溶液),Glu(495 g混合底物+20 mL 0.34 mg/mL谷氨酸溶液)和Muc(495 g混合底物+20 mL稀释后的黏液)。试验在塑料花盆中进行,每种处理方法有18盆,这是为了满足6个取样时间点,每次取样在3盆中进行,也就是每次取样用掉3盆。试验进行期间,通过喷洒灭菌水,使底物含水率维持在55%~65%左右。分别于第0、10、20、30、40、50天取样进行检测。
1.3 黏液主要化学成分分析
蚯蚓黏液是低分子量水溶性碳水化合物、氨基酸、糖苷和糖蛋白的混合物[12-13]。采用硫酸-苯酚法测定黏液总糖含量[16]。采用考马斯亮蓝法测定黏液总蛋白质含量[17]。采用聚丙烯酰胺凝胶电泳(SDS-PAGE)测定了黏液蛋白质分子质量[18]。
1.4 有机碳氮矿化速率
采用重铬酸钾和浓硫酸氧化法测定总有机碳含量(total organic carbon)[19]。有机碳矿化速率(min)计算如公式(1)。
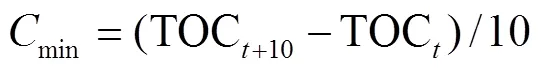
式中TOC指第天时有机碳含量,mg/kg;TOC+10指(+10)d时有机碳含量,mg/kg。
矿质氮含量是铵态氮和硝态氮含量之和,采用文献[20]方法测定铵态氮和硝态氮含量。氮的净矿化速率(min)计算如公式(2)

式中N指第天时的矿质氮含量,mg/kg;N+10指 (+10) d时矿质氮含量,mg/kg。计算6个采样日期(即第0、10、20、30、40、50天)之间S1(第0~10天)、S2(第10~20天)、S3(第20~30天)、S4(第30~40天)和S5(第40~50天)的碳和氮矿化速率, mg/(kg∙d)。
1.5 酶活力测定
羧甲基纤维素酶(CMCase)活力测定方法参考Chen等[21]。蛋白酶活力通过测定氨基酸释放量来测定,将1.0 g样品(鲜质量)与2%酪蛋白酸钠在50 ℃下保温2 h,随后在0.5 mL提取液中加入福林酚试剂,用BioTek酶标仪在700 nm波长测定吸光度[22]。蛋白酶活力是指每小时释放1mol酪氨酸所需的酶量。脲酶活力测定方法如下:1 g新鲜样品(1%)与尿素(1%)在38 ℃下保温3 h后,测定水解所释放的NH4+来确定酶活力[23]。脲酶活力是指每小时从尿素中释放1g NH4+所需酶量。脱氢酶活力测定采用氯化三苯基四氮唑(TTC)法,在30 ℃下保温24 h,通过TTC到三苯基甲酰胺(TPF)的还原速率来计算脱氢酶活力,在545 nm波长测定吸光度[24]。脱氢酶活力指每小时从1g TTC减少到TPF的所需酶量。
1.6 微生物群落结构分析
微生物群落结构分析使用E.Z.N.A.DNA提取试剂盒(OmegaBiotek,USA)。根据操作指南提取DNA,并用琼脂糖凝胶电泳确定其纯度。根据Chen等方法[21],扩增细菌16SrRNA基因V3-V4序列和真菌18SrRNA基因ITS序列,PCR产物使用AxyPrep DNA凝胶回收试剂盒(Axygen)纯化,纯化后的PCR产物进行高通量测序,委托中国上海美吉生物医药科技有限公司完成。根据Silva数据库[25]在97%相似水平将序列聚类成为操作分类单元(OTUs),计算丰度和Shannon-Wiener多样性指数。
1.7 统计分析
用SPSS16.0进行统计分析。采用两因素方差分析确定取样时间和不同处理(CK、Glu、Glc、Muc)对有机碳、氮矿化及酶活力的影响。在同一取样时间,用单因素方差分析不同处理对有机碳氮矿化和酶活力的影响。所有结果均以平均值±标准偏差(mean±SD)表示。当<0.05时,认为具有统计学意义。
2 结果与讨论
2.1 黏液主要化学成分分析
硫酸-苯酚法测得黏液中总糖质量浓度为1.3 mg/mL,考马斯亮蓝法测得黏液的粗蛋白质量浓度为3.4 mg/mL。
用丙烯酰胺凝胶电泳(SDS-PAGE)法得到赤子爱胜蚓黏液中蛋白质电泳图(图1),从图中可以看出,蚯蚓黏液中蛋白质的明显条带出现在44.3和22.1 kDa附近,此外,在44.3~97.2 kDa之间和22.1 kDa附近也存在条带。由标准蛋白质相对迁移率标准曲线计算,得到黏液中蛋白质明显条带的分子质量为44.6和21.5 kDa。我们在前期研究工作中也分析了黏液蛋白质的氨基酸组成,赤子爱胜蚓黏液的蛋白质由16种氨基酸构成,其中组氨酸、缬氨酸、天冬氨酸、谷氨酸含量相对较高[26]。
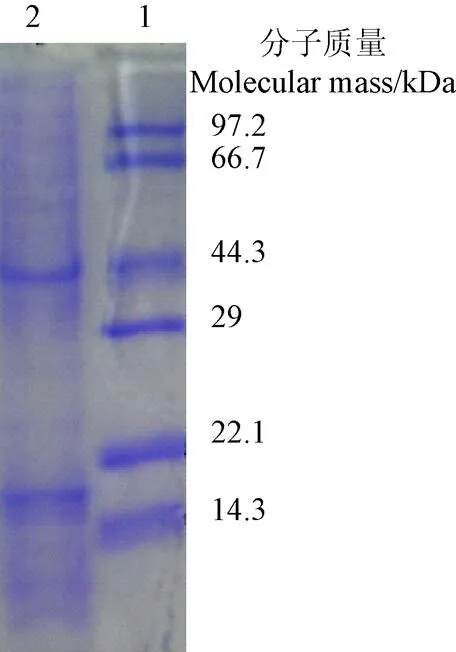
注:1.标准蛋白质 2.黏液
蚯蚓黏液中富含的糖、氨基酸为微生物生长提供了营养物质,进而增加了微生物的种类和数量,这与赵海涛等[27]的研究结果相一致。同时,环境中游离的氨基酸可以透过微生物的生物膜,直接被微生物利用合成目标蛋白或者为微生物的生长代谢提供氮源[28]。黏液中的糖类和氨基酸等物质促进了微生物的繁殖和代谢,从而提高了微生物产物即纤维素酶、蛋白酶、脲酶和脱氢酶的活性,最终加快了碳氮矿化速率,加快了秸秆的堆制进程。
2.2 添加物对碳、氮矿化的影响
处理方式明显影响碳矿化速率,并且其影响与取样时间有关。此外,取样时间与处理组之间存在显著交互作用(图2、表1)。在试验过程中,碳矿化速率呈现波动变化。在第10天时,Muc组碳矿化速率为0.83 mg/(kg∙d),而CK组、Glc组和Glu组分别为0.60、0.82和0.99 mg/(kg∙d)。表明,在第10天,添加黏液、葡萄糖、谷氨酸明显增加了碳矿化速率(单因素方差分析,=22.008,<0.00l)。在初期,添加黏液、葡萄糖和谷氨酸促进了碳矿化,而且黏液和谷氨酸的作用强于葡萄糖。在第20天时,所有处理组的碳矿化速率都极低。这与Kuzyakov and Bol[29]研究结果相似,他们认为,碳是依据可被利用的难易程度依次利用。蚯蚓黏液是低分子量水溶性碳水化合物、氨基酸、糖苷和糖蛋白的混合物[12-13]。本研究所添加的糖、氨基酸和黏液很容易被微生物群利用,这些物质在短时间内迅速被微生物同化。Kuzyakov and Bol[29]还发现,在微生物集中利用活性碳源期间,惰性碳(本研究中的秸秆)分解明显减慢。
表1 取样时间与处理方式对碳氮矿化影响的统计分析
这就可以解释为什么在第20天时碳矿化速率极其低。第30天时,Muc组碳矿化速率明显高于Glc组、Glu组和CK组(单因素方差分析,=3.319E3,<0.001),其值为1.16 mg/(kg∙d)。在第40天时,Glc组、Glu组和CK组的碳矿化速率比第30 天有所增加,然而Muc组的却在下降,这可能是由Muc组秸秆先于其他组达到降解稳定。糖和氨基酸等低分子量物质会迅速被微生物分解利用[30],微生物对添加这些物质迅速作出响应,引发有机质分解的激发效应[31]。Kuzyakov and Bol认为,激发效应涉及一系列作用机理[29]:优先利用易被利用的底物,激活相关微生物,然后根据底物可被利用难易程度依次利用,最后回归到初始状态,本研究中的碳矿化状况与此一致。Glc组和Glu组的碳矿化速率在第10天出现最大值。添加黏液、葡萄糖和谷氨酸对底物的碳矿化均有促进作用。与添加葡萄糖和谷氨酸对比,黏液的促进作用出现稍迟一些,这与Bityutskii等的结果是一致的[9]。葡萄糖和谷氨酸比黏液更容易被微生物利用,因此,更早出现激发效应。Muc组的碳矿化速率始终高于CK组,尤其是在第30天。因此,我们分析了第30天的Muc组和CK组样品的微生物群落结构。
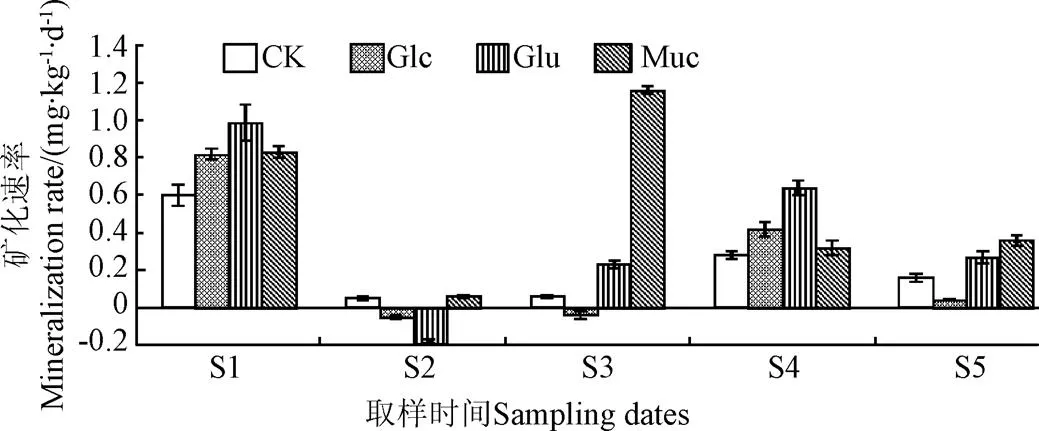
注:CK:对照组;Glc:葡萄糖处理组;Glu:谷氨酸处理组;Muc:黏液处理组;S1:第0~10天;S2:第10~20天;S3:第20~30天;S4:第30~40天;S5:第40~50天。下同。
处理方式对氮矿化有显著影响,并且其影响作用与取样时间相关。此外,取样时间与处理方式之间存在显著的交互作用(图3、表1)。整个试验过程中,氮矿化速率呈现波动变化。在第10天时,Muc组的氮矿化速率最高(单因素方差分析,=177.348,<0.001),而CK组的氮矿化率最低,表明添加黏液、葡萄糖和谷氨酸在此阶段对氮矿化有促进作用,并且黏液的促进作用最为明显。在第20天时,所有处理组均出现负矿化速率。然而在第30天时,仅有Muc组呈现负矿化速率。在第40天,Glc组和Muc组呈现正矿化速率,而CK组和Glu组呈现负氮矿化速率。在第50天时,仅Glc组呈现负矿化率。试验初期,全部处理组出现正氮矿化速率,表明底物中的有机氮被微生物分解,并且黏液对分解作用的影响最大。第20天时,处理组均出现负氮矿化速率。这是由于添加易于利用的物质,如糖、氨基酸或黏液能够激活微生物[29]。矿化速率为负值,表明微生物作用总的结果是固氮作用。在此阶段,Muc组和Glc组对氮矿化的影响较强(单因素方差分析,=122.011,<0.00l)。
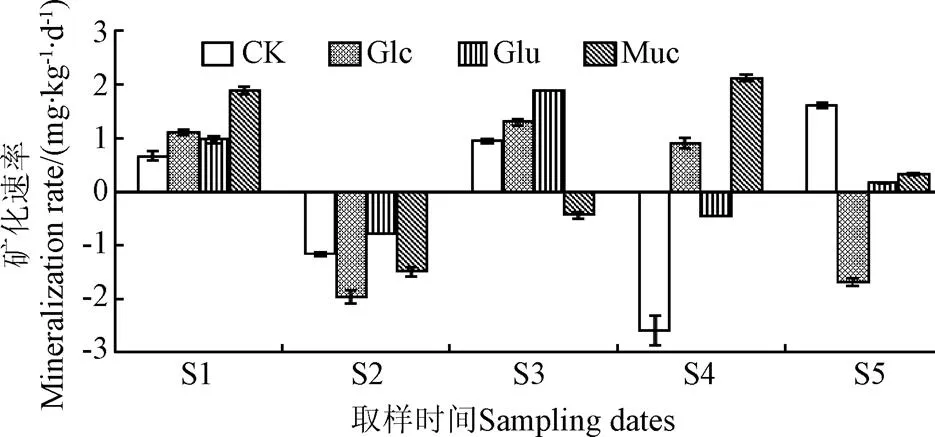
图3 玉米秸秆的氮矿化
2.3 添加黏液、葡萄糖及谷氨酸对关键酶活力影响
2.3.1 羧甲基纤维素酶
不同处理组间CMCase酶活力有显著差异,同一处理组不同时间CMCase酶活力也有显著差异。此外,取样时间与处理组之间存在交互作用(表2)。初期Muc组、Glu组和CK组中的CMCase的酶活力增加,在第30天到达峰值(图4a),随后CMCase酶活力开始下降。Glc组中,CMCase活力的变化表现为双峰型。第1个峰值在第10天前后出现,第2个峰值是在第30天左右。Muc组CMCase酶活力的波动与碳矿化速率相一致。第10天时,Muc组羧甲基纤维素酶活力是CK组的4倍。添加黏液和谷氨酸组,CMCase活力明显提高,进而加快纤维素降解。
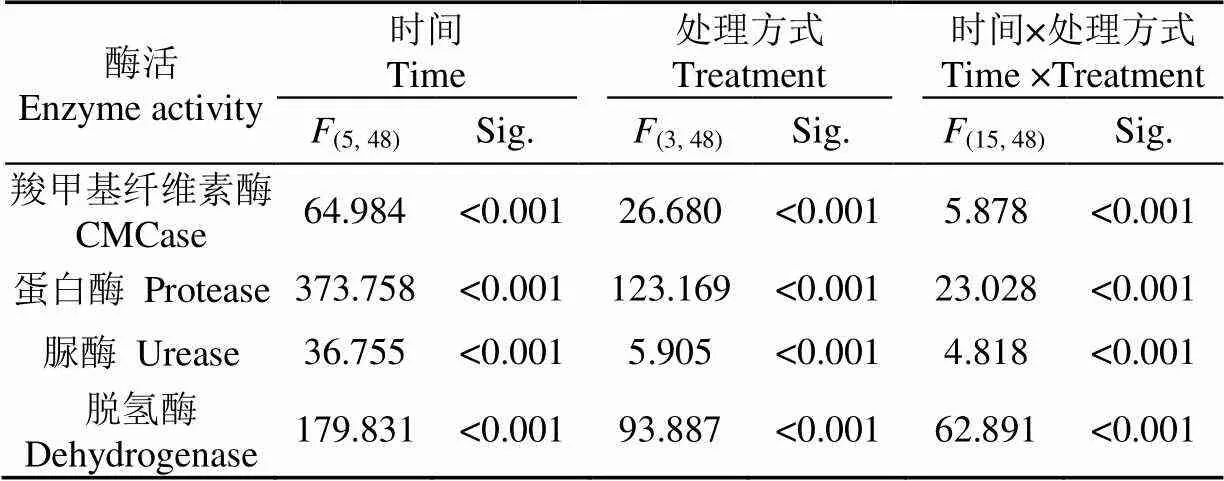
表2 取样时间与处理方式对酶活力影响的统计分析
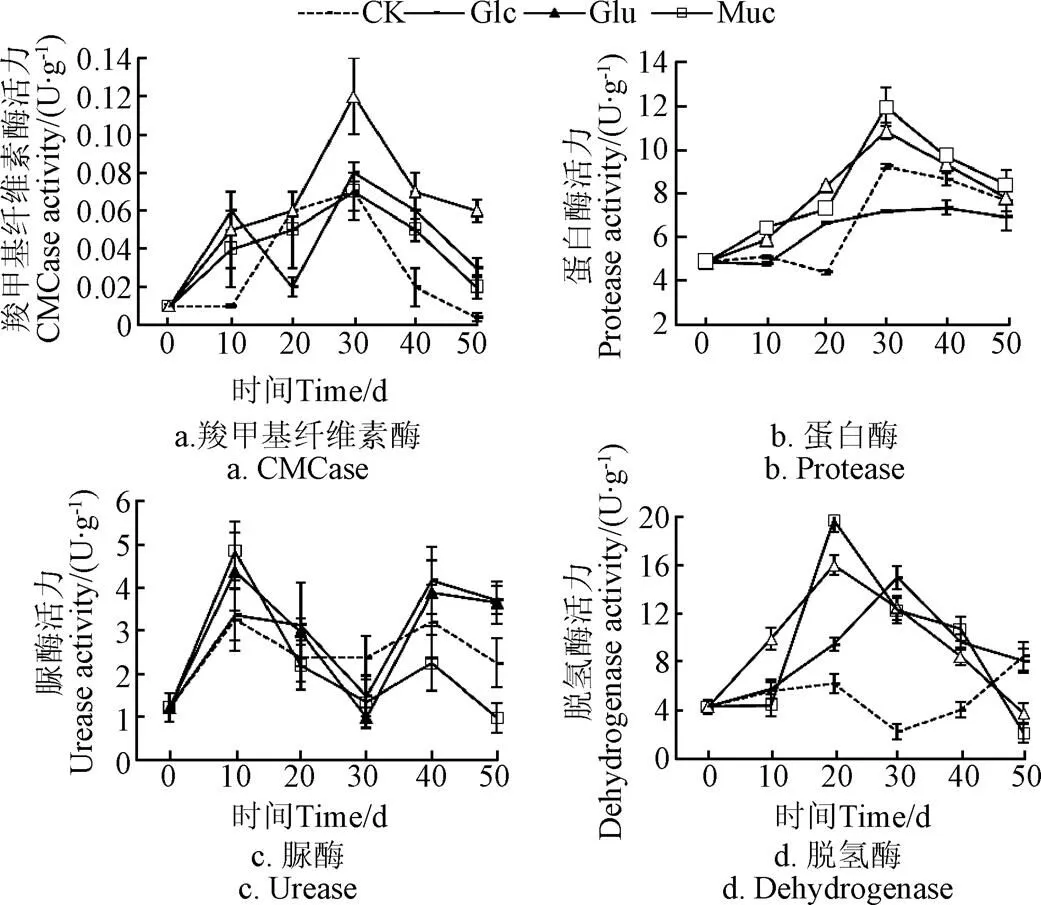
图4 玉米秸秆分解过程中羧甲基纤维素酶、蛋白酶、脲酶、脱氢酶活力
2.3.2 蛋白酶
在整个试验过程中,Muc组、Glu组蛋白酶活力均高于CK组和Glc组(图4b)。蛋白酶活力显著受处理方式影响且与时间相关。此外取样时间与处理组之间存在显著的交互作用(表2)。蛋白酶活力从第0天至30天呈现上升趋势。在第10天时,Muc组、Glu组、Glc组和CK组的蛋白酶活力分别为6.45、5.93、4.79和5.12g/(g∙h)。4个处理组(单因素方差分析,=324.626,<0.001)间存在显著差异。蛋白酶催化含氮化合物的解聚,释放可溶性有机氮,被认为是氮循环的关键步骤,因为微生物无法利用氮的聚合物[32]。在第10天时,Muc组蛋白酶活力最高,表明该组氮矿化速率最高。从第10天到30天,Muc组和Glu组的蛋白酶活力快速上升,而Glc组和CK组蛋白酶活力则缓慢增加。从第30天开始,蛋白酶活力开始下降。初期蛋白酶活力较高,与Jurado等[33]的报道结果一致,他们认为分解蛋白质微生物通常在有机物分解的初始阶段较为活跃。
2.3.3 脲酶
脲酶活力呈现双峰,第1个峰值出现在第10天,第2个峰值出现在第40天(图4c)。脲酶活力显著受处理方式影响且与时间相关,此外时间与处理方式之间存在显著的交互作用(表2)。在第10天时,Muc组、Glu组、Glc组和CK组的脲酶活力分别为4.84、4.36、3.36和3.25g/(g∙h)。Muc组脲酶活力是CK组的1.5倍。此时Muc组高氮矿化速率与高脲酶活力相关联。脲酶催化底物中的尿素转化为二氧化碳和氨[15]。脲酶活力从第10天开始下降,与第20天前后的负氮矿化速率相一致。从第30天至第40天,脲酶活力增加,这与Muc组和Glc组氮矿化速率的增加相吻合。
2.3.4 脱氢酶
在整个试验过程中,Muc组、Glu组、Glc组脱氢酶活力明显高于对照组(图4d)。脱氢酶活力受到处理方式的显著影响,且与时间相关,时间与处理方式之间存在显著的交互作用(表2)。Muc组和Glu组脱氢酶活力在第0~20 天呈上升趋势,随后开始下降。Muc组脱氢酶活力峰值为19.71g/(g∙h),而Glu组为15.99g/(g∙h)。Glc组脱氢酶活力从第0天开始升高,至第30天开始下降,其峰值为14.96g/(g∙h)。CK组脱氢酶活力在试验结束时最高,为8.48g/(g∙h)。脱氢酶活力表征土壤生态系统或其他生物转化过程中微生物活力[34],脱氢酶酶活力较高,说明活力微生物活性较强。脱氢酶活力随时间变化反映了试验过程中微生物活性的变化。Muc组、Glu组和Glc组中,脱氢酶活力在初始阶段呈上升趋势,直至达到峰值之后下降。试验结束时底物脱氢酶活力较低,表明底物趋于稳定。试验后期脱氢酶活力下降与蛋白酶活力的下降是一致的。
2.4 微生物群落结构
2.4.1 微生物多样性分析
对高通量测序数据分析,去除低质量序列后,Muc组细菌序列21 762个,真菌序列27 313个,平均读取长度分别为435.96和260.47 bp,CK组细菌序列18 141个,真菌序列26 610个,平均读取长度分别为435.45和230.29 bp。
设置97%相似度水平下,Muc组和CK组的细菌OTU数量分别为566和167(表3),真菌OUT数量分别为在152和63。丰度和多样性指数与此呈现一致趋势(表3)。对细菌来说,Muc组的ACE和Chao的平均值分别为630.24和640.08,而CK组的相应值分别为240.70和215.75,Muc组细菌群落的ACE和Chao的平均值分别是CK组2.6和3倍。Muc组Shannon-Wiener多样性指数为4.90,而CK组为3.41,Muc组细菌群落Shannon-Wiener多样性指数分别是CK组的1.4倍,表明Muc组细菌丰度和多样性均高于对照组。对于真菌群落,Muc组的ACE和Chao的平均值分别为171.43和165.80,而CK组的相应值分别为71.56和70.58,Muc组真菌群落的ACE和Chao的平均值分别是CK组的2.4倍和2.3倍。Muc组Shannon-Wiener多样性指数为2.42,而CK组为0.50,Muc组真菌群落Shannon-Wiener多样性指数分别是CK组的4.8倍,也就是说Muc组的真菌的丰富度和多样性也较高。结果表明,黏液对微生物群落的丰度和多样性有显著促进作用,这可能是因为蚯蚓黏液含有容易被微生物吸收利用的低分子量碳水化合物、氨基酸、糖苷和糖蛋白等物质[12-14]。
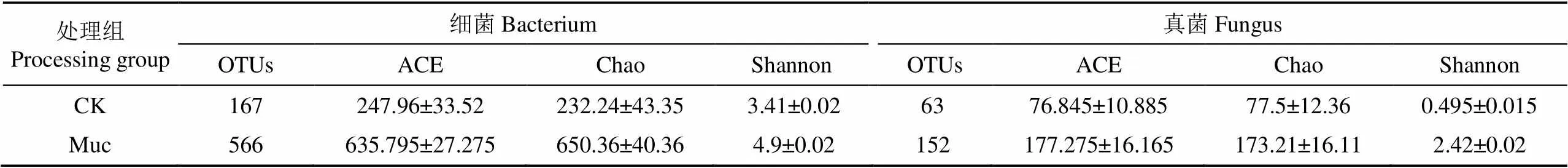
表3 16S rRNA和18S rRNA基因文库的OTUs丰度和多样性指数的比较
2.4.2 微生物群落组成分析
Muc组中,细菌的优势属为Candidate_ division_TM7_norank、Phyllobacteriaceae_unclassified、、和(图5a),其相对丰度分别为6.74%、6.43%、5.01%、4.95%和4.75%。还有和,相对丰度分别为3.5%和2.5%。CK组中,优势细菌为、、Candidate_division_TM7_norank、_ unclassified、、根瘤菌和,其相对丰度分别为23.09%、10.00%、8.79%、7.38%、5.75%、5.32%和5.10%。在分类学上未确定或相对丰度低于0.5的序列被指定为“其他”序列。属的一些微生物是纤维素分解菌[35],该属的某些物种可有效分解结晶纤维素,并可利用结晶纤维素作为其唯一的碳和能量来源[36]。是典型的分解纤维素微生物[37]。的某些微生物在碳氮矿化过程中起着重要的作用。例如,KCTC 22041T具有还原硝酸盐的能力,并能利用纤维二糖作为碳源[38]。部分属促进硝酸盐还原,且影响脲酶活力[39]。

图5 两种处理组中细菌属和真菌属的比较
与对照组相比,Muc组的分解纤维素微生物及催化氮矿化微生物的相对丰度较高。Muc组中,真菌的优势菌为Incertae_unclassified、、Sordariomycetes_ unclassified、Fungi_unclassified和(图5b),相对丰度为31.85%、22.66%、17.70%、16.37%和8.89%。对照组的优势真菌为、、_unclassified和Incertae_unclassified,其相对丰度分别为90.57%、3.52%、3.24%、1.01%。特别值得注意的是,与CK组对比,Muc组镰刀菌属的相对丰度显著增加。据报道[40],该属的某些微生物具有分解木质纤维素能力。例如,产生内切葡聚糖酶和木聚糖酶[40],参与有机碳循环。具备将亚硝酸盐转化为N2O的能力[41-42]。属在木质纤维素物质分解和碳氮循环中起着关键作用,该菌是添加黏液处理组的优势微生物。
3 结 论
1)与对照组对比,添加赤子爱胜蚓黏液,对玉米秸秆分解过程中的碳、氮矿化有促进作用。整个试验过程中,Muc组的碳矿化速率始终高于CK组。第10天时,Muc组的氮矿化速率最高。
2)与葡萄糖组和谷氨酸组比较,黏液的促进作用出现时间较迟。试验中,Glc组和Glu组的碳矿化速率均在第0~10 天有最大值,而Muc组在第20~30天有最大值;Glc组、Glu组的最大氮矿化速率均在第20~30天,而Muc组在第30~40天。
3)添加黏液可以提高纤维素酶、蛋白酶、脲酶和脱氢酶活力。在整个试验过程中,Muc组蛋白酶、脱氢酶活力均高于CK组。第10天时,Muc组羧甲基纤维素酶、脲酶活力分别是CK组的4倍和1.5倍。
4)蚯蚓黏液中富含的糖、氨基酸为微生物生长提供了营养物质,进而增加了微生物的种类和数量。黏液处理组的微生物丰度和多样性均高于对照组。Muc组细菌群落的ACE和Chao的平均值分别是CK组2.6和3倍;Muc组真菌群落的ACE和Chao的平均值分别是CK组的2.4倍和2.3倍。此外,Muc组细菌和真菌群落Shannon- Wiener多样性指数分别是CK组的1.4倍和4.8倍。
5)黏液处理组的优势微生物为降解木质纤维素微生物,其中部分微生物参与氮循环。Muc组相对丰度是CK组的2.5倍。其中,该属的某些微生物具有分解木质纤维素能力。研究结果表明,“蚓触圈”的黏液对还田后的玉米秸秆分解起着重要的作用。
[1] Medina J, Monreal C, Barea J M, et al. Crop residue stabilization and application to agricultural and degraded soils: A review[J]. Waste Manage, 2015, 42: 41-54.
[2] Kumar K, Goh K. Crop residues and management practices: Effects on soil quality, soil nitrogen dynamics, crop yield, and nitrogen recovery[J]. Adv Agron, 2000, 68: 197-319.
[3] Singh B, Shan Y H, Johnson-Beebout S E, et al. Crop residue management for lowland rice-based cropping systems in Asia[J]. Adv Agron, 2008, 98: 117-199.
[4] Lal R, Bruce J. The potential of world cropland soils to sequester C and mitigate the greenhouse effect[J]. Environ Sci Policy, 1999, 2: 177-185.
[5] Choudhury S G, Srivastava S, Singh R, et al. Tillage and residue management effects on soil aggregation, organic carbon dynamics and yield attribute in rice-wheat cropping system under reclaimed sodic soil[J]. Soil Tillage Res, 2014, 136: 76-83.
[6] Sun H Y, Wang C X, Wang X D, et al. Changes in soil organic carbon and its chemical fractions under different tillage practices on loess soils of the Guanzhong Plain in north-west China[J]. Soil Use Manag, 2013, 29: 344-353.
[7] Edwards C A, Bohlen P J. Biology and Ecology of Earthworms[M]. New York: Chapman & Hall Ltd, 1995.
[8] Lavelle P. Functional domains in soils[J]. Ecol Res, 2002, 17: 441-450.
[9] Bityutskii N P, Maiorov E I, Orlova N E. The priming effects induced by earthworm mucus on mineralization and humification of plant residues[J]. Eur J Soil Biol, 2012, 50: 1-6.
[10] Pathma J, Sakthivel N. Microbial diversity of vermicompost bacteria that exhibit useful agricultural traits and waste management potential[J]. Springer Plus, 2012, 1: 26.
[11] Rukshana F, Butterly C R, Xu J M, et al. Soil organic carbon contributes to alkalinity priming induced by added organic substrates[J]. Soil Biol Biochem, 2013, 65: 217-226.
[12] Lavelle P, Lattaud C, Trigo D, et al. Mutualism and biodiversity in soils[J]. Plant Soil, 1995, 170: 23-33.
[13] Pan X, Song W, Zhang D. Earthworms (, Savigny) mucus as complexing ligand for imidacliprid[J]. Biol Fertil Soils, 2010, 46: 845-850.
[14] Zhao L M, Wang Y Y, Yang J, et al. Earthworm- microorganism interactions: A strategy to stabilize domestic wastewater sludge[J]. Water Res, 2010, 44: 2572-2582.
[15] Yadav A, Suthar S, Garg V K. Dynamics of microbiological parameters, enzymatic activities and worm biomass production during vermicomposting of effluent treatment plant sludge of bakery industry[J]. Environ Sci Pollut Res, 2015, 22(19): 14702-14709.
[16] 方霖楠. 不同水果中总糖含量的比较研究[J]. 化学世界,2017(3):190-192.
[17] 杨静华. 考马斯亮蓝法测定苦荞麦中可溶性蛋白的含量[J]. 山西医药杂志,2018,47(2):206-207.
[18] 高艳利,杨思文,樊凯奇,等. SDS-PAGE电泳技术分析蛋白质的研究[J]. 辽宁化工,2007,36(7):460-463.
[19] Nelson D W, Sommers L E. Total Carbon and Organic Carbon andOrganic Matter[M]. Madison: American Society of Agronomy, 1996.
[20] 李酉开. 土壤农业化学常规分析方法[M]. 北京:科学出版社,1983.
[21] Chen Yuxiang, Zhang Quanguo, Zhang Yufen, et al. Changes in fibrolytic enzyme activity during vermicomposting of maize stover by an anecic earthworm[J]. Polym Degrad Stabil, 2015, 120: 169-177.
[22] Ladd J N, Butler J H A. Short-term assays of soil proteolytic enzyme activities using proteins and dipeptide derivatives as substrates[J]. Soil Biol Biochem, 1972, 4: 19-30.
[23] Tao J, Griffiths B, Zhang S J, et al. Effects of earthworms on soil enzyme activity in an organic residue amended rice-wheat, rotation agro-ecosystem[J]. Appl Soil Ecol, 2009, 42: 221-226.
[24] Casida Jr L E, Klevin D A, Santoro T. Soil dehydrogenase activity[J]. Soil Sci, 1964, 93: 371-376.
[25] Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools[J]. Nucl Acids Res, 2013, 41(D1): D590-D596.
[26] Zhang Dongguang, Chen Yuxiang, Ma Yunhai, et al. Earthworm epidermal mucus: Rheological behavior revealsdrag-reducing characteristics in soil[J]. Soil & Tillage Research, 2016, 158: 57-66.
[27] 赵海涛,狄霖,刘平,等. 蚯蚓生物床工程处理对牛粪性质的影响[J].农业工程学报,2011,27(9):255-259.
Zhao Haitao, Di Lin, Liu Ping, et al. Effect of earthworm bio-bed treatment on properties of cow manure[J].Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(9): 255-259.
[28] 刘政,杨绍斌,宋小美,等.氨基酸类营养对微生物生长及活性的影响[J]. 黑龙江农业科学,2010(5):13-15.
[29] Kuzyakov Y, Bol R. Sources and mechanisms of priming effect induced in two grassland soils amended with slurry and sugar[J]. Soil Biol Biochem, 2006, 38: 747-758.
[30] Jones D L, Kemmitt S J, Wright D, et al. Rapid intrinsic rates of amino acid biodegradation in soils are unaffected by agricultural management strategy[J]. Soil Biol Biochem, 2005, 37: 1267-1275.
[31] Stenström J, Svensson K, Johansson M. Reversible transition between active and dormant microbial states in soil[J]. FEMS Microbiol Ecol, 2001, 36: 93-104.
[32] Aira M, Monroy F, Domínguez J. Earthworms strongly modify microbial biomass and activity triggering enzymatic activities during vermicomposting independently of the application rates of pig manure[J]. Sci Tot Environ, 2007, 385: 252-261.
[33] Jurado M M, Suárez-Estrella F, Vargas-García M C, et al. Increasing native microbiota in lignocellulosic waste composting: Effects on process efficiency and final product maturity[J]. Process Biochem, 2014, 49: 1958-1969.
[34] Fernández-Gómez M J, Nogales R, Insam H, et al. Continuous-feeding vermicomposting as a recycling management method to revalue tomato-fruit wastes from greenhouse crops[J]. Waste Manage, 2010, 30: 2461-2468.
[35] Wang X R, Peng Z Q, Sun X L, et al. The FPase properties and morphology changes of a cellulolytic bacterium,sp. JL-01, on decomposing filter paper cellulose[J]. J Gen Appl Microbiol, 2012, 58: 429-436.
[36] Liu L, Gao P J, Chen G J, et al. Draft genome sequence of cellulose-digesting bacteriumPG-01[J]. Genome Announc, 2014, 2(6): e01154-14.
[37] Cohen M F, Hu P, Nguyen M V, et al. Genome Sequence of the Alkaline-Tolerantsp. Strain FA1[J]. Genome Announc, 2015, 3(3): e00646-15.
[38] Jiang F, Li W J, Xiao M C, et al.sp. nov., isolated from Arctic tundra soil, and emended description of the genus[J]. Int J Syst Evol Micr, 2012, 62: 2259-2263.
[39] Tanaka N, Romanenko L A, Svetashev V I, et al.sp. nov., isolated from seashore sediments of the Sea of Japan[J]. Int J Syst Evol Micr, 2014, 64: 2688-2692.
[40] de Almeida M N, Guimarães V M, Falkoski D L, et al. Optimization of endoglucanase and xylanase activities fromforsimultaneous saccharification andfermentation of sugarcane bagasse[J]. Appl Biochem Biotechnol, 2014, 172: 1332-1346.
[41] Wei W, Isobe K, Shiratori Y, et al. N2O emission from cropland field soil through fungal denitrification after surface applications of organic fertilizer[J]. Soil Biol Biochem, 2014, 69: 157-167.
[42] Jirout J. Nitrous oxide productivity of soil fungi along a gradient of cattle impact[J]. Fungal Ecology, 2015, 17: 155-163.
Earthworm mucus improvingdecomposition of maize stover and its mechanism
Chen Yuxiang1, Zhao Tingting1, Yao Yue1, Xu Lixin2
(1.130022,; 2.130022)
Returning crop residues to soil is regarded as a beneficial agricultural management practice. The decomposition of the returned organic residues is a research concern, and the soil fauna plays an important role during the degradation process. Earthworms are generally regarded as a major and beneficial component of soil fauna. In the present study, the decomposition process was simulated by mixing the maize stover with the ignited quartz sand. The mucus of the earthwormwhich was an important component of drilosphere, glucose or glutamate were added to the mixture. Besides, glucose and glutamate were easily utilizable substrate for the microorganism. The total carbohydrate and crude protein contents in the mucus were analyzed. The total carbohydrate content was 1.3 mg/mL, and the crude protein content was 3.4 mg/mL. SDS-PAGE showed that the protein in the mucus was mainly comprised of two specific protein molecules with molecular weight approximately 44.6 and 21.5 kDa. The carbon and nitrogen mineralization, enzyme activity and microbial community structure were investigated in detail. In the experiment, the carbon mineralization rates of Glc and Glu groups reached a peak value at around 10th day, while that of Muc group reached a maximum value at 20th-30thday. The maximum nitrogen mineralization rates in both Glc and Glu groups were in the 20th-30thday, while those in Muc group were in the 30th-40thday. The effect of the mucus was compared with that of glucose and glutamate. During the whole experiment process, the carbon mineralization rate of Muc group was always higher than that of the control group. After comparing with the control group, it could be observed that the mucus had stimulatory effect on carbon and nitrogen mineralization. The delay effect of the mucus was observed when it was compared to glucose and glutamate. The activities of protease and dehydrogenase in Muc group were higher than those in CK group. On the 10thday, the activities of carboxymethyl cellulase and urease in Muc group were 4 times and 1.5 times of those in CK group, respectively. The average values of ACE and chao for bacterial community in Muc group were 2.6 and 3 times of those in CK group, respectively. The values of ACE and chao for fungal community in Muc group were 2.4 times and 2.3 times of those in CK group, respectively. In addition, the Shannon-wiener diversity index of bacterial and fungal communities in Muc group was 1.4 times and 4.8 times of that in CK group, respectively. The relative abundance ofin Muc group was 2.5 times of that in CK group. The activity of cellulolytic enzyme, protease, urease and dehydrogenase was increased by the addition of the mucus. The microbial abundance and diversity in the group treated with the mucus was higher than that in the control group. The predominant microbial genera in the group treated with the mucus were lingocellulolytic microorganism and some were involved in nitrogen cycle. This indicated that the mucus of drilosphere played an important role in decomposition of crop residues after being returned to soil.
straw; decomposition;earthworm mucus; microbial composition
10.11975/j.issn.1002-6819.2019.15.029
X71; S141
A
1002-6819(2019)-15-0234-07
2019-03-24
2019-07-29
国家自然科学基金项目(31872178)
陈玉香,博士,教授。从事生物质转化研究。Email: chen@jlu.edu.cn
陈玉香,赵婷婷,姚 月,徐立新. 蚯蚓黏液促进玉米秸秆分解及其机理分析[J]. 农业工程学报,2019,35(15):234-240. doi:10.11975/j.issn.1002-6819.2019.15.029 http://www.tcsae.org
Chen Yuxiang, Zhao Tingting, Yao Yue, Xu Lixin. Earthworm mucus improving decomposition of maize stover and its mechanism[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(15): 234-240. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.15.029 http://www.tcsae.org

