帕金森病新药Opicapone的研究进展
陈信捷 罗恩丽 陈雅芳 雒晓东 郑春叶
[摘要] 帕金森病(PD)是发病率仅次于阿尔茨海默病的第二大神经系统退行性病变。当前治疗PD的主要途径仍然是左旋多巴治疗,然而长期服用左旋多巴会导致一系列副作用,如运动障碍、疗效减退、“开-关”现象和剂末效应等。儿茶酚-O-甲基转移酶(COMT)抑制剂能抑制周围左旋多巴的代谢,增加左旋多巴的传输量,从而用于左旋多巴附加疗法,用来增强左旋多巴疗效。作为一种新的三代COMT抑制剂,Opicapone能用于左旋多巴附加疗法中,用来改善波动效应和剂末现象。Opicapone在体内具有长时间的持续活性,当前建议剂量是每天睡前口服50 mg。Opicapone诱导的COMT抑制剂的半衰期较前两代Opicapone抑制剂更长,且能显著升高左旋多巴全身性暴露,具有更有效、更安全、更持久的特性。
[关键词] 帕金森病;Opicapone;左旋多巴;儿茶酚氧位甲基转移酶抑制剂
[中图分类号] R742.5 [文献标识码] A [文章编号] 1673-7210(2019)07(b)-0029-05
Research progress of new drug Opicapone for Parkinson′s disease
CHEN Xinjie1 LUO Enli2 CHEN Yafang1 LUO Xiaodong2 ZHENG Chunye2
1.The Second Clinical Medical School, Guangzhou University of Chinese Medicine, Guangdong Province, Guangzhou 510405, China; 2.Department of Neurology, Fangcun Hospital, Guangdong Provincial Hospital of Traditional Chinese Medicine, Guangdong Province, Guangzhou 510370, China
[Abstract] Parkinson′s disease (PD) is the second most common neurodegenerative disease after Alzheimer′s disease. At present, the main way to treat PD is still Levodopa therapy. However, long-term use of Levodopa can lead to a series of side effects, such as dyskinesia, decreased efficacy, "on-off" phenomena, end of dose phenomena, and soon. The catechol-O-methyltransferase (COMT) inhibitor can inhibit the metabolism of surrounding Levodopa and increase the transmission amount of Levodopa, so it is used in Levodopa additional therapy to enhance the efficacy of Levodopa. As a new third-generation COMT inhibitor, Opicapone can be used in Levodopa addition therapy to improve the motor fluctuations and end of dose phenomena. Opicapone has sustained activity in vivo for a long time. The current recommended dose is 50 mg per day taken orally before bedtime. The half-life of opicapone-induced COMT inhibitors is longer than that of the previous two generations of Opicapone inhibitors, and can significantly increase Levodopa systemic exposure, with more effective, safer and more lasting properties.
[Key words] Parkinson′s disease; Opicapone; Levodopa; Catechol-O-methyltransferase inhibitor
帕金森病(Parkinson′s disease,PD)是一种神经系统退行性病变,典型PD患者的临床表现以锥体外系运动障碍为特征,其发病机制尚未明确。目前PD的发病率正在逐年增加,全人群患病率约为0.3%[1]。该病尚不可治愈,目前最有效的治疗方法仍然是多巴替代疗法[2]。左旋多巴是PD治疗的黄金标准[2],长期的左旋多巴治疗方案并不完善。大部分左旋多巴在外周被多巴脱羧酶(dopa decarboxylase,DDC)代谢,经口服摄入的90%左旋多巴被儿茶酚-O-甲基转移酶(catechol-O-methyltransferase,COMT)代谢成为无活性的代谢产物3-O-甲基多巴(3-O-methyldropa,3-OMD)[3]。COMT抑制劑能抑制周围左旋多巴的代谢,增加左旋多巴的传输量,从而用于左旋多巴附加疗法,用来改善波动效应[4]。Opicapone(OPC)是一种第三代的、药效时间长的外周COMT抑制剂。该抑制剂已被欧洲药物管理局在2013年6月批准用于对患有PD的成年人的左旋多巴/DDC抑制剂治疗的辅助治疗[5],能增加左旋多巴到大脑的运输,用来改善波动效应和剂末现象[6]。本研究旨在从循证医学角度系统地介绍OPC治疗的有效性和安全性。
1 药物作用机制
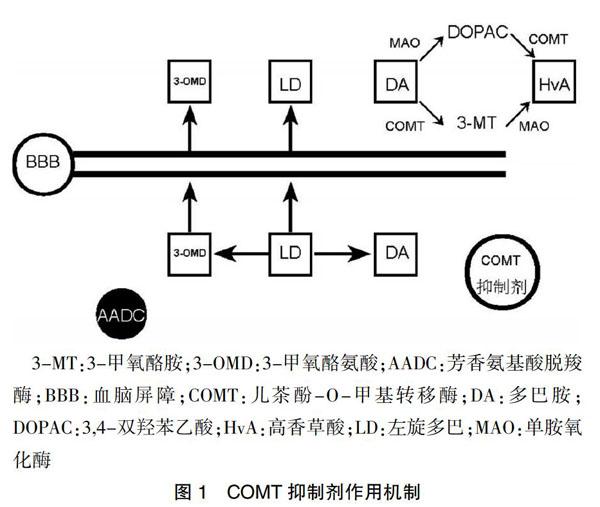
1.1 COMT抑制剂的作用机制
左旋多巴是由周围的芳香族氨基酸脱羧酶和COMT进行快速代谢产生,只有1%的口服摄入的多巴胺能到达大脑[7]。COMT能将大约90%的左旋多巴转化为3-甲氧酪氨酸,它与左旋多巴在血脑屏障的运输上竞争受体[8]。因此,COMT抑制剂被用于抑制外围左旋多巴代谢,从而增加左旋多巴到大脑的运输。见图1。
3-MT:3-甲氧酪胺;3-OMD:3-甲氧酪氨酸;AADC:芳香氨基酸脱羧酶;BBB:血脑屏障;COMT:儿茶酚-O-甲基转移酶;DA:多巴胺;DOPAC:3,4-双羟苯乙酸;HvA:高香草酸;LD:左旋多巴;MAO:单胺氧化酶
1.2 OPC作用机制
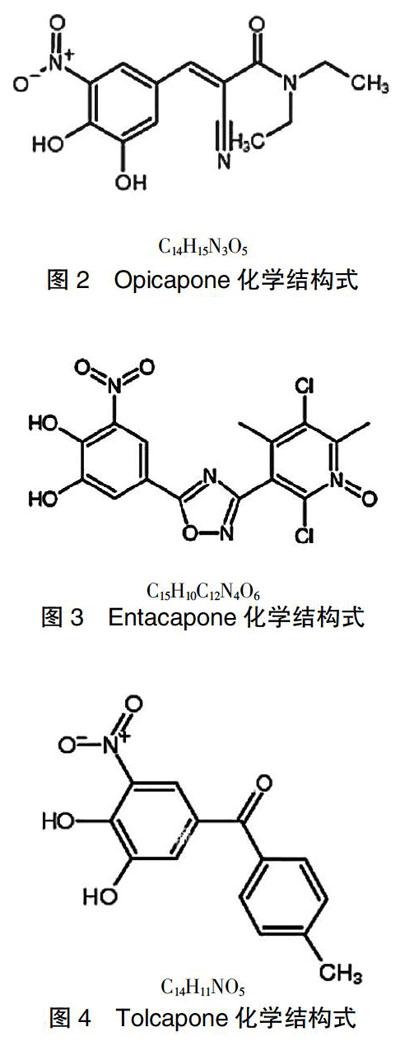
OPC是一种具亲水性的1,2,4-二唑类似物,3号位的NO修饰旨在提高其COMT抑制能力和降低细胞毒性[9],与托卡朋(Tolcapone)和恩他卡朋(Entacapone)在化学结构式上存在明显差异,见图2~4。由于缓慢复杂的解离速率和较高的亲和力,OPC在体内具有长时间的持续活性。在大鼠的肝匀浆中,OPC对COMT持续抑制时间比Entacapone和Tolcapone二者都要高[10],其在左旋多巴和苄丝肼药物联用情况下,左旋多巴血浆浓度维持时间最长能达到24 h。服用OPC 1 h,监测体内COMT抑制率为99%(服用Tolcapone为82%,服用Entacapone为68%)。在服药9 h后,Entacapone没有表现出任何COMT抑制作用,托卡朋只产生了非常小的抑制作用(16%),而OPC达到了91%的抑制率[11]。另外,只作用于外周的Entacapone被认为需通过频繁的剂量来维持药效[12],Tolcapone则证明具有一定的肝损害性[13]。OPC在体内抑制常数为16 pmol/L(1 pmol/L=1×10-12 mol/L),比Tolcapone的抑制常数值(160 pmol/L)低10倍[11]。
2 OPC的剂量管理
OPC当前建议的剂量是每天50 mg,需睡前至少1 h前于左旋多巴药物后服用[14]。由于OPC增强了左旋多巴类药物的药效,从而在药物使用初期阶段,需要适当调整左旋多巴药物的剂量。当左旋多巴与卡比多巴比例为4∶1时,OPC能以平稳剂量依赖状态发挥最大生物利用度。
3 药效动力学和药代动力学
3.1 药效动力学
动物实验研究[10,15]中表明,OPC所诱导的外周COMT抑制效应与作用于全身多系统和中枢的左旋多巴含量持久增高有关。服药24 h后[10],OPC、Entacapone和Tolcapone三者中OPC表现出最低潜力的细胞毒性,而Tolcapone则表现出最高潜力的细胞毒性,且根据该实验有关数据提示,与Tolcapone比较,OPC对肝功能的影响更小。
国外的一项Ⅱ阶研究[16]分别采用单剂量和多剂量(5~1200 mg)的给药方式进行治疗的体外红细胞培养实验中发现,OPC是通过可逆的剂量依赖方式来抑制COMT的活性,且其诱导的持续抑制时间与剂量的大小无关。与对照组比较,10 mg OPC组P < 0.05,其余剂量OPC组P < 0.0001。在人类的红细胞中,正常情况下COMT抑制剂从血浆中被快速清除。而OPC诱导的COMT抑制剂的半衰期较长,反映出COMT-OPC复合物非常缓慢的离解率及较长的作用时间。
COMT药效学上的多态性与种族差异性(包括日本或高加索健康受试者)并没有在国外临床实验(连续10 d服用5、25、50 mg剂量)中显现明显差异[17]。
在健康成人志愿者和伴有劑末现象的PD受试者中,OPC诱导的COMT抑制效应能增加左旋多巴的生物利用度,随之左旋多巴对波动效应的作用有所增强。与安慰剂比较,单剂量的OPC(25、50、100 mg)与左旋多巴/DDC抑制剂早晨合用,可以增加左旋多巴的外周系统体内暴露[即血药浓度曲线下面积(AUC)]。在患者最优稳定剂量的左旋多巴/DDC抑制剂组合中,根据接收不超过28 d的连续每日1次OPC摄入(5、15、30 mg)[18]显示,OPC给药后,左旋多巴全身性暴露(即0~6 h内AUC)显著升高(对应值为24.7%、53.9%和65.6%)。
3.2 药代动力学
3.2.1 最大血药浓度 在健康成人志愿者中,OPC单剂量(10~1200 mg)[16]口服与多剂量(5~50 mg)[19]口服吸收具有剂量依赖的线性相关性。单剂量服用中,当剂量到达50 mg时可达到最大血药浓度[20]。
3.2.2 代谢方式和途径 OPC主要是通过硫化成BIA 9-1103经肝脏代谢的[16,19-20](小部分还原成BIA 9-1709或醛糖酸化成BIA 9-1106),其主要的排泄途径包括经肝胆排泄(约70%)和粪便、尿液途径排泄(12%)[20]。
3.2.3 药物半衰期 单一剂量(≤50 mg)的OPC半衰期为0.8~1.1 h[16],多剂量(≤30 mg[18]或≤50 mg[17])OPC的半衰期为0.7~2.3 h。
3.2.4 特殊人群的药代动力学试验 目前认为[21],轻度肝损害(Child-Pugh分级A级)的患者不需要调节OPC的剂量;在中度肝损害的患者中,需留意并适当地改进剂量方案,其OPC吸收血药浓度曲线升高184%[20];目前仍未有与重度肝损害患者相关的临床经验,故不建议重度肝损害的PD使用OPC用于左旋多巴的辅助治疗。年龄、肾损害、人种因素并不会引起临床药代动力学的明显差异[21]。
4 OPC耐受性与安全性
迄今为止,在PD患者中,OPC药物耐受性和安全性已通过两阶段Ⅱ期和两阶段Ⅲ期随机双盲临床试验中进行了评估[22-23]。一项药物安全性实验研究结果表明,OPC组最常见的不良反应事件包括运动障碍(21.5%)、进展加重(17.0%)、摔倒(9.1%)、血肌酸磷酸激酶(CPK)增加(7.4%)、失眠(5.7%)和直立性低血压(5.4%),并有1例死亡事件(脑外伤后出血死亡)[24]。通过比较该两项实验数据表明[25],在70岁以上的PD患者中,OPC保持良好的安全性,并且,在心脏安全性评估[26]方面,其QT/QTc改变结果符合药物安全性。综合各研究表明,5~50 mg/d OPC剂量服用被认为安全且耐受良好。运动障碍是最常见的不良反应事件,且未见因药物导致的死亡事件[27]。
4.1 常见的急性不良反应
在Ⅲ期试验中,最常见的急性不良反应(the most common treatment emergent adverse effects,TEAEs)包括运动障碍(OPC组18.3%,安慰剂组6.2%)、便秘(OPC组5.7%,安慰剂组1.9%)、失眠(OPC组5.1%,安慰剂组1.6%)、口干(OPC组4.7%,安慰剂组1.2%)[28]。
4.2 严重不良反应
严重不良反应(AEs)发生非常罕见(安慰剂组4.3%和OPC组3.5%),包括1例因肺部感染死亡的安慰剂组病例。在AEs发生率比较中[29],实验组和安慰剂组的差别不具有明显的临床意义。在OPC组中,没有出现严重腹泻、心肌梗死、前列腺癌、黑素瘤或严重肝衰竭的案例报道,且运动控制障碍的发生率<1%。
5 临床疗效
国外当前相关临床实验表明[22-23,30-31],OPC有效、安全且耐受性良好。OPC有助于降低关期时间,提高临床治疗组统一帕金森病评分量表(UPDRS)[32]运动部分总分。Ferreira等[31]的临床试验结果提示,绝对关期时间呈OPC剂量依赖性缩短,且开期时间呈OPC剂量依賴性延长。
已有Ⅲ阶临床试验[23]表明,对不同剂量OPC(5、25、50 mg)联合左旋多巴治疗临床实验中关期时间与基线的平均变化呈剂量依赖性,且高剂量的OPC与安慰剂有显著差异(P = 0.0015)。该作用在停药用仍能维持。该实验数据提示,UPDRS总评分、39项帕金森病问卷(PDQ-39)、帕金森病睡眠量表(PDSS)和非运动症状量表(NMSS)的变化均无统计学意义。
另一项Ⅲ阶研究(持续15周)[30]表明,与安慰剂比较,25、50 mg的OPC均能有效降低关期时间,但只有50 mg的OPC才达到统计学意义(P = 0.0081);绝对开期时间延长方面,比较安慰剂组两种剂量治疗组别都具有统计学意义(P = 0.02,P = 0.005);在伴随运动障碍或不伴随运动障碍的开期状态下,两种剂量治疗不存在统计学差异;除此之外,在治疗组中,UPDRS总分(开期与关期状态)、PDQ-39评分、PDSS评分、NMSS评分变化(与安慰剂对照)差异均无统计学意义。
综上,OPC比较Entacapone和安慰剂,在临床上能有效缩短关期时间,从而有效缓解左旋多巴治疗带来的波动效应,其在各项日常生活能力水平和非运动症状量表的评分方面暂未显现治疗差异。
6 总结展望
临床上,COMT抑制剂能抑制周围左旋多巴的代谢,增加左旋多巴的传输量,从而可用于左旋多巴附加疗法,改善PD患者的波动效应和剂末现象。OPC是根据实验设计合成,比Tolcapone和Entacapone具有更强的药效和更长的抑制作用时间。多项临床试验和随访研究能证明OPC的有效性、安全性。总体而言,相比前两代,第三代COMT抑制剂OPC的优越性更强,且不具备更明显的副作用。
根据临床研究结果,OPC的推荐使用剂量仍建议为50 mg/d,需同时服用比例为4∶1的左旋多巴与卡比多巴复方制剂以发挥最大生物利用度。药代动力学和药效动力学中实验研究表明,OPC具有最高血药浓度高、半衰期长、稳定性强的特点,其药物代谢途径研究未有证据表明造成肝肾功能损害。该药物不认为会引起人种、年龄治疗效果的差异性。
当前相关临床研究实验数量有限,尚需更多的剂量分组比较,来显现最优剂量;其次,尚未有OPC与治疗PD药物中非COMT抑制剂药物进行比较。我们也期待更多的临床研究进一步提供对OPC有效性及安全性的评价。
[参考文献]
[1] 刘疏影,陈彪.帕金森病流行现状[J].中国现代神经疾病杂志,2016,16(2):98-101.
[2] Lang AE,Lozano AM. Parkinson′s disease [J]. N Engl J Med,1998,339(16):1130-1143.
[3] Kaakkola S,Gordin A,M?覿nnist?觟 PT. General properties and clinical possibilities of new selective inhibitors of catechol O-methyltransferase [J]. Gen Pharmacol,1994,25(5):813-824.
[4] Bonifácio MJ,Palma PN,Almeida L,et al. Catechol-O-methyltransferase and its inhibitors in Parkinson′s disease [J]. Drugs,2007,13(3):352-379.
[5] European Medicines Agency. Ongentys 25 mg hard capsules:summary of product characteristics [EB/OL]. 2016. http://www.ema.europa.eu.
[6] LeWitt PA. Levodopa for the treatment of Parkinson's disease [J]. N Engl J Med,2008,359(23):2468-2476.
[7] Hauser RA. Levodopa:past,present,and future [J]. Eur Neurol,2009,62(1):1-8.
[8] Gomes P,Soares-da-Silva P. Interaction between L-DOPA and 3-O-methyl-L-DOPA for transport in immortalised rat capillary cerebral endothelial cells [J]. Neuropharmacology,1999,38(9):1371-1380.
[9] Kiss LE,Ferreira HS,Torrao L,et al. Discovery of a long-acting,peripherally selective inhibitor of catechol-O-methyltransferase [J]. J Med Chem,2010,53(8):3396-3411.
[10] Bonif?觃cio MJ,Torr?觔o L,Loureiro AI,et al. Pharmacological profile of opicapone,a third-generation nitrocatechol catechol-O-methyl transferase inhibitor,in the rat [J]. Br J Pharmacol,2015,172(7):1739-1752.
[11] Bonifácio MJ,Torr?觔o L,Loureiro AI,et al. 2.243 OPICAPONE:CHARACTERIZATION OF A NOVEL PERIPHERAL LONG-ACTING CATECHOL-O-METHYLTRANSFERASE INHIBITOR [J]. Parkinsonism Relat Disord,2012,18(Suppl 2):S125.
[12] Deane K,Spieker S,Clarke CE. Catechol-O-methyltransferase inhibitors for levodopa-induced complications in Parkinson′s disease [J]. Cochrane Database Syst Rev,2004(4):CD004554.
[13] Ceravolo R,Piccini P,Bailey DL,et al. 18F-dopa PET evidence that tolcapone acts as a central COMT inhibitor in Parkinson's disease [J]. Synapse,2002,43(3):201-207.
[14] Scott LJ. Opicapone in Parkinson′s disease:a profile of its use [J]. Drugs,2017,33(7):303-310.
[15] Bonifácio MJ,Sutcliffe JS,Torr?觔o L,et al. Brain and peripheral pharmacokinetics of levodopa in the cynomolgus monkey following administration of opicapone,a third generation nitrocatechol COMT inhibitor [J]. Neuron,2014,77:334-341.
[16] Almeida L,Rocha JF,Falc?觔o A,et al. Pharmacokinetics,Pharmacodynamics and Tolerability of Opicapone,a Novel Catechol-O-Methyltransferase Inhibitor,in Healthy Subjects [J]. Clin Pharmacokinet,2013,52(2):139-151.
[17] Falc?觔o A,Rocha JF,Santos A,et al. Opicapone pharmacokinetics and pharmacodynamics comparison between healthy Japanese and matched white subjects [J]. Clin Pharmacol Drug Dev,2016,5(2):150-161.
[18] Rocha JF,Ferreira JJ,Falc?觔o A,et al. Effect of 3 single-dose regimens of opicapone on levodopa pharmacokinetics,catechol-O-methyltransferase activity and motor response in patients with Parkinson disease [J]. Clin Pharmacol Drug De,2016,5(3):232-240.
[19] Rocha JF,Almeida L,Falc?觔o A,et al. Opicapone:a short lived and very long acting novel catechol-O-methyltransferase inhibitor following multiple dose administration in healthy subjects [J]. Br J Clin Pharmacol,2013,76(5):763-775.
[20] Rocha JF,Santos A,Falc?觔o A,et al. Effect of moderate liver impairment on the pharmacokinetics of opicapone [J]. Eur J Clin Pharmacol,2014,70(3):279-286.
[21] Scott LJ. Opicapone:a review in Parkinson′s disease [J]. Drugs,2016,76(13):1293-1300.
[22] Ferreira JJ,Lees A,Rocha JF,et al. Opicapone as an adjunct to levodopa in patients with Parkinson′s disease and end-of-dose motor fluctuations:a randomised,double-blind,controlled trial [J]. Lancet Neurol,2016,15(2):154-165.
[23] Lees A,Ferreira J,Costa R,et al. Efficacy and safety of opicapone,a new COMT inhibitor,for the treatment of motor fluctuations in Parkinson′s Disease patients:a phase Ⅲ,randomized,double-blind,placebo-controlled,parallel-group study(BIPARK Ⅱ)[J]. Mov Disord,2013,333:e116.
[24] Costa R,Oliveira C,Pinto R,et al. One-year open-label efficacy and safety of opicapone in Parkinson′s disease BIPARK-Ⅱ study [J]. Mov Disord,2014,29(Suppl 1):S233.
[25] Lees A,Ferreira J,Lopes N,et al. Efficacy and safety of opicapone in patients over 70 years with Parkinson′s disease and motor fluctuations [J]. Mov Disord,2015,30:S99.
[26] Pinto R,Hostis P,Patat A,et al. Evaluation of opicapone on cardiac repolarization in a thorough QT/QTc study [J]. Clin Pharmacol Drug Dev,2015,4(6):454-462.
[27] Ferreira J,Lees A,Gama H,et al. Safety and tolerability of opicapone in the treatment of Parkinson′s disease and motor fluctuations:analysis of pooled phase Ⅲ studies [J]. Mov Disord,2015,30(Suppl 1):S86.
[28] Scaglione F. New oral anticoagulants:comparative pharmacology with vitamin K antagonists [J]. Clin Pharmacokinet,2013,52(2):69-82.
[29] Vaz-Da-Silva M,Pinto R,Lopes N,et al. Evaluation of opicapone′s cardiac safety in patients with Parkinson′s disease:analysis of the centralized phase Ⅲ ECG dataset [J]. Eur J Neurol,2015,22:818.
[30] Lees AJ,Ferreira J,Rascol O,et al. Opicapone as adjunct to levodopa therapy in patients with Parkinson disease and motor fluctuations:a randomized clinical trial [J]. JAMA Neuro,2017,74(2):197-206.
[31] Ferreira JJ,Rocha JF,Falc?觔o A,et al. Effect of opicapone on levodopa pharmacokinetics,catechol-O-methyltransferase activity and motor fluctuations in patients with Parkinson′s disease [J]. Eur J Neurol,2015,22(5):815-825,e56.
[32] Goetz CG,Tilley BC,Shaftman SR,et al. Movement Disorder Society-sponsored revision of the Unified Parkinson's Disease Rating Scale(MDS-UPDRS):scale presentation and clinimetric testing results [J]. Mov Disord,2008,23(15):2129-2170.

