碳还原氧化铜实验探究
郑春燕,粟 智
(新疆师范大学化学化工学院,新疆 乌鲁木齐 830054 )
1 问题提出
碳还原氧化铜实验是初中化学教学中一个重要而又难做成功的演示实验[1]。经过对这一实验的长期关注,从相关文献着手分析,王寿红[2]〗等人指出该实验成功率低的主要原因是两反应物(碳和氧化铜)的晶体结构相当稳定,使该化学变化具有高活化能,而且固相间的反应只能在表面进行,更增加了反应的困难程度。付立海[3]指出该实验现象不明显是因为碳粉还原氧化铜的反应类型属于固体和固体反应生成固体和气体的反应,增大反应物的接触面积是实验成功的关键因素。卫泽敏[4]通过实验证实了反应物间的接触面积越大,则反应界面越大,反应速度可明显提高。可以看出,无论从反应物的性质还是反应机理出发都足以说明碳还原氧化铜实验的复杂性和难成功性。徐传兵[5]在对“甲烷的还原性”研究性学习的探讨中采用与氢气还原氧化铜相同的装置来做甲烷还原氧化铜实验,已证实甲烷能还原氧化铜。除了甲烷,像乙烯、乙炔都可以还原灼热的氧化铜,已被唐玄馨[6]在甲烷不能还原氧化铜吗一文中加以肯定。于海强[6]等人在探析分子“肼”之常见考点中介绍了肼可以将氧化铜还原为氧化亚铜,但未做详细说明。那么用不同种类的反应物对该实验进行改进是否可行呢?为此开展了以下探索工作。
2 理论依据
从不同种类反应物的状态分析,碳还原氧化铜为两种固态反应物生成至少一种固态产物的反应,称为固固反应。依此甲烷、乙烯、乙炔与氧化铜的反应为气固反应,肼与氧化铜反应为液固反应。查阅有关教材[7]得知:
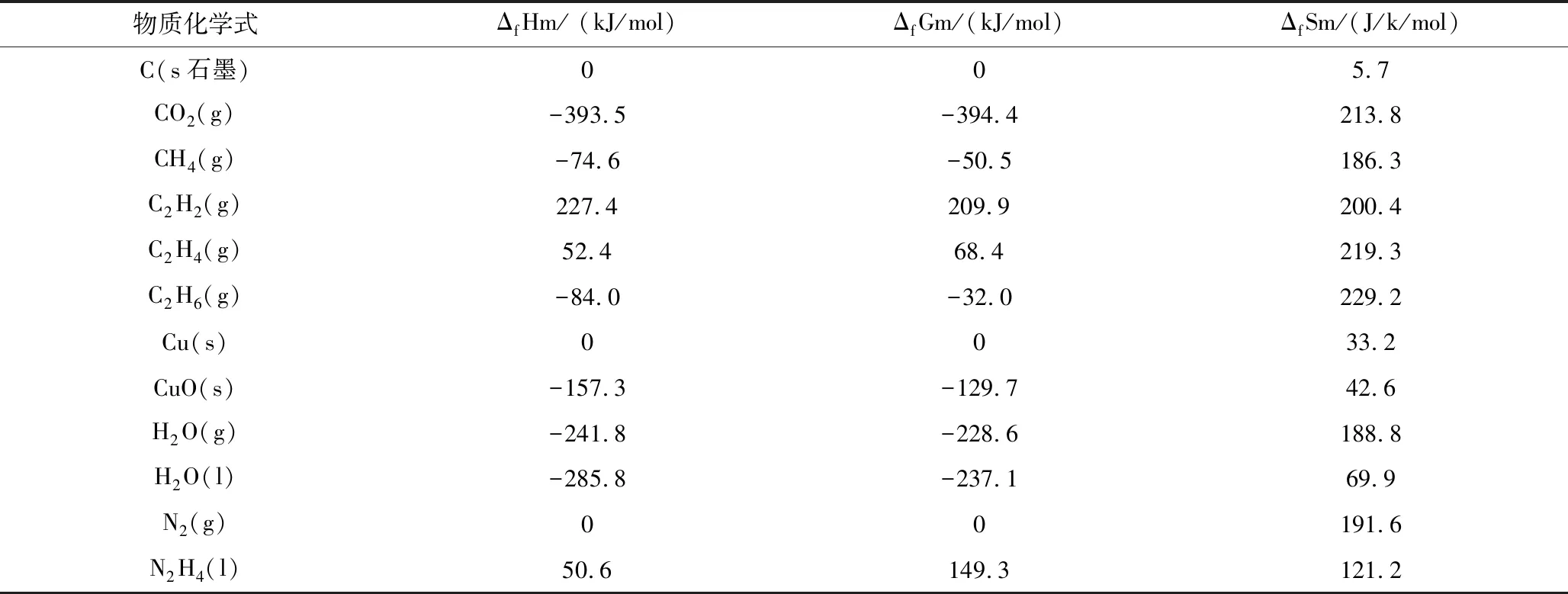
表1 相关物质的热力学函数(298.15k,100.00kPa)
从热力学角度分析,在恒温恒压非体积功为零的状态变化中,吉布斯自由能ΔrGml可以作为反应能否自发进行的判据。我们通常用ΔrGml=ΔrHml-T×ΔrSml来计算反应的ΔrGml,ΔrGml的值越负,说明这个反应能自发进行的可能性越大。综合考虑反应的焓熵值对反应过程的决定性作用,我们用焓熵的比值,即最低反应温度直观表示过程对温度的要求:最低反应温度值越负,反应自发过程对温度的要求越低。当反应的ΔrGml=0时,反应达到最大限度,反应系统的组成不再改变,于是达到化学平衡状态,此时反应的最低温度T=ΔrHml/ΔrSm 。
根据表1相关热力学参数分别计算固固反应,气固反应,液固反应的ΔrHml和ΔrSml,从而求出ΔrGml和T。
固固反应碳还原氧化铜计算过程:
(1)
ΔrHml=-393.5-2(-157.3)=-78.9(kJ/mol)
ΔrSml=213.8+2×33.2-(2×42.6+5.7)=189.3(J/k/mol)=0.1893(kJ/k/mol)
(ΔrGml=ΔrHml-T×ΔrSml=-78.9-298.15×0.1893=-135.4(kJ/mol)
该反应ΔrGml﹤0,表示生成物的自由能小于反应物的自由能,化学反应能够自发向产物方向进行。实际操作中我们知道该反应必须在一定温度下发生。
T=ΔrHml/ΔrSml=-78.9/0.1893=-416.8(k)
理论分析表明该反应常温下即可自发进行,但实际操作中,实验结果并不理想,这不是热力学的缘故,而是动力学上的障碍,也可见固固反应固有的复杂性。
同理我们对气固反应进行计算,甲烷还原氧化铜反应计算过程:
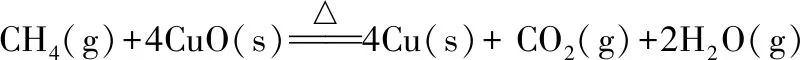
(2)
ΔrHml=2×(-241.8)-393.5-(4×(-157.3)+(-74.6))=-173.3(kJ/mol)
ΔrSml=2×188.8+213.8+33.2-(4×42.6+186.3)=367.5(J/k/mol)=0.3675(kJ/k/mol)
ΔrGml=ΔrHm -T×ΔrSm =-173.3-298.15×0.3675=-282.9(kJ/mol)
T=ΔrHml/ΔrSml=-173.3/0.3675=-471.6(k)
计算可知甲烷还原氧化铜反应ΔrGml﹤0,为自发反应。反应自发过程对温度的要求低于碳还原氧化铜反应。
乙烷还原氧化铜反应计算过程:
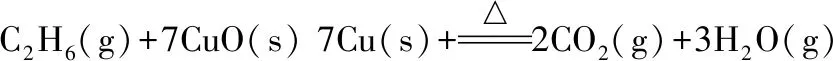
(3)
ΔrHml=3×(-241.8)+2×(-393.5)-(7×(-157.3)+(-84.0))=-327.3(kJ/mol)
ΔrSml=3×188.8+2×213.8+7×33.2-(7×42.6+229.2)=699(J/k/mol)=0.699 (kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-327.3-298.15×0.699=-535.7(kJ/mol)
T=ΔrHml/ΔrSml=-327.3/0.699=-468.2(k)
计算可知该反应ΔrGml﹤0,为自发反应。反应自发过程对温度的要求与甲烷相近。乙烯还原氧化铜反应计算过程:
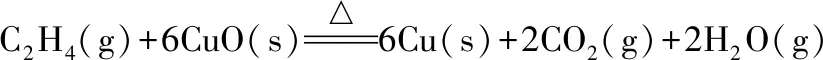
(4)
ΔrHml=2×(-241.8)+2×(-393.5)-(6×(-157.3)+52.4)=-379.2(kJ/mol)
ΔrSml=2×188.8+2×213.8+6×33.2-(6×42.6+219.3)=529.5(J/k/mol)=0.5295 (kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-379.2-298.15×0.5295=-537.1(kJ/mol)
T=ΔrHml/ΔrSml=-379.2/0.5295=-716.1(k)
计算可知该反应ΔrGml﹤0,为自发反应。反应自发过程对温度的要求低于甲烷、乙烷还原氧化铜反应。
乙炔还原氧化铜反应计算过程:
ΔrHml=241.8+2×(-393.5)-(5×(-157.3)+227.4)=-469.7(kJ/mol)
ΔrSml=188.8+2×213.8+5×33.2-(5×42.6+200.4)=369.5(J/k/mol)=0.3695 (kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-469.7-298.15×0.3695=-579.9(kJ/mol)
T=ΔrHml/ΔrSml=-469.7/0.3695=-1271.2(k)
分析可知该反应ΔrGml﹤0,为自发反应,相比以上反应,自发过程对温度的要求降低。
液固反应肼还原氧化铜的计算过程如下:
ΔrHml=2×(-285.8)-(2×(-157.3)+50.6)=-307.6(kJ/mol)
ΔrSml=2×69.9+191.6+2×33.2-(2×42.6+121.2)=191.4(J/k/mol)=0.1914(kJ/k/mol)
ΔrGml=ΔrHml-T×ΔrSml=-307.6-298.15×0.1914=-364.7 (kJ/mol)
T=ΔrHml/ΔrSml=-307.6/0.1914=-1607.1(k)
计算可知该反应ΔrGml﹤0,为自发反应,且相比以上反应自发可能性最大,自发过程对温度的要求最低。
3 结果分析
对上述热力学函数计算结果进行统计,在表2中列出各反应的吉布斯函数ΔrGml(kJ/mol)和最低反应温度T(k)。
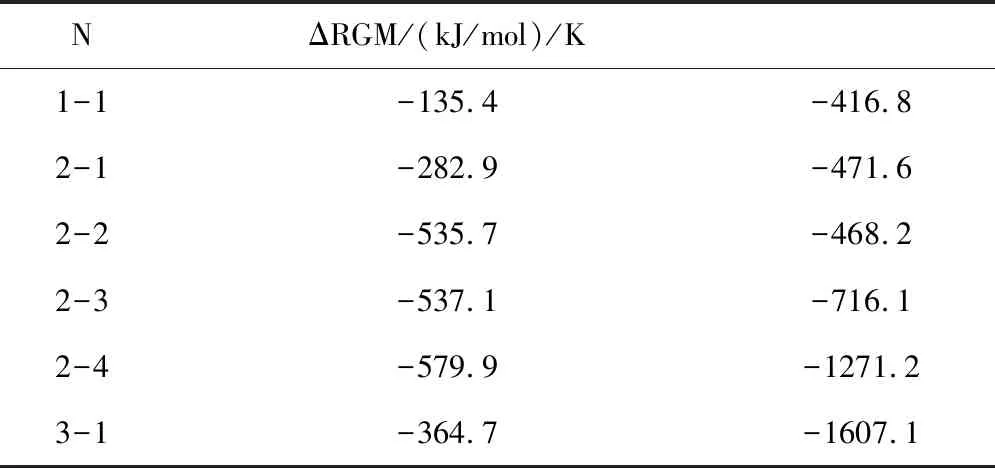
表2 各反应的吉布斯函数
对表2数据进行分析,作出各反应的吉布斯函数ΔrGml(kJ/mol)和最低反应温度T(k)的柱状图见图1和图2。
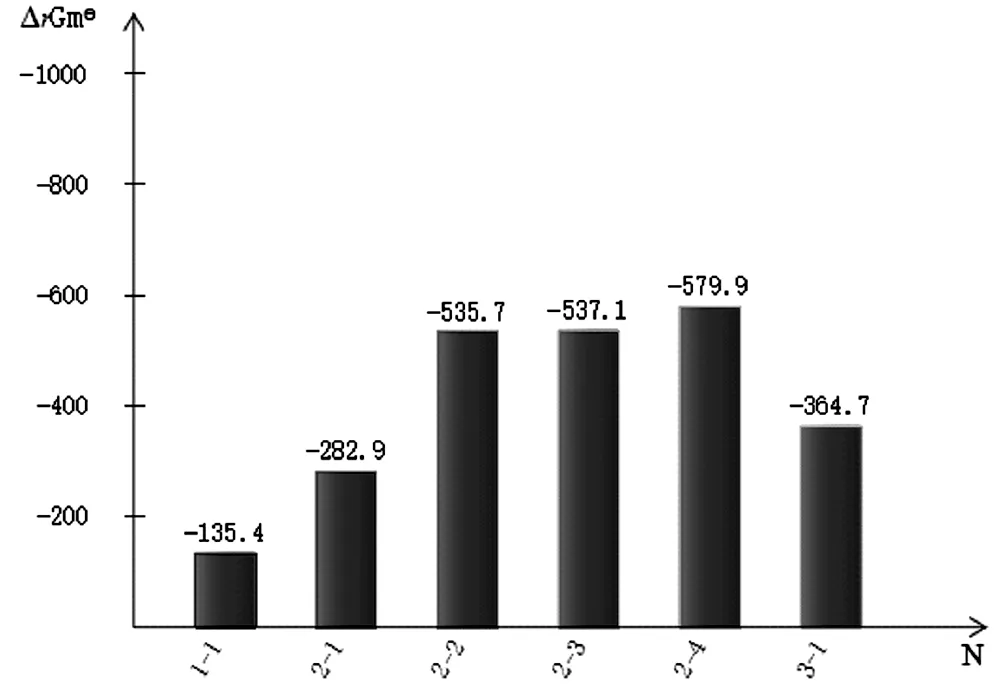
图1 各反应的吉布斯函数ΔrGm (kJ/mol)
从图1中可以清楚的看出各反应ΔrGm 均为负值,说明各反应都具有自发性。
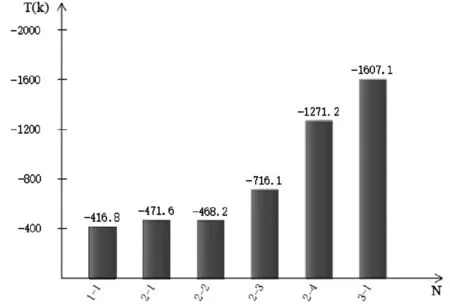
图2 各反应的最低反应温度T(k)
从图2各反应的最低反应温度T(k)可以看出,反应3-1的最低反应温度为-1607.1(k),说明肼还原氧化铜的反应对温度的要求最低。
综上所述:(1)从热力学角度分析,以上各反应都具有自发性,其中肼还原氧化铜反应对温度要求最低。(2)从动力学角度看,气固反应,液固反应大大增加了反应物的接触程度,克服了固相反应固有的缺陷,降低了实验难度。(3)从实验装置考虑:固固反应,气固反应实验均需要加热装置,且对温度有一定要求,而液相肼还原氧化铜实验在常温下即可进行反应,反应条件温和,实验装置简单。(4)从环保角度,碳还原氧化铜反应产物中的二氧化碳是温室气体的罪魁祸首,反应不完全产生的一氧化碳危害更为严重。气相反应甲烷等均为含碳化合物,产物中有二氧化碳。液相肼与氧化铜反应产物为氮气,清洁安全。
4 教学应用
肼又称联氨,分子式为 N2H4,作为氮的重要氢化合物,在各类高中化学试题中出现的频率很高,但教科书上偶见其名,试题中往往要求学生迁移应用,给学生化学知识的学习造成了困扰。因此本文意欲提出将碳还原氧化铜这一演示实验换成更肼还原氧化铜的学生实验,激发学生学习化学的兴趣,发挥初中阶段化学教育的启蒙作用。为学生高中化学学习提供先行组织者,发展学生的化学学科素养。

