F-box结构域参与FBXO39蛋白对MCF-7细胞增殖的调控*
李 芳, 刘罗根, 黄 果, 戈 欣, 欧阳靖霖, 章运生, △
(1湖南环境生物职业技术学院化学教研室, 湖南 衡阳 421005;2南华大学附属第二医院临床研究所,3湖南省乳甲疾病防治临床医学研究中心, 4南华大学附属第二医院超声医学科, 湖南 衡阳 421001)
F-box蛋白是一类含有F-box结构域的蛋白家族[1]。F-box结构域位于F-box蛋白的N端,与SKP1和cullin蛋白结合成SCF(SKP1-CUL1-F-box)E3泛素连接酶复合体[2-3]。F-box蛋白的C端主要参与特异性底物蛋白的识别。F-box蛋白的功能主要与肿瘤发生发展[4]、细胞周期调控[5]、上皮细胞间质转化[6]、细胞代谢[7]和生殖发育[8-9]等过程相关,例如F-box蛋白家族成员FBXO31能够选择性降解cyclin D1来诱导G1期的阻滞,但对cyclin B1和周期蛋白依赖性激酶(cyclin-dependent kinases, CDKs)以及CDK抑制因子p14和p27等没有影响,其中cyclin D1正是G1/S期的关键调控因子;另外两种F-box蛋白家族成员FBXO4和FBXW8也能够介导cyclin D1的降解来阻滞细胞周期G1进程[6]。
FBXO39是F-box蛋白家族成员之一,目前在乳腺癌、结肠癌、甲状腺未分化肉瘤、卵巢和肺癌均发现其表达[10]。RT-PCR检测发现其高表达于成年男性睾丸组织中,而在其它大部分正常器官组织中表达缺失或低表达。因此,FBXO39被认为是一种新的肿瘤/睾丸抗原[11]。在骨肉瘤U-2OS细胞中,敲减FBXO39的表达能够抑制细胞的增殖,并促进肿瘤细胞凋亡[12]。在乳腺癌中,RT-PCR检测发现FBXO39在2种乳腺癌细胞系(MCF-7和MDA-MB-231)和临床乳腺癌标本中都有表达,但在正常乳腺组织中表达缺失[13]。因此,FBXO39被认为参与了乳腺癌的发生,但其具体机制目前尚不清楚。已知,F-box结构域对于F-box蛋白的分子功能起到了至关重要的作用[1]。F-box结构域对FBXO39蛋白的细胞定位和功能是否产生影响呢?细胞定位的改变对FBXO39蛋白的功能是否有影响呢?本课题采用缺失突变的方法,构建F-box结构域缺失的真核表达载体pEGFP-FBXO39ΔF及其野生型pEGFP-FBXO39转染在乳腺癌MCF-7细胞,探究F-box结构域对FBXO39蛋白的细胞定位及功能的影响。
材 料 和 方 法
1 材料与试剂
pEGFP-C2质粒、大肠杆菌DH5α和乳腺癌MCF-7细胞由本实验室保存;限制性内切酶HindIII和KpnI,高保真DNA聚合酶、T4 DNA连接酶、DpnI酶及PNK磷酸化酶均购自Fermentas;DNA纯化试剂盒、无内毒素质粒提取试剂盒和逆转录试剂盒等购于天根公司;转染试剂Lipofectamine 2000和RNA提取试剂(TRIzol)购自Invitrogen;FBXO39多克隆抗体以及山羊抗兔II抗购于Sigma;Alexa Fluor 488标记的荧光II抗购于Jackson;DAPI购于碧云天公司;EdU试剂盒购于恒宇生物公司。
2 主要方法
2.1引物设计与合成 使用Primer 5.0软件设计FBXO39和FBXO39ΔF载体构建的上、下游引物,以及用于RT-PCR检测的上、下游引物,并由Invitrogen合成(序列见表1)。

表1 引物序列
2.2目的基因的扩增 以MCF-7细胞cDNA为模板,PCR扩增FBXO39基因的ORF序列。反应体系为2×Phusion Master Mix 25 μL,上、下游引物各2 μL,cDNA模板 1 μL,ddH2O 20 μL。反应条件为 98 ℃ 30 s;98 ℃ 10 s、56 ℃ 30 s、72 ℃ 40 s,共30个循环;72 ℃ 5 min。取3 μL PCR产物经1.0%琼脂糖凝胶电泳确定得到的目的片段大小。利用DNA纯化回收试剂盒纯化PCR产物的基因片段。
2.3pEGFP-FBXO39 和pEGFP-FBXO39ΔF重组质粒的构建Hind III和KpnI双酶切目的基因FBXO39和pEGFP-C2空载体,DNA纯化回收试剂盒回收酶切片段,使用T4 DNA连接酶于16 ℃连接过夜。将连接产物转入DH5α感受态细胞后,接种于含卡那霉素的LB平板上。培养12 h后,挑取若干单菌落。经菌液PCR和DNA测序验证为正确的pEGFP-FBXO39重组质粒。
以pEGFP-FBXO39重组质粒为模板,PCR扩增含FBXO39ΔF(F-box结构域缺失)的质粒片段。反应体系如上述步骤2.2,反应条件为98 ℃ 30 s;98 ℃ 10 s、47 ℃ 30 s、72 ℃ 3 min,共25个循环;72 ℃ 5 min。DNA纯化回收试剂盒纯化PCR产物后,DpnI酶切PCR模板质粒。再次纯化酶切产物后,经PNK酶磷酸化PCR的产物末端。利用T4 DNA连接酶于16 ℃连接过夜。经转化、菌液PCR和DNA测序鉴定为pEGFP-FBXO39ΔF重组质粒。
2.4细胞培养与转染 人乳腺癌细胞MCF-7在含10%胎牛血清的DMEM培养液 (青霉素1×105U/L,链霉素1×105U/L)中,于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。
取对数期生长的细胞,经胰蛋白酶消化后,铺入6孔细胞培养板。待12 h后,取4 μg上述重组质粒分别与250 μL Opti-MEMI无血清培养基和10 μL Lipofectamine 2000混匀。室温孵育20 min后,加入6孔细胞培养板中。转染4~6 h后,需要更换新鲜的正常DMEM(包含血清和抗生素)的培养基。继续培养24~48 h。
2.5总RNA提取和RT-PCR 采用TRIzol试剂提取pEGFP-C2、 pEGFP-FBXO39 和pEGFP-FBXO39ΔF质粒转染的MCF-7细胞总RNA。并用核酸蛋白测定仪测定RNA浓度和纯度。然后采用Quant One Step RT-PCR试剂盒(天根)对所提取的RNA进行cDNA逆转录。最后用RT-PCR方法检测FBXO39在mRNA水平上的表达。反应体系为2×Taq PCR Master Mix 10 μL,上、下游引物各1 μL,cDNA模板 1 μL,ddH2O 7 μL。反应条件为94 ℃ 5 min;94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,共30个循环;72 ℃ 5 min。取3 μL PCR产物经1.0%琼脂糖凝胶电泳确定FBXO39相对表达量,以β-actin为内参照。
2.6Western blot实验 将MCF-7细胞分别转染pEGFP-C2、pEGFP-FBXO39 和pEGFP-FBXO39ΔF质粒。24~48 h后提取细胞总蛋白。经SDS-PAGE后,转移至PVDF膜上。5%脱脂牛奶中室温孵育2 h。抗FBXO39抗体(1 ∶1 000稀释)4 ℃孵育过夜。后加入HRP标记的山羊抗兔II抗(1 ∶5 000稀释)室温孵育1 h。经ECL化学发光试剂上机曝光显色并拍照。
2.7细胞定位实验 将pEGFP-FBXO39 和pEGFP-FBXO39ΔF质粒分别转入MCF-7细胞。24 h后加入预冷PBS洗涤3次,每次5 min。后加入4%多聚甲醛室温固定30 min。PBS洗涤后,DAPI染核10 min,指甲油封片。共聚焦荧光显微镜观察FBXO39和FBXO39ΔF蛋白在MCF-7中的细胞定位。
2.8细胞免疫荧光观察 将MCF-7细胞接种于细胞爬片12 h后,加入预冷PBS洗涤3次,每次5 min。4%多聚甲醛室温固定30 min后,0.1%Triton X-100细胞打孔10 min。经PBS洗涤后,加入5%血清封闭1 h。抗FBXO39抗体(1 ∶100稀释)4 ℃孵育过夜,加入红色荧光II抗(1 ∶250稀释)避光室温孵育1 h。DAPI染核10 min,指甲油封片。共聚焦荧光显微镜观察内源性FBXO39蛋白在MCF-7中的细胞表达和定位。
2.9流式细胞术 将MCF-7细胞分别转染pEGFP-C2、pEGFP-FBXO39 和pEGFP-FBXO39ΔF质粒。24~48 h后经胰蛋白酶消化收集细胞。预冷PBS洗涤3次,每次5 min。后加入75%乙醇固定。送赛维尔生物科技有限公司进行流式细胞周期检测分析。
2.10MTT和EdU实验检测细胞增殖 将MCF-7细胞接种于96孔细胞培养板12 h后,分别转染pEGFP-C2、pEGFP-FBXO39 和pEGFP-FBXO39ΔF质粒,每种质粒转染设置5个复孔。24、48和72 h后分别加入2 g/L的MTT试剂。37 ℃孵育4 h后,加入150 μL DMSO。以490 nm波长上机检测其吸光度(A)值。
将MCF-7细胞接种于96孔细胞培养板12 h后,分别转染pEGFP-C2、pEGFP-FBXO39 和pEGFP-FBXO39ΔF质粒。24 h后加入2×EdU工作液孵育2 h。按照EdU试剂盒说明书对细胞进行染色,荧光显微镜观察并拍照。
2.11免疫组化染色 从病理科获取乳腺癌及其癌旁组织的石蜡切片。经脱水、灭活、抗原修复和封闭等步骤后,滴加抗FBXO39抗体(1 ∶300稀释)4 ℃孵育过夜。PBS冲洗后,滴加II抗室温孵育30 min。后经复染、脱水、透明和封片。倒置显微镜观察并拍照。
3 统计学处理
采用SPSS 17.0统计软件对各数据进行分析,数据均采用均数±标准差(mean±SD)表示。两组间比较采用独立样本t检验,多组差异比较采用单因素方差分析,组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 pEGFP-FBXO39 和pEGFP-FBXO39ΔF重组质粒的构建及鉴定
以MCF-7细胞的cDNA为模板,PCR扩增FBXO39基因的ORF,得到大小为1 348 bp的片段,见图1A。经限制性内切酶HindIII和KpnI双酶切后,利用T4 DNA连接酶与真核表达载体pEGFP-C2相连接,见图1B。以pEGFP-FBXO39为模板,PCR扩增含FBXO39ΔF(F-box结构域缺失)的质粒片段约6 000 bp左右,见图1C。经DpnI酶消化以及PNK酶磷酸化后,利用T4 DNA连接酶连接PCR产物,组成pEGFP-FBXO39ΔF载体,见图1B。菌液PCR结果显示,扩增出大小为1 300 bp左右的FBXO39基因片段和大小为1 200 bp左右的FBXO39ΔF基因片段,见图1D。DNA测序结果证实,所获得的重组质粒目的片段序列与预期完全相符,见图1E。表明pEGFP-FBXO39 和pEGFP-FBXO39ΔF重组质粒构建成功。
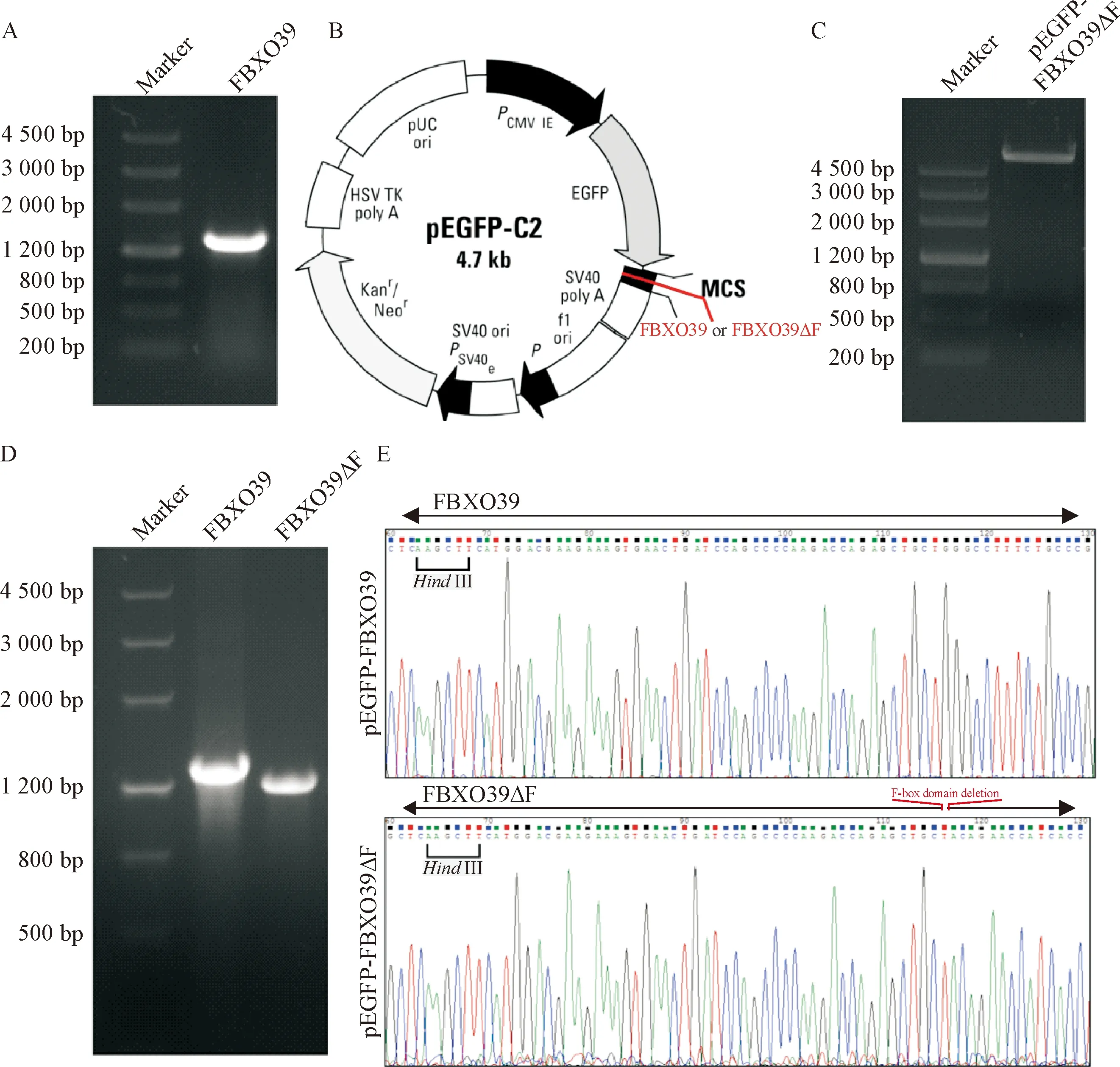
Figure 1. Construction and identification of recombinant plasmids. A: theFBXO39gene fragment was detected by agarose gel electrophoresis; B: schematic of pEGFP-FBXO39 and pEGFP-FBXO39ΔF (F-box domain deletion mutation) expression vectors; C:the pEGFP-FBXO39ΔF vector was detected by agarose gel electrophoresis; D:theFBXO39andFBXO39ΔFfragments were detected by agarose gel electrophoresis; E: DNA sequencing of pEGFP-FBXO39 and pEGFP-FBXO39ΔF vectors.
图1 重组质粒的构建与鉴定
2 FBXO39与FBXO39ΔF在MCF-7细胞中的表达
分别将pEGFP-C2、pEGFP-FBXO39和pEGFP-FBXO39ΔF质粒转染MCF-7细胞。24 h后,利用荧光显微镜观察转染效率,发现3种质粒的转染效率都超过70%,见图2A。我们首先通过RT-PCR检测FBXO39和FBXO39ΔF在MCF-7细胞中的表达,发现与空质粒对照组相比,转染重组质粒细胞中FBXO39和FBXO39ΔF的mRNA水平显著增加,见图2B。进一步通过Western blot检测了GFP-FBXO39及GFP-FBXO39ΔF蛋白在MCF-7细胞中的表达情况,发现2种蛋白均成功在细胞中表达,见图2C。上述结果说明pEGFP-FBXO39 和pEGFP-FBXO39ΔF重组质粒在MCF-7细胞中都成功获得表达。
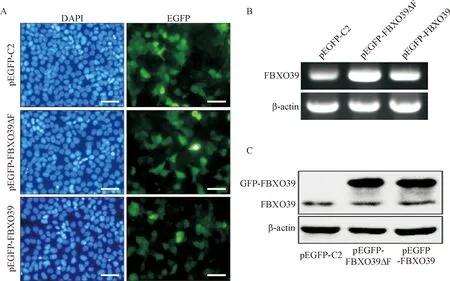
Figure 2. The expressions of FBXO39 and FBXO39ΔF in the MCF-7 cells. A: transfection efficiency of pEGFP-C2, pEGFP-FBXO39 and pEGFP-FBXO39ΔF vectors was observed by fluorescence microscope. The scale bar=100 μm;B: the expression of FBXO39 and FBXO39ΔF was detected by RT-PCR at mRNA level; C:the expression of FBXO39 and GFP-FBXO39ΔF was detected by Western blot at protein level.
图2 FBXO39与FBXO39ΔF在MCF-7细胞中的表达
3 FBXO39与FBXO39ΔF在MCF-7细胞中的定位
为了研究F-box结构域对FBXO39蛋白细胞定位的影响,我们将pEGFP-FBXO39和pEGFP-FBXO39ΔF质粒转染MCF-7细胞后用共聚焦荧光显微镜观察目的蛋白在细胞中的定位。结果显示,FBXO39在细胞质中均匀分布;FBXO39ΔF也定位在细胞质中,见图3A。此外,细胞免疫荧光技术结果显示内源性FBXO39蛋白也主要表达在细胞质中,见图3B。上述结果表明F-box结构域对FBXO39蛋白的细胞定位没有影响。
4 FBXO39与FBXO39ΔF对MCF-7细胞增殖的影响
为了进一步研究F-box结构域对FBXO39蛋白生物学功能的影响,我们将pEGFP-C2、pEGFP-FBXO39和pEGFP-FBXO39ΔF质粒转染MCF-7细胞,MTT法检测FBXO39和FBXO39ΔF对MCF-7细胞活力的影响,结果显示,与空质粒对照组相比,FBXO39显著地促进了细胞的活力(P<0.05);而FBXO39ΔF组对细胞活力无明显影响(P>0.05),见图4A。此外,EdU染色结果也显示,FBXO39促进了细胞的增殖;FBXO39ΔF对细胞的增殖几乎没有影响,见图4。上述结果表明F-box结构域在FBXO39对MCF-7细胞的增殖过程起着至关重要的作用。
5 FBXO39与FBXO39ΔF对MCF-7细胞周期的影响
为了进一步研究F-box结构域对FBXO39蛋白促进细胞增殖能力的影响,我们将pEGFP-C2、pEGFP-FBXO39和pEGFP-FBXO39ΔF质粒转染MCF-7细胞,流式细胞术检测FBXO39和FBXO39ΔF对MCF-7细胞周期的影响。结果显示,与空质粒对照组相比,FBXO39组细胞处于S期的比例明显增加,处于G1期的细胞比例明显减少,表明FBXO39能够促进细胞增殖;然而,FBXO39ΔF组细胞比例没有发生显著性变化,见图5A。此外,Western blot检测细胞周期相关蛋白cyclin E1和cyclin D1的表达情况,发现FBXO39抑制了cyclin E1和cyclin D1的表达;同样地,FBXO39ΔF组没有发生显著性变化,见图5B,说明F-box结构域的缺失可能抑制了FBXO39在细胞周期调控方面的作用。

Figure 3. The cellular localization of FBXO39 and FBXO39ΔF in the MCF-7 cells. A: the cellular localization of GFP-FBXO39 and GFP-FBXO39ΔF was observed under confocal fluorescence microscope in the MCF-7 cells; B:cellular localization of FBXO39 was analyzed by immunofluorescence staining. The scale bar=10 μm.
图3 FBXO39与FBXO39ΔF在MCF-7细胞中的定位
6 FBXO39在乳腺癌组织中的表达及临床意义
为了探究FBXO39在乳腺癌组织中表达的临床意义,我们利用Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)分析了FBXO39表达与乳腺癌患者生存期的相关性,结果发现高表达FBXO39患者具有较好的生存期,见图6A。此外我们利用免疫组化的方法分析了FBXO39在乳腺癌及其癌旁组织中的表达情况,结果发现FBXO39高表达于乳腺癌组织中,见图6B,提示FBXO39可能与乳腺癌的发生相关。
讨 论
F-box蛋白是一类广泛存在于真核生物中的蛋白家族,该蛋白家族都含有F-box结构域,该结构域由大约50个氨基酸残基构成,位于F-box蛋白的N端,介导底物蛋白的泛素化水解[14-15]。F-box蛋白C端也存在一些相对保守的结构域,介导底物蛋白的特异性识别。根据C端结构域的不同,可以将F-box蛋白家族分为3个亚家族[16]:FBXW亚家族,包含WD40重复结构域;FBXL亚家族,富含亮氨酸重复序列;FBXO亚家族,这类F-box蛋白C端包含多种类的结构域并且功能暂时还不明确, FBXO39蛋白就是属于该亚家族[1]。
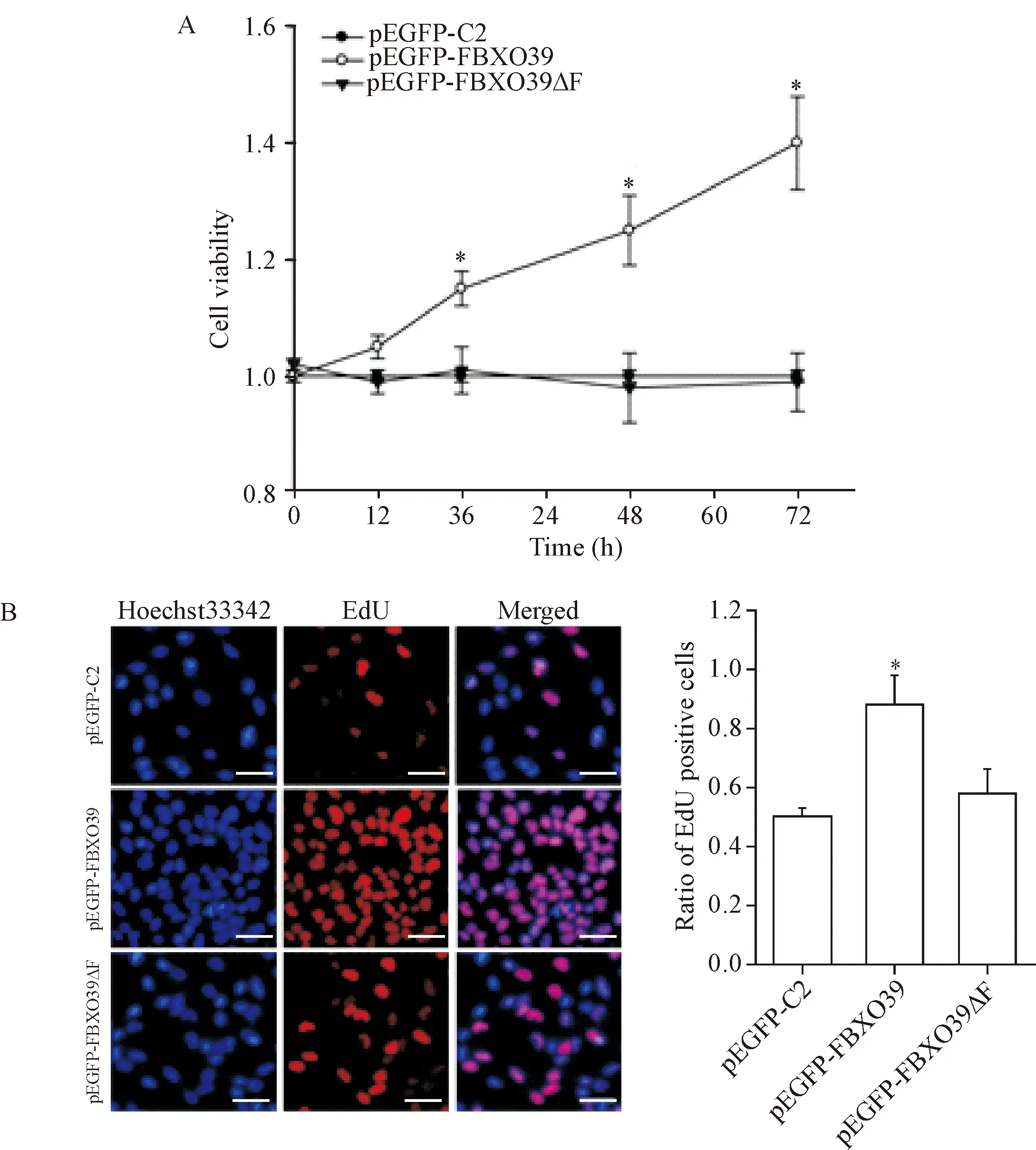
Figure 4. FBXO39 promoted MCF-7 cell proliferation. A: the effect of FBXO39 and FBXO39ΔF on the cell viability was analyzed by MTT assay in the MCF-7 cells;B: the effect of FBXO39 and FBXO39ΔF on the cell proliferation was detected by EdU assay. The scale bar=100 μm. Mean±SD.n=3.*P<0.05vspEGFP-C2 group.
图4 FBXO39促进MCF-7细胞增殖

Figure 5. The cell cycle analysis. A: the cell cycle was analyzed by flow cytometry in the MCF-7 cells after transfection with pEGFP-C2, pEGFP-FBXO39 and pEGFP-FBXO39ΔF vectors; B:the protein expression of cell cycle-related proteins (cyclin E1and cyclin D1) was detected by Western blot.Mean±SD.n=3.*P<0.05vspEGFP-C2 group.
图5 细胞周期分析
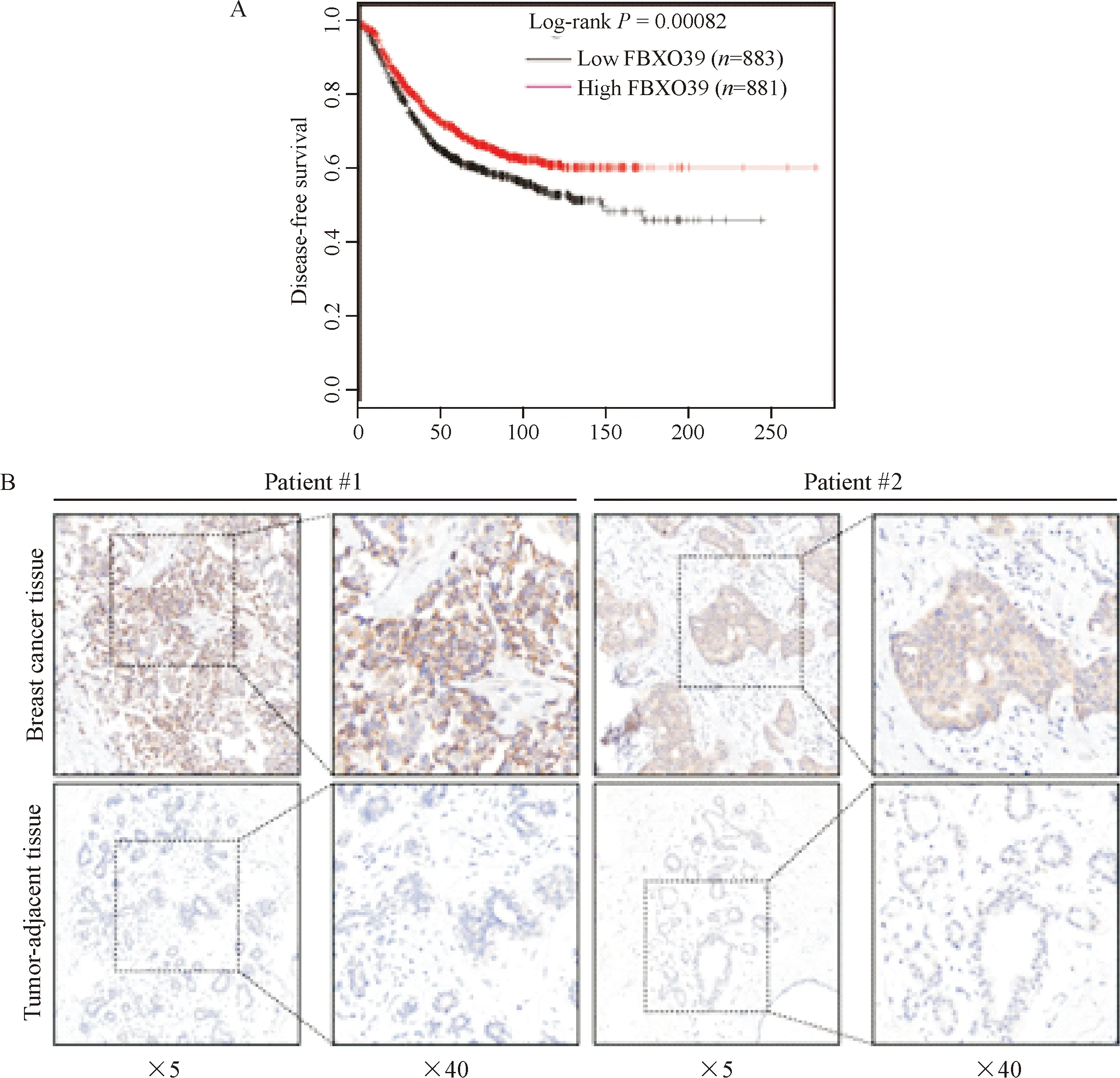
Figure 6. The expression and clinical significance analysis of FBXO39 in breast cancer. A: the survival analysis of the breast cancer patients in Kaplan-Meier Plotter database. The log-rank test was used to evaluate the clinical significance of FBXO39 expression; B:immumohistochemical staining showed that FBXO39 expression in breast cancer and tumor-adjacent tissues.
图6 FBXO39在乳腺癌中的表达及临床意义分析
FBXO39是通过SEREX免疫筛选技术筛选发现的一个新的CT抗原[11],在正常的睾丸组织和多种肿瘤组织中其mRNA呈高表达[17]。在结肠癌中,FBXO39的表达被认为是肿瘤转移的危险指标,具有重要的临床意义[18]。在对乳腺癌的研究中也发现,多种乳腺癌组织以及2种乳腺癌细胞系中FBXO39的mRNA水平表达上调[13],以上的研究结果在一定程度上说明了FBXO39可能具有癌基因的功能。然而,Yang等[19]在研究泌尿上皮肿瘤中DNA甲基化的时候发现FBXO39基因在该种类型的肿瘤中出现普遍甲基化现象,提示FBXO39可能具有抑癌基因的特点。Ponsuksili等[20]在研究猪的下丘脑数量控制基因座的时候,发现FBXO39就位于其中,并暗示FBXO39的功能可能与动物的适应行为以及生物钟调节有关。根据目前的研究进展来看,对于FBXO39在肿瘤中的具体功能仍不明确[10]。
在本研究中,FBXO39过表达能够促进乳腺癌细胞增殖,具有癌基因的特点;FBXO39在乳腺癌组织中表达高于癌膀组织,也具有癌基因的特点。但在生存期统计中高表达FBXO39的患者预后反而较好,具有抑癌基因的特点。二者结论相反。根据我们的实验结果和文献报道[13],我们考虑FBXO39是一个抑癌基因。在乳腺癌发生过程中,可能是其它基因(如BRCA1/2等)或环境因素主导发生的,FBXO39部分参与了抑癌过程。当正常细胞癌变后,FBXO39可能是受到癌变过程中其它因素或癌细胞本身的反馈调控、刺激或突变而呈现高表达状态和“癌基因”特点,此时外源过表达FBXO39会促进肿瘤细胞的增殖,例如抑癌基因p53能够通过功能性突变变成一个“癌基因”促进乳腺癌的发生[21]。因此,对于FBXO39到底是癌基因还是抑癌基因这个问题,需要今后进一步深入研究才能准确回答。但可以肯定的是,FBXO39参与了乳腺癌等多种恶性肿瘤的发生[12-13, 18]。
本课题的研究结果证实了FBXO39能够促进乳腺癌MCF-7细胞的增殖。F-box结构域影响FBXO39蛋白的功能,但不影响它的细胞定位。此外,我们的研究进一步证实FBXO39可能与乳腺癌的发生相关。本研究明确了后续的研究方向,对进一步探究FBXO39蛋白的作用机制有重要意义。

