固定化胰蛋白酶整体小柱的制备及其用于微量蛋白质的快速酶解
郑蒙蒙, 韩 颖, 康经武,*
(1.中国科学院上海有机化学研究所, 生命有机化学国家重点实验室, 上海 200032; 2.中国科学院大学, 北京 100049; 3.上海科技大学, 上海 201210)
近20年来,质谱法已成为大规模蛋白质分析的核心方法。基于质谱的蛋白组学分析通常采用自下而上(bottom-up)的策略[1],需要将完整蛋白质酶解成肽段后采用多维液相色谱-质谱分析得到肽段的氨基酸序列,通过搜库检索鉴定蛋白质[1,2]。在整个分析过程中,蛋白质样品的高效酶解是蛋白质鉴定不可或缺的步骤。目前传统的蛋白酶解方法为溶液酶解,整个过程需要持续12~24 h,耗时较长。因此,蛋白质的快速酶解方法受到研究者们的广泛关注,其中包括如多酶系复合作用,培育筛选高效酶种,技术辅助酶解等,其中以固定化酶技术最具代表性[3,4]。与溶液酶解方法相比,固定化酶技术克服了游离酶稳定性低、难以与底物蛋白质分离等缺点。由于多孔材料的限阈作用[5],胰蛋白酶在微反应器中的局部浓度显著提高,提升了酶解效率。
在众多的固定化酶技术研究中,常用的载体有毛细管柱[6,7]、微流控芯片[8,9]、磁性微球[10-13]、纳米多孔材料[14-16]和溶胶-凝胶[17]等。受材料性质的影响,酶固定化载体也存在自身的优缺点,如微流控芯片易于携带,小型化,可减少样品与试剂的消耗量,但较难实现自动化[18];磁性微球虽然简化了样品分离过程,但微球本身易团聚,表面容易产生不可逆吸附,酶负载量低[10];纳米多孔材料比表面积大,可固载大量的胰蛋白酶,但制备与化学修饰过程繁琐[19]。
20世纪90年代初,Hjerten等[20]、Svec和Frechet[21]分别提出了“有机聚合物整体柱”的概念,随后各类有机聚合整体柱被广泛应用于固定化酶技术研究中[22-24]。与其他载体相比,整体柱材料具有较大的贯穿孔道和比表面积,其特有的对流性能可增加样品的传质效率,样品与底物的接触机会,以及酶催化的速率[25]。整体柱材料制备简单,成本低廉,渗透性良好,机械强度高,是样品处理和色谱分离的理想介质[26]。2002年,Svec课题组[22]以甲基丙烯酸羟乙酯(HEMA)、2-乙烯-4,4二甲基吖内酯(VAL)为功能单体,乙二醇二甲基丙烯酸酯(EDMA)为交联剂在微流体通道内制备了poly(VAL-co-EDMA-co-HEMA)整体材料,用于胰蛋白酶的固定化及蛋白质的快速酶解。2013年,Dovichi课题组[27]将毛细管区带电泳与ESI-MS串联,并与固定化胰蛋白酶整体柱结合,成功地从3 ng小鼠单核巨噬细胞(RAW 264.7)的细胞裂解液中鉴定到7个蛋白质。同年,Krenkova等[28]将肽-N-糖苷酶F固定到修饰后的聚甲基丙烯酸酯整体柱上,用于多糖的分离检测。但整体柱也存在分析通量不高的缺点,且催化酶大多通过与甲基丙烯酸缩水甘油酯(GMA)单体上的环氧基反应被固定在基质上[23,29],环氧基的开环衍生化处理使实验变得耗时繁琐。
为了解决以上问题,本研究发展了光聚合的方式批量制备固定化酶整体小柱用于蛋白质的快速酶解。该整体小柱采用4-戊烯酸琥珀酰亚胺酯(PAS)、HEMA为功能单体,可与交联剂、致孔剂在20 μL的移液器吸头尖端原位聚合形成整体柱床。酶分子的氨基与琥珀酰亚胺酯反应实现固定化,无需引入其他偶联试剂与化学修饰。实验采用离心辅助的方式对蛋白质样品进行上样、酶解、收集,简化了样品处理的流程,减少了样品的损失与污染。整个酶解过程高效省时,可在10 min内完成,且离心式、平行化的样品处理方式显著地提高了样品的分析通量,十分适用于微量蛋白质的快速酶解。
1 实验部分
1.1 仪器、材料与试剂
Dionex Ultimate 3000高效液相色谱-LTQ-Fleet离子阱质谱仪(HPLC-MS/MS)、EASY-nLC 1200纳升级液相色谱-Thermo Orbitrap Fusion Tribrid高分辨串联质谱仪(Nano-LC-MS/MS)(美国Thermo Fisher Scientific公司); Mini spin高速离心机、Concentrator plus真空离心浓缩仪(德国Eppendorf公司); BT25S分析天平、PB-20标准型pH计(德国Sartorius公司); JY92-Ⅱ超声波细胞破碎机(宁波新芝生物科技股份有限公司); Rotavapor R-210旋转蒸发仪(瑞士Buchi公司); S-4800型扫描电子显微镜(日本日立株式会社)。
胰蛋白酶(trypsin)、二甲基亚砜(DMSO)、十二醇(1-dodecanol)、二硫苏糖醇(DTT)、甲酸(HCOOH,色谱纯)、碘代乙酰胺(IAM)(美国Sigma-Aldrich公司);蛋白酶抑制剂(德国Roche公司);乙腈和甲醇(色谱纯,德国Merck公司);细胞色素C(CYC)、三羟甲基氨基甲烷(Tris)、尿素(上海阿拉丁生化科技股份有限公司);牛血清白蛋白(BSA)、碳酸氢铵、盐酸(HCl)、N,N-二甲基甲酰胺(DMF)、二氯甲烷(CH2Cl2)、氨水(上海国药集团化学试剂有限公司);季戊四醇三丙烯酸酯(PETA,美国Alfa Aesar公司); 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl,上海安耐吉化学公司); 4-二甲氨基吡啶(DMAP,日本TCI公司);磷酸缓冲盐溶液(PBS, pH=7.4)、Axygen®系列20 μL吸头(上海生工生物工程股份有限公司); Sep-pack C18固相微萃取小柱(美国Waters公司); Pierce BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司)。Milli-Q去离子水由Millipore纯水仪(美国Millipore公司)制备得到。
人急性早幼粒白血病(NB4)细胞与人急性T细胞白血病(Jurkat T)细胞由上海交通大学医学院馈赠。
1.2 固定化胰蛋白酶整体小柱的制备
1.2.1整体小柱的制备
4-戊烯酸琥珀酰亚胺酯功能单体的制备:取4.5 gN-羟基琥珀酰亚胺,置于干燥的圆底烧瓶中,抽换氮气3次后,加入150 mL二氯甲烷,搅拌均匀,加入3 mL戊烯酸,待白色颗粒溶解后再加入6.9 g EDC·HCl和4.0 g DMAP,室温搅拌12 h,旋干,进行柱层析分离,旋转蒸发浓缩后得到4-戊烯酸琥珀酰亚胺酯白色晶体5.57 g,产率为94.3%。
整体小柱的制备:取20 μL的移液器吸头适量,分别于乙醇、丙酮中各超声10 min,自然风干后,将柱头封端。取0.090 5 g二苯甲酮[30],置于1 mL 1,4-丁二醇-甲醇(1∶1, v/v)中,混合均匀后用氮气吹扫去氧。取10 μL上述溶液导入柱头内,在氮气保护下,于365 nm紫外灯下照射15 min,重复3次。将功能单体PAS和HEMA、交联剂PETA、致孔剂DMSO、DMF和十二醇按质量分数5%、7.4%、12.6%、33%、8%和34%的比例混合均匀,取7 μL于柱头中,在紫外灯装置中光照30 min。聚合结束后切去柱头的封端,用乙腈冲洗以除去未反应的功能单体和致孔剂,制得整体小柱,常温保存。
1.2.2胰蛋白酶的固定化
用0.1 mol/L磷酸盐缓冲盐(pH 6.8)洗涤整体小柱3次,加入0.5 mg/mL 100 μL胰蛋白酶溶液(溶解于pH 6.8的磷酸盐缓冲溶液),以2 000 r/min离心15 min,重复3次,然后用500 mmol/L Tris-HCl(pH 7.5)封闭未反应的PAS基团[19],于-20 ℃冰箱中保存待用。
1.3 样品制备与处理
1.3.1NB4细胞与Jurkat T细胞培养
NB4细胞与Jurkat T细胞均接种于含体积分数10%的胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养液中,置于37 ℃、含5%(体积分数) CO2的饱和湿度孵箱中悬浮培养。每隔48 h更换新的培养基,传代培养。
1.3.2固定化酶整体小柱酶解标准蛋白质与细胞样品
采用固定化酶整体小柱酶解标准蛋白质时,整体小柱先用50 mmol/L碳酸氢铵溶液洗涤3次,除去未键合的胰蛋白酶。取适量CYC与BSA,置于50 mmol/L碳酸氢铵缓冲液中,分别配制成200 ng/μL的CYC标准溶液和BSA标准溶液,各取100 μL于固定化酶整体小柱内,以2 000 r/min离心酶解10 min,收集酶解液,进行HPLC-MS/MS分析。
在酶解细胞样品时,配制10 mL裂解缓冲液(4.804 8 g尿素和0.039 5 g碳酸氢铵,以及一片蛋白酶抑制剂片剂溶于10 mL Milli-Q H2O中)。分别收集1×105个NB4细胞与Jurkat T细胞,用预冷的PBS缓冲液清洗3次,加入100 μL预冷的裂解缓冲液,在冰上以60 W功率超声破碎2 min。然后以9 780 r/min离心10 min,收集上清液。采用Pierce BCA蛋白定量试剂盒对细胞裂解液进行定量。向蛋白质溶液中加入终浓度为10 mmol/L的DTT溶液,置于37 ℃温育1 h,随后加入终浓度为5 mmol/L的IAM,并置于暗室中常温反应45 min。向蛋白质溶液中加入50 mmol/L碳酸氢铵,将尿素浓度稀释至1 mol/L。取稀释后的细胞裂解液于固定化酶整体小柱中,以2 000 r/min离心酶解10 min,收集酶解液,通过Sep-pack C18固相微萃取柱脱盐。酶解所得肽段进行Nano-LC-MS/MS分析。
1.3.3溶液酶解标准蛋白质与细胞样品
取适量CYC和BSA于50 mmol/L碳酸氢铵缓冲液中,分别配制成200 ng/μL的CYC标准溶液和BSA标准溶液,于100 ℃变性处理10 min。待标准样品冷却至室温,以蛋白质与酶质量比为40∶1的比例加入胰蛋白酶,置于37 ℃水浴中酶解16 h。酶解结束后置于-20 ℃冰箱内保存备用。酶解所得肽段进行HPLC-MS/MS分析。
在酶解细胞样品时,预处理步骤同1.3.2节,1×105个NB4细胞与Jurkat T细胞经超声破碎、还原烷基化、样品稀释后,在样品溶液中以蛋白质与酶质量比为40∶1的比例加入胰蛋白酶,置于37 ℃水浴中酶解16 h。酶解结束后通过Sep-pack C18脱盐。酶解所得肽段进行Nano-LC-MS/MS分析。
1.4 分析条件
1.4.1标准蛋白质样品
标准蛋白样品酶解后由Dionex Ultimate 3000液相色谱与LTQ-Fleet离子阱质谱联用系统进行肽段的分离与鉴定。
色谱条件:分析色谱柱为Agilent Zorbax SB-C18(250 mm×4.6 mm, 5 μm);柱温为25 ℃;流动相A相为0.1%(v/v)甲酸水溶液,B相为0.1%(v/v)甲酸乙腈溶液;流速为0.5 mL/min;梯度洗脱程序:0~25 min, 5%B~45%B; 25~30 min, 45%B~72%B; 30~40 min, 72%B。进样量为10 μL(标准蛋白质的质量浓度为200 ng/μL)。
质谱条件:离子源为电喷雾电离源,正离子模式;离子源电压为3.0 kV;金属毛细管温度为275 ℃;一级质谱扫描范围为m/z300~1 800;二级质谱中母离子的选择采用数据依赖模式;碰撞诱导解离(CID)能量为35 eV。
数据检索条件:由MaxQuant(1.5.4.1)软件进行检索,蛋白酶切类型选择胰蛋白酶,允许最大肽段漏切位点数为2。因BSA采用了高温加热的方式进行蛋白质变性预处理,检索时无固定修饰,蛋氨酸上的氧化(Oxidation, M)与蛋白质N端的乙酰化(Acetyl, proteinN-term)设置为可变修饰。允许的最小肽长度设置为4。肽段水平假阳性率(FDR)≤1%。
1.4.2细胞样品
细胞样品酶解后由EASY-nLC 1200与Thermo Orbitrap Fusion Tribrid质谱联用系统进行分离与鉴定。
色谱条件:色谱柱为实验室自主装填的Nano-C18柱(15 cm×75 μm, 3 μm,填料来自德国Dr.Maisch公司);柱温为25 ℃;流动相A相为0.1%(v/v)甲酸水溶液,B相为80%(v/v)乙腈水溶液(含0.1%(v/v)甲酸);流速为300 nL/min;梯度洗脱程序:0~50 min, 0%B~30%B; 50~53 min, 30%B~38%B; 53~54 min, 38%B~90%B; 54~60 min, 90%B。进样量:1 μL(肽段质量约为200 ng)。
质谱条件:离子源为电喷雾电离源,正离子模式;离子源电压为2.3 kV;一级质谱分辨率为120 000,一级质谱的自动增益控制(AGC)为5×105,最大离子注入时间为50 ms,全扫描范围为m/z300~1 400;二级质谱中母离子的选择采用数据依赖模式;高能诱导裂解(HCD)的归一化碰撞能量为28%,二级AGC为5×104,动态质量排除窗口为30 s。
数据检索条件:由MaxQuant(1.5.4.1)软件进行检索,蛋白酶切类型选择胰蛋白酶,允许最大肽段漏切位点数为2。半胱氨酸上的氨基甲酰甲基化(carbamidomethyl)为固定修饰,蛋氨酸上的氧化与蛋白质N端的乙酰化为可变修饰。允许的最小肽长度设置为7。肽段水平FDR≤1%。鉴定到的细胞蛋白数量为单次实验的结果。
2 结果与讨论
2.1 固定化酶整体小柱的制备及表征
在制备有机聚合整体柱时,因GMA在聚合后仍含有较活泼的环氧基而颇受青睐[23,29],但环氧基的化学改性需要在强碱性或高温下进行,条件比较严苛,于是本文选用了更活泼的PAS作为功能单体之一,其在常温下即可与氨基等活性基团反应,易于配体修饰。为了降低水解肽段的非特异性吸附[15],实验选用亲水性的PETA作为交联剂,同时在聚合溶液中加入功能单体HEMA增加整体材料的亲水性。三元致孔剂DMSO、DMF、十二醇的使用可以得到良好的整体骨架与孔结构。
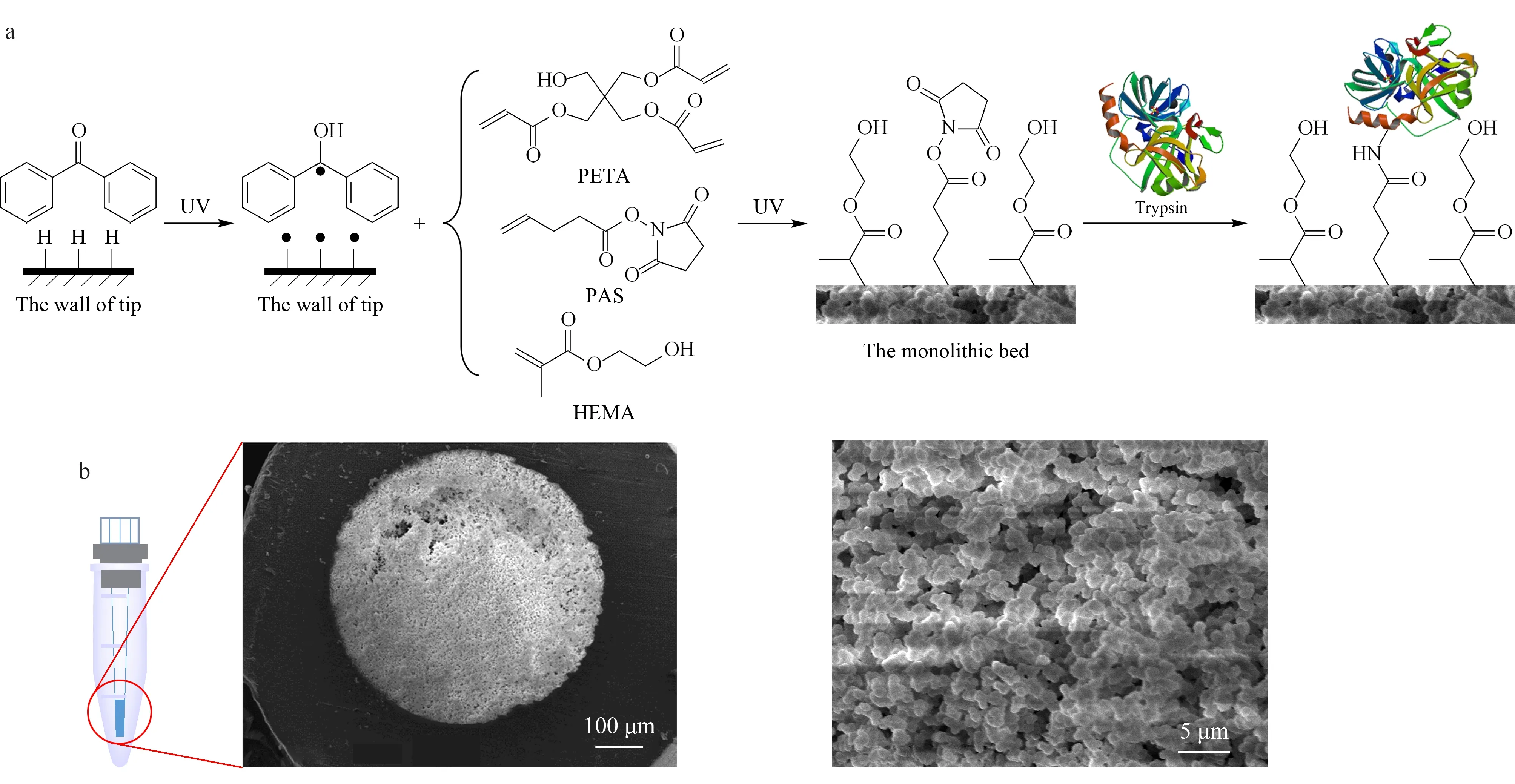
图1 固定化胰蛋白酶整体小柱的(a)制备流程图和(b)扫描电镜图
本研究采用光聚合的方式制备整体小柱,聚合过程如图1a所示:在紫外光照射下,光敏剂二苯甲酮从移液器吸头的聚丙烯表面夺氢生成半频哪醇自由基,并与吸头内表面的自由基结合形成稳定的表面引发剂。在柱头加入聚合液后,再次进行紫外灯照射,表面引发剂被激活,释放出自由基,实现功能单体与小柱内表面的交联接枝反应。整个光聚合反应仅需2 h便可完成。整体小柱切面的扫描电子显微镜(SEM)图见图1b。可以看出,柱体材料与移液器吸头内表面结合紧密,无脱壁、塌陷等现象,通过观察SEM放大图,该材料具有较大的贯穿孔道,既保证了胰蛋白酶的稳定固定化,又保证了良好的渗透性,使溶液在柱床中进行对流传质。
2.2 胰蛋白酶固载量的测定
胰酶的固载量是影响酶解效率的关键因素[5]。在特定的限阈范围内,胰酶的固载量越大,其局部浓度越大;与底物蛋白分子接触的机会越大,则酶解效率越高[31]。实验用Pierce BCA试剂盒测定固定化前后缓冲溶液中胰蛋白酶的质量,以确定整体小柱上胰酶的固载量。
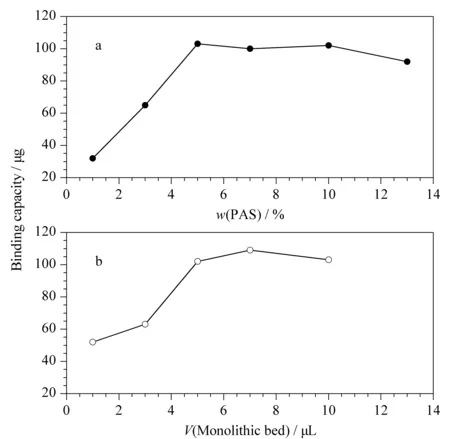
图2 不同(a)PAS质量分数和(b)柱床体积对胰蛋白酶固载量的影响
实验首先考察了PAS的质量分数对胰酶固载量的影响,在保持功能单体(12.4%)、交联剂(12.6%)与致孔剂(75%)所占质量分数不变的情况下,调节功能单体 PAS与 HEMA的比例,制备了6款整体小柱。如图2a所示,当聚合溶液中活性酯PAS的质量分数从1%增至5%时,酶的固载量逐渐上升;活性酯的质量分数从5%继续增加至13%时,酶的固载量略有降低。亲水性的聚合材料可以降低水解肽段的非特异性吸附,在聚合溶液中加入HEMA可增加整体材料的亲水性。实验最终确定功能单体PAS与HEMA的质量分数分别为5%和7.4%,在确保胰酶最大固载量的同时减少了水解肽段的非特异性吸附。
随后实验考察了整体小柱的柱床体积对酶固载量的影响,结果见图2b。随着柱床体积增加,胰酶的固载量也逐渐增加。但当柱床体积达到10 μL时,整体小柱在酶固定化过程中出现了明显的脱壁现象。实验最终选用7 μL的柱床体积,此时胰酶的固定量为108.8 μg。
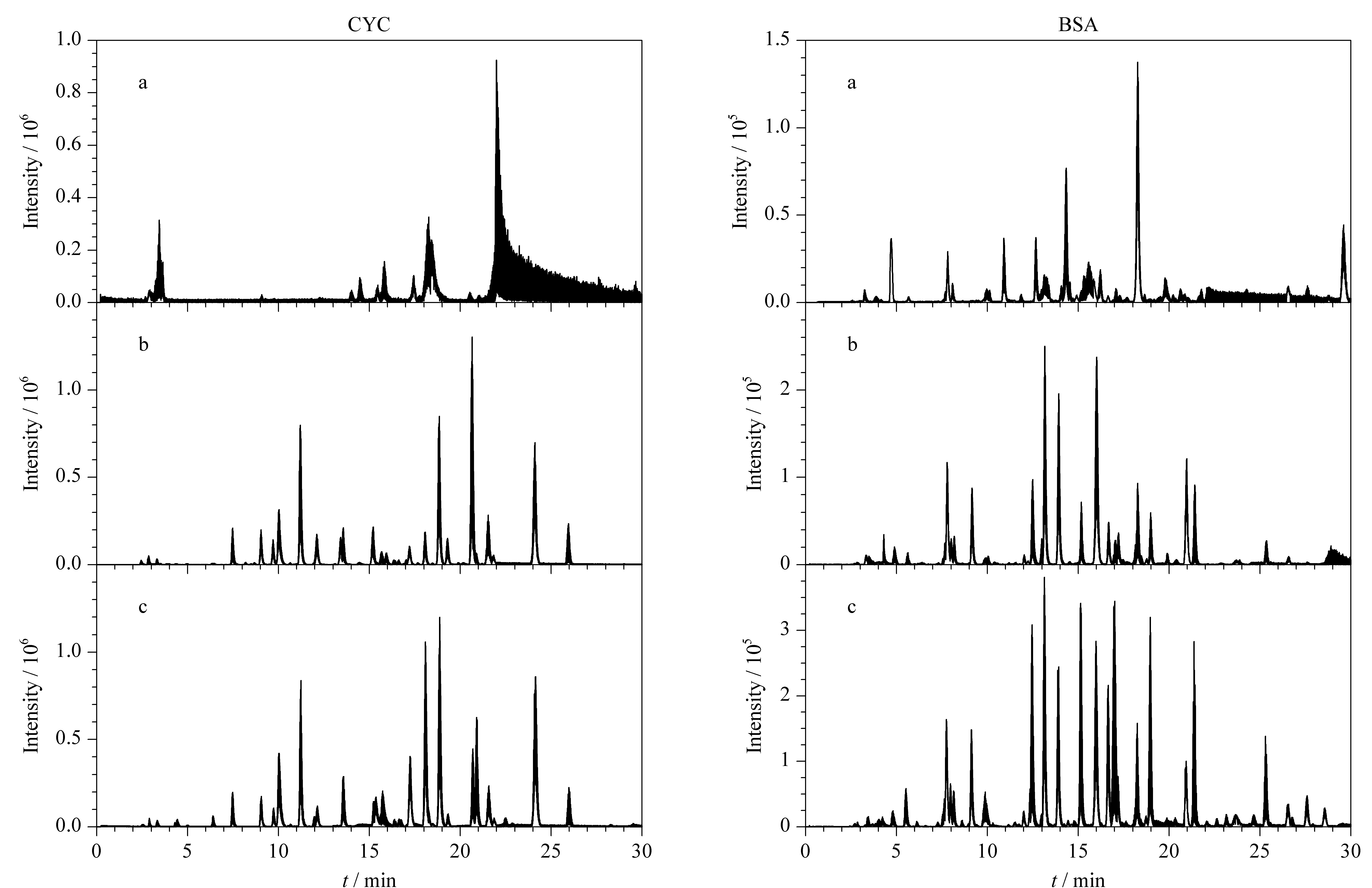
图3 CYC和BSA经(a)溶液酶解10 min、(b)固定化胰蛋白酶整体小柱酶解10 min、(c)溶液酶解16 h后所得肽段的色谱图
2.3 固定化酶整体小柱用于标准蛋白质的高效酶解
在均相酶解过程中,传质速率是限制酶解动力学过程的主要因素之一[31]。大多数常用的内肽酶和外肽酶的米氏常数(Km)值都在5~50 mmol/L之间,当蛋白质浓度低于μmol/L水平时,酶解过程将受到显著的阻碍[32]。为了避免这类浓度极低却又重要的痕量蛋白质丢失,可以设法提高胰酶与蛋白质的相对浓度。在固定化酶整体小柱中,酶分子以共价键合的方式固定在柱体的贯通孔道内,相对于游离酶而言,其局部浓度得到了很大提升,当样品上样后,待酶解蛋白质与胰蛋白酶的相对浓度也进一步增加[31]。同时离心带来的驱动力可以将所有流动相强制通过多孔介质,达到最大的对流效果[33],酶解效果也随之增强。
实验首先考察了不同酶解时间对固定化酶整体小柱酶解效率的影响。当酶解时间为5 min时,200 ng/μL的CYC标准溶液酶解并不完全;而将酶解时间增加至10 min时,酶解效果良好;当酶解时间为15 min时,酶解效率与10 min条件下的效果相当。因此选用10 min作为优化后的酶解时间。
在优化酶解时间后,分别取100 μL 200 ng/μL的CYC和BSA标准溶液于固定化酶整体小柱中酶解10 min。同时,取相同浓度与体积的CYC和BSA标准溶液于37 ℃恒温条件下分别溶液酶解10 min与16 h。不同酶解条件下得到的酶解液分别进行HPLC-MS/MS分析,所得色谱图见图3。对比图3a与图3b可以发现,当酶解时间为10 min时,固定化酶整体小柱的酶解效果明显优于溶液酶解。CYC标准溶液通过固定化酶整体小柱酶解可鉴定出17条肽段,对应的氨基酸序列覆盖率为85%,溶液酶解10 min仅能鉴定到2条肽段,且在图3a的22 min处可明显观察到CYC蛋白的信号峰。当溶液酶解时间增至16 h时(见图3c),酶解效率提升,可以鉴定到17条肽段。
将BSA标准溶液恒温溶液酶解10 min(见图3a),仅可鉴定到4条肽段,序列覆盖率仅为5.8%,但将BSA通过固定化酶酶解10 min(见图3b)后可鉴定到37条肽段,氨基酸序列覆盖度为43%,与16 h的溶液酶解(见图3c)效果基本一致。但溶液酶解由于酶解时间过长,容易发生肽段非特异性裂解,胰酶自酶解等现象[2],在色谱图中产生信号干扰峰。而整体小柱的孔道可以稳定胰蛋白酶,提供较高的局部酶浓度,在缩短酶解时间的同时有效避免了自酶解干扰。
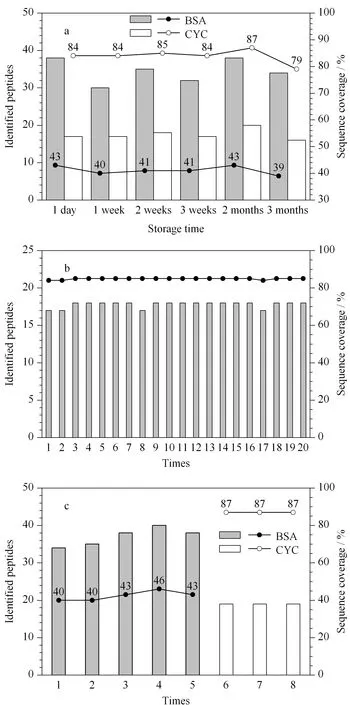
图4 不同条件下固定化胰蛋白酶整体小柱酶解CYC和BSA得到的肽段数量和序列覆盖率
由于细胞中的蛋白质呈现高动态分布,许多蛋白质在低丰度下自然表达,这类低浓度微量蛋白的酶解是蛋白组学研究中遇到的不利因素[34]。为了考察固定化酶整体小柱对微量蛋白质的酶解效果,实验选择了质量浓度为1 ng/μL与10 ng/μL的CYC标准溶液作为样品,经固定化酶整体小柱酶解后进行HPLC-MS/MS分析。实验结果表明,当CYC含量低至1 ng/μL时,仍能鉴定到5条肽段,对应的氨基酸序列覆盖度为24%;当含量提高至10 ng/μL时,成功鉴定到12条肽段,对应的序列覆盖度为62%。说明固定化酶整体小柱对低浓度标准蛋白仍具有较好的酶解效果。
2.4 固定化酶整体小柱稳定性和重复性考察
本文还考察了固定化酶整体小柱的稳定性。将固定化酶整体小柱于-20 ℃储存1 d、1周、2周、3周、2个月和3个月后取出,恢复至室温后用于CYC和BSA标准溶液的酶解(200 ng/μL)。实验结果如图4a所示,即使储存了3个月,该整体小柱仍维持着较高的酶解性能,在酶解产物中分别鉴定到了16条CYC肽段和34条BSA肽段,酶解效率较新鲜制备的整体小柱仅有轻微的降低,说明固定化可以稳定胰蛋白酶的性能。
为了考察固定化酶整体小柱的可重复使用性,实验选取了同一支固定化酶整体小柱先后酶解了20个200 ng/μL的CYC标准溶液,其中,每两个相邻样品间均用50 mmol/L碳酸氢铵溶液清洗2次。得到的实验结果如图4b所示:同一支整体小柱即使重复使用了20次,酶解效率依然没有降低,第20次实验中仍能鉴定到17条肽段,对应氨基酸序列覆盖率高达85%。考虑到同一支固定化酶整体小柱重复处理不同样品时可能会存在样品残留引起的记忆效应。本实验取同一支整体小柱依次酶解5批200 ng/μL的BSA标准溶液,随后采用这支整体小柱酶解3批200 ng/μL的CYC标准溶液(见图4c)。在分析BSA时,整体小柱维持了稳定的酶解性能,5次酶解鉴定到的肽段数量相当,氨基酸序列覆盖度为40%~46%;分析CYC时,搜库结果显示没有属于BSA的肽段,重复使用的整体小柱对CYC仍有较高的酶解效率,对应蛋白质的氨基酸序列覆盖率高达87%。以上结果说明,固定化酶整体小柱对肽段的非特异性吸附较低,可重复用于酶解不同的蛋白质样品。
2.5 固定化酶整体小柱酶解NB4与Jurkat T细胞
为了考察固定化酶整体小柱对复杂样品的酶解效率,本文选用了NB4细胞与Jurkat T细胞进行实验。分别收集1×105个NB4与Jurkat T细胞,超声破碎、还原烷基化后分别导入整体小柱内,以2 000 r/min离心10 min后收集酶解液,经脱盐处理后进行Nano-LC-MS/MS分析。作为对照,相同数量的细胞样品经相同条件处理后于37 ℃溶液酶解16 h,收集的酶解液经脱盐后由同一仪器相同参数下分析。
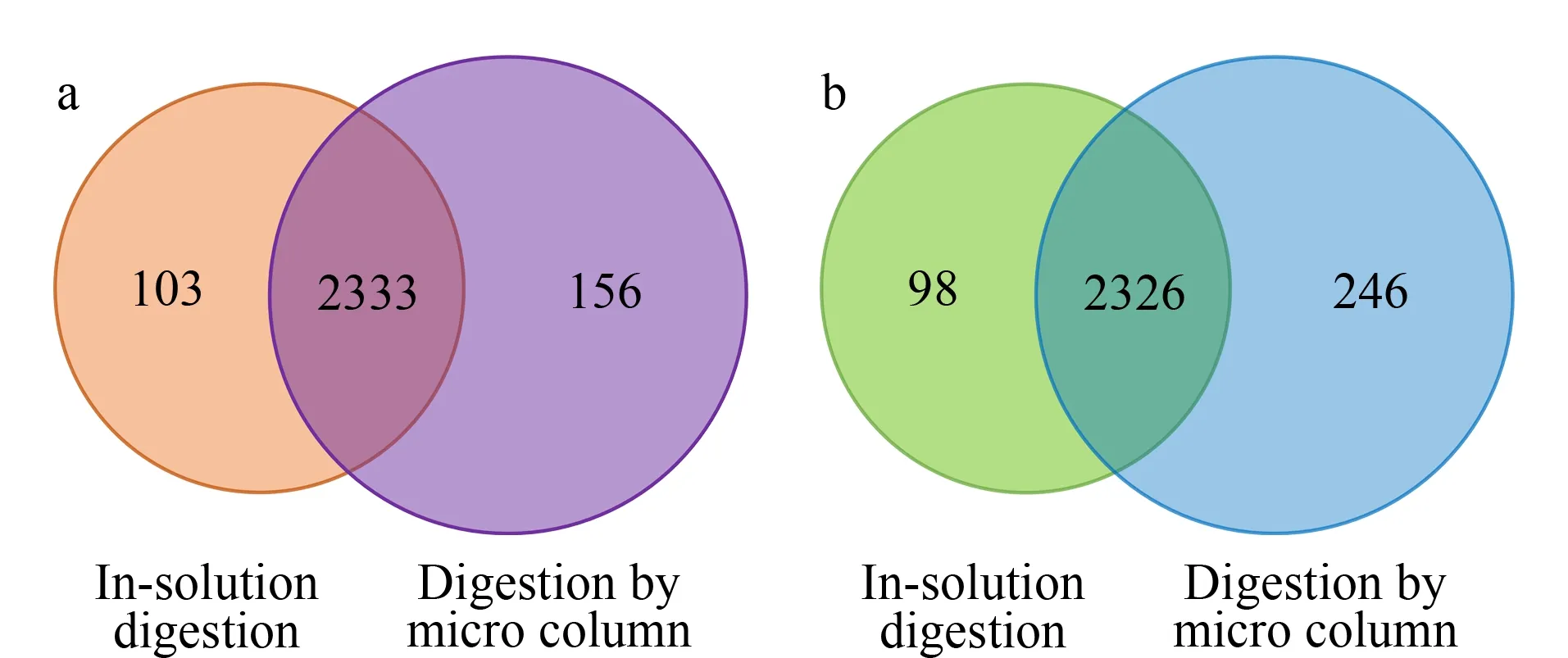
图5 两种方法酶解(a)NB4细胞和(b)Jurkat T细胞所得蛋白质数量的文氏图
图5a显示了NB4细胞蛋白质组分析结果,从文氏图可以看出,两种酶解方法共同鉴定到2 333个蛋白质,固定化酶整体小柱鉴定到的蛋白质总数为2 489个,大于溶液酶解得到的蛋白质数量(2 436个),提高了2.2%。对于Jurkat T细胞而言,整体小柱鉴定的蛋白质总量为2 572个,较溶液酶解鉴定到的蛋白质数量提高了6.1%。在胰蛋白酶的固定化过程中,偶尔会发生酶解活性位点被堵塞、胰酶三级结构发生扭曲等现象[35],而对于这两种细胞系而言,溶液酶解与固定化酶酶解两种方式鉴定到的蛋白质重叠部分占比较大,说明了胰蛋白酶在固定过程中并未过多改变自身的构象与活性,固定化后仍然维持着稳定的酶解性能和高效的酶解效率。
以上分析结果体现了固定化酶整体小柱在复杂蛋白质样品中应用的可行性。复杂生物样品在整体小柱中的酶解时间也仅需10 min,鉴定到的蛋白质数量优于溶液酶解方法。且离心式、平行化的酶解过程简化了样品处理的流程,减少了样品的损失与污染,同时增加了样品处理的通量,十分适用于高通量蛋白组学及临床医学的研究。
3 结论
在基于质谱的蛋白质组学分析中,样品制备是蛋白质分析的关键步骤,而蛋白质的酶解效率将影响整个样品前处理的进程。本研究以光聚合法在20 μL移液器吸头原位聚合形成整体小柱用于微量蛋白质的快速酶解。该固定化酶整体小柱使用4-戊烯酸琥珀酰亚胺酯为功能单体,无需化学修饰与其他偶联试剂即可一步实现胰蛋白酶的固定化。同理,该固定化技术有望应用于其他不同特性的酶。制备得到的整体小柱机械强度高,化学性能稳定。在酶解过程中,样品消耗量低,分析通量高,十分适用于微量的蛋白组学样品分析。将固定化酶整体小柱应用于酶解NB4细胞与Jurkat T细胞,酶解效果优于常规的溶液酶解,在蛋白质组学分析领域展现出较大的应用潜力。