黄山不同海拔植被带土壤活性有机碳、氮及其与酶活性的关系
姚 兰,张焕朝,胡立煌,王艮梅,方炎明
(1.南京林业大学 南方现代林业协同创新中心,江苏 南京 210037;2.南京林业大学 林学院,江苏 南京 210037;3.南京林业大学 生物与环境学院,江苏 南京210037)
森林作为重要的生态系统,其碳储量是陆地碳的46%,但是近几十年来,森林对全球变暖的正反馈作用,导致森林土壤中碳的大量流失[1]。土壤碳库的动态变化主要体现在土壤活性碳库中。土壤活性有机碳受植被和土壤微生物影响强烈,并与大气二氧化碳存在较频繁的相互作用,因此在全球气候变暖的背景下,研究环境变量和土壤有机碳储量对未来气候变化的影响具有重要意义[1-2]。溶解性有机碳(dissolved organic carbon,DOC)、微生物生物量碳(microbial biomass carbon,MBC)和易氧化有机碳(readily oxidization carbon,ROC)作为土壤活性碳库的3个重要指标,由于其周转率高且快,所以相较于总有机碳(total organic carbon,TOC),更能反映森林环境随海拔梯度的变化[3]。DOC不仅能够从森林底部向矿质土壤进行水文输送,而且是矿质土壤中有机碳的重要来源,是全球碳循环中的重要碳通量[4]。MBC是土壤有机质的重要组成部分,占土壤有机碳的2%~5%,在养分循环和整个有机质动态中起着重要作用[5]。ROC指能被333 mmol·L-1高锰酸钾氧化的碳,在土壤碳库中其含量通常大于MBC,能代表驱动反硝化和甲烷生成过程所需的碳源[6]。由于碳和氮循环之间的相互作用,森林生态系统氮素的储存与碳库之间紧密耦合,在全球气候变化中起重要作用[7]。溶解性有机氮(dissolved organic nitrogen,DON)是微生物和植物的一种重要氮源,而微生物和植物通过产生和吸收各种温室气体从而对当地气候变化起作用[8]。微生物生物量氮(microbial biomass nitrogen,MBN)不仅在土壤氮矿化等过程中起重要作用,而且对气候变化具有敏感的生物指示作用[9]。土壤酶在许多涉及土壤有机质降解、转化和矿化的生化过程中起重要作用[10]。已有研究表明:土壤酶活性与土壤养分动态密切相关,尤其是DON[11]。土壤活性有机碳不仅依赖于TOC,也与土壤脲酶(urease,UE)、过氧化氢酶(catalase,CAT)等酶活性密切相关[12]。土壤酶如β-葡萄糖苷酶(β-glucosidase,βG)与土壤DOC和DON储量密切相关,DOC和DON储量对土壤碳通量和循环至关重要[8]。黄山具有明显的植被和土壤垂直地带性[13],关于该区域的森林土壤碳氮库及相关酶活性的研究报道较少。本研究以黄山4种不同海拔典型植被带的土壤为研究对象,分析不同植被带土壤碳氮及其活性组分与相关土壤酶活性关系,以期为评价黄山森林生态系统的土壤碳储量和生产力以及保护区森林土壤管理等提供依据。
1 材料与方法
1.1 研究区概况
黄山位于安徽省南部(30°01′~30°18′N, 118°01′~118°17′E), 景区面积为 160.6 km2, 地势高差达1400 m,地处亚热带季风气候带。黄山植物群落分布自下而上为次生林、常绿阔叶林、常绿落叶阔叶混交林、落叶阔叶林、山地矮林与灌丛及山地草甸;土壤自下而上分别为黄红壤、黄壤、暗黄棕壤、酸性棕壤,山顶局部分布有山地草甸土及山地草甸沼泽土[13]。
1.2 研究方法
1.2.1 样品采集 2018年7月,沿黄山云谷寺—光明顶步道,以海拔、植被类型及实际情况为指标,按约300 m的间隔、远离步道处选择4个海拔植被带样地,样地基本情况见表1。每个海拔植被带设置3个10 m×10 m的样方,每个样方内按S型采集10个表层10 cm深的土样,用冰盒运回实验室。一份土样过2 mm筛后保存于4℃冰箱中用于溶解性有机碳、氮以及微生物生物量的测定,另一份风干过筛后用于其他指标的测定。

表1 样地概况Table 1 Basic situations of the sampling sites
1.2.2 土壤活性组分及基本性质 总有机碳(TOC)用重铬酸钾氧化-外加热法测定;全氮(total nitrogen,TN)用开氏法测定;pH值用电位法测定,水土质量比为2.5∶1.0[14]。微生物量碳(MBC)和微生物量氮(MBN)用氯仿熏蒸浸提法测定[15],熏蒸土和未熏蒸土均用0.5 mol·L-1的硫酸钾浸提30 min(土液质量比为1∶4),提取液中的有机碳质量分数用有机碳分析仪测定,全氮质量分数用开氏消化法测定。wMBC=EC/0.45;wMBN=EN/0.45。其中:EC和EN分别为熏蒸和未熏蒸土壤有机碳、全氮质量分数之差,转换系数为0.45。溶解性有机碳(DOC)和溶解性有机氮(DON)的测定[16]:用去离子水振荡浸提(水土质量比为5∶1)30 min,高速(15000 r·min-1)离心10 min,用0.45 μm滤膜抽滤,用有机碳分析仪测定滤液碳浓度得到DOC,用过硫酸钾氧化-紫外分光光度法测定滤液TN,靛酚蓝比色法测定NH4+-N,紫外分光光度法测NO3--N,则wDON=wTN-(wNH4+-N+wNO3--N)。易氧化有机碳(ROC)用高锰酸钾氧化法测定,过0.25 mm的风干土加333 mol·L-1高锰酸钾溶液25 mL,震荡1 h后离心,取上清液稀释250倍,在分光光度计565 nm波长下比色[16]。
1.2.3 土壤酶活性 脲酶(UE)用靛酚蓝比色法测定,酶活性以24 h土中产生NH3-N表示(mg·g-1·d-1);β-葡萄糖苷酶(βG)用硝基酚比色法测定,酶活性以土中产生对硝基苯酚表示(mg·g-1·d-1);过氧化氢酶(CAT)用高锰酸钾滴定法测定, 酶活性以土中消耗的高锰酸钾表示(mL·g-1·h-1)[17]。
1.2.4 林下植被多样性 调查样地林下植被种类、株数或多度、盖度、高度等,并计算其多样性和重要值。 Shannon-Wiener多样性指数(H):H=-∑PilnPi; Simpson优势度指数(D):D=∑。 其中:Pi为样方内物种的重要值,Pi=(相对盖度+相对高度)/2。
1.2.5 数据分析 用SPSS 20软件统计分析,单因素方差分析(one-way ANOVA)和Duncan法比较不同海拔植被带间的差异。Origin 2016软件制图。用R 3.3.4软件Performance Analytics包做Pearson相关矩阵图;Vegan包做酶活性和活性有机碳、氮组分冗余分析(redundancy analysis,RDA),对酶的数据进行Hellinger转化,999次蒙特卡罗置换检验(Monte-Carlo permutation test)考察环境因子的显著性。
2 结果与分析
2.1 不同海拔植被带土壤碳氮及其活性组分
不同植被带土壤碳及其活性组分呈现随海拔变化的特征(表2)。各海拔植被带的土壤TOC和ROC质量分数差异均不显著。高山草甸的土壤MBC平均质量分数最高,EDFⅡ的DOC平均质量分数最高,且各海拔植被带的MBC和DOC质量分数存在极显著差异(P<0.01)。说明不同树种覆盖的植被带,导致土壤活性碳及微生物生物量的差异。
由表2可知:高山草甸土TN,MBN及DON质量分数均最高,分别为4.487,260.99,74.01 mg·kg-1。常绿落叶阔叶混交林下土壤TN和MBN质量分数较低,分别为2.85和65.70 mg·kg-1;常绿阔叶林下的土壤DON质量分数最低,为39.35 mg·kg-1。说明高海拔土壤氮素有效性较高。不同海拔植被带土壤TN和MBN质量分数存在极显著差异(P<0.01),而各海拔植被带间的土壤DON质量分数无显著差异。
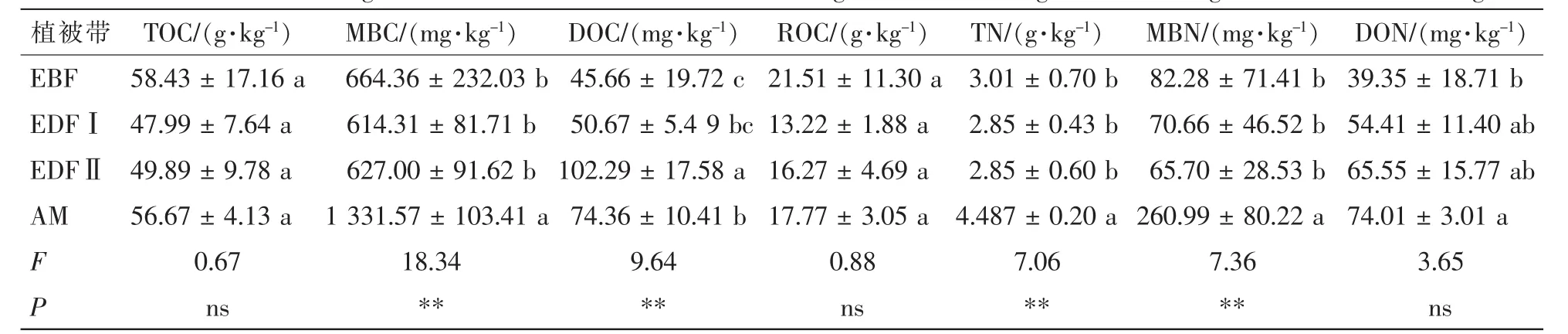
表2 黄山不同海拔植被带土壤碳氮及其活性组分Table 2 Soil carbon and nitrogen and their labile fractions in different vegetation zones along an altitudinal gradient on Mount Huangshan
2.2 不同海拔植被带土壤活性有机碳氮分配比例
MBC/TOC称为土壤微生物熵[18]。从表3可见:高山草甸土的微生物熵(2.35%)明显高于其他植被带,而常绿阔叶林的土壤微生物熵(1.12%)最低;常绿落叶阔叶混交林Ⅱ的DOC平均分配比例(20.65%)显著高于其他植被带,常绿阔叶林的DOC平均分配比例最低(7.95%),不同海拔植被带的微生物熵以及DOC/TOC存在显著差异(P<0.01)。总体上常绿落叶阔叶林的ROC分配比例最大(35.11%),常绿落叶阔叶混交林Ⅰ则最小(27.66%)。不同植被带土壤活性有机氮分配比例呈现不同的海拔变化特征。高山草甸土的MBN/TN(5.79%)明显高于其他植被带,但是高山草甸的DON/TN(1.66%)较低。相较于其他植被类型,常绿落叶阔叶混交林MBN的分配比例较低,DON的分配比例较高。说明不同植被类型影响土壤微生物生物量和活性,从而在一定程度上影响土壤DON分配比例。
2.3 不同海拔植被带土壤酶活性
如图1所示:脲酶活性在常绿阔叶林下达最高值,为1.81 mg·g-1·d-1,在常绿落叶阔叶混交林Ⅱ下达最低值,为0.73 mg·g-1·d-1,且这2种植被类型的脲酶活性差异显著(P<0.05)。β-葡萄糖苷酶和过氧化氢酶均在高山草甸表现为最高活性,分别是2.05 mg·g-1·d-1和19.12 mL·g-1·h-1;β-葡萄糖苷酶在常绿落叶阔叶混交林Ⅱ下的活性最低,为0.94 m·g-1·d-1,过氧化氢酶在常绿阔叶林下的活性最低,为11.30 mL·g-1·h-1。 不同海拔植被带的 β-葡萄糖苷酶(F=23.85,P<0.01)和过氧化氢酶(F=23.24,P<0.01)均呈极显著差异,脲酶呈显著差异(F=4.47,P<0.05)。
2.4 相关性及冗余分析
如表4所示:不同海拔植被带的土壤碳氮及其活性组分与土壤酶及其他土壤因子之间存在一定的相关性。就土壤碳组分而言,TOC与TN(R=0.65,P<0.05)、ROC(R=0.90,P<0.001)存在显著正相关关系; MBC 与 TN(R=0.96)、MBN(R=0.92)、 β-葡萄糖苷酶活性(R=0.86)呈极显著正相关关系(P<0.001),与过氧化氢酶(R=0.66,P<0.05)显著正相关;DOC与pH值显著负相关(R=-0.65,P<0.05)。就土壤氮组分而言,TN与MBN(R=0.89,P<0.001)、β-葡萄糖苷酶活性(R=0.76,P<0.01)极显著正相关; MBN与β-葡萄糖苷酶(R=0.82,P<0.01)、过氧化氢酶(R=0.66,P<0.05)活性均显著正相关;DON与过氧化氢酶活性(R=0.58,P<0.05)显著正相关,与脲酶活性(R=-0.97,P<0.01)呈极显著负相关关系。此外,本研究发现所选样地的林下植被多样性与各因子之间均无相关关系。
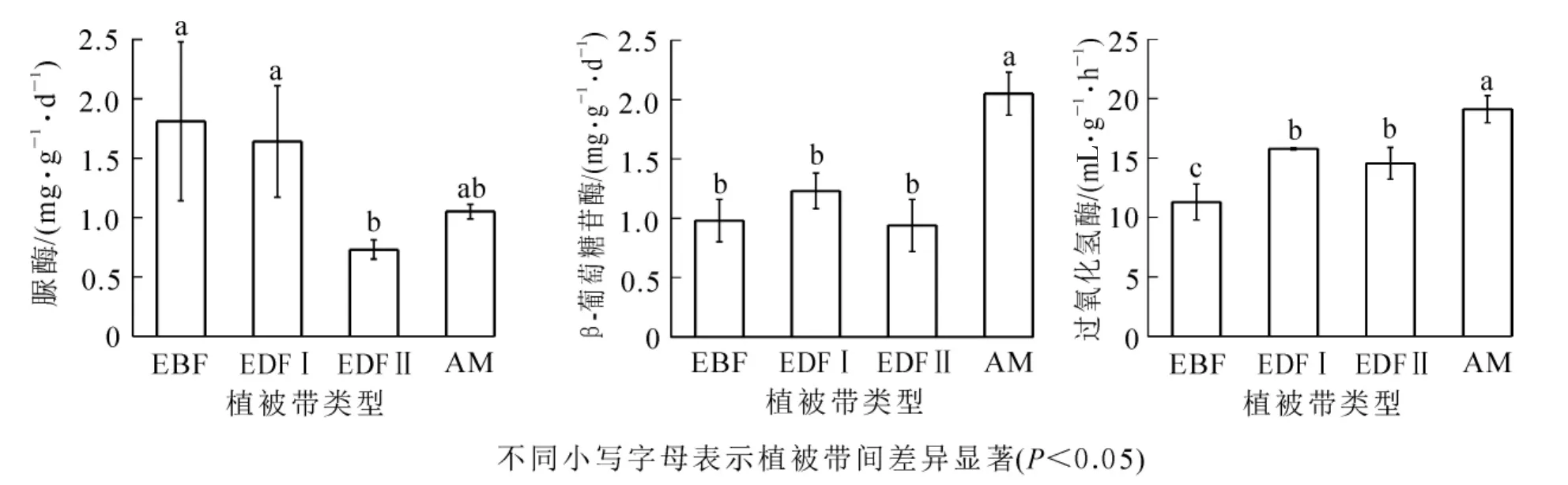
图1 黄山不同海拔植被带土壤酶活性Figure 1 Soil enzyme activities in different vegetation zones along an altitudinal gradient on Mount Huangshan
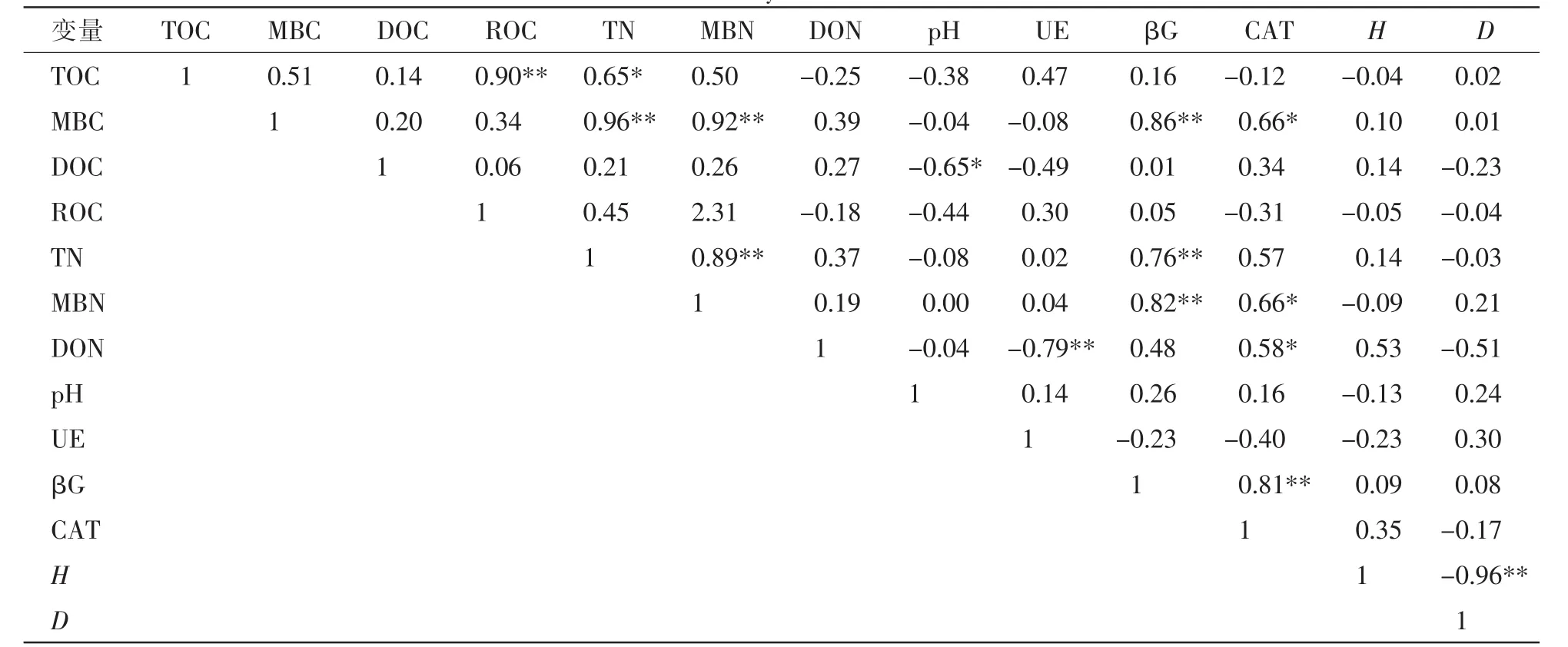
表4 环境变量的Pearson相关分析Table 4 Pearson correlation analysis between environmental variables
以土壤酶活性作为响应变量,活性有机碳、氮组分作为解释变量,并结合不同海拔植被带样点进行RDA分析。由图2可知:土壤酶活性与活性有机碳、氮组分关系显著,可以解释86.96%的变异,其中第1轴解释了75.11%的变异,第2轴解释了11.85%的变异。从各酶活性与环境因子夹角可知,土壤脲酶与DON有很强的负相关性,过氧化氢酶与DOC以及β-葡萄糖苷酶与MBC,MBN均有很强的正相关性,这基本上与相关性检验结果一致。蒙特卡罗检验结果显示:仅DON对于土壤酶的分布的影响达到显著水平(r2=0.6957,P=0.006),土壤活性有机碳氮组分对土壤酶分布的决定系数从大到小依次为DON,MBC,DOC,MBN和ROC。
3 讨论
3.1 不同海拔植被带土壤碳氮及其活性组分特征
黄山较高海拔土壤TOC及其活性组分质量分数高于较低海拔,且存在较明显的海拔植被带差异。可能的原因是随着海拔高度增加,温度降低,土壤微生物活性降低,从而导致土壤TOC释放速率降低[19]。孙海燕等[20]研究也证明:海拔较高的高寒草甸群落内的杂类草物种数目和盖度较低,温度较低且湿度较高,因此有机质的分解速率较慢,土壤活性有机碳含量相对较高。有机氮通过氨化和硝化作用由细菌转化为氨、硝酸盐或亚硝酸盐,变化的气象条件(温度和湿度)将改变细菌的氨化和硝化能力,因此DON沉积与温度和降水密切相关[21];随着海拔升高,气温下降,降雨量增大[20],因此本研究1760 m高山草甸的土壤氮素及其活性组分的质量分数相较于其他海拔植被带最高。DOC和DON主要来源于土壤有机质、根系分泌物以及微生物代谢产物,林分类型也通过这些过程影响土壤DOC和DON及其动态[22]。TU等[23]研究也证明:DOC主要来源于表层土壤中的凋落物,且DOC的主要来源可能随周围环境的变化而改变。凋落物数量、种类和化学组分是影响表土DOC和DON的主要因素[24]。不同植物种类对养分的需求不同,产生的凋落物数量和质量也不同,从而影响微生物种群和多样性,进而影响土壤微生物生物量和微生物碳的利用效率[5]。因此,植被类型是导致黄山不同海拔植被带土壤MBC,DOC和MBN质量分数存在极显著差异的重要因素,而海拔梯度所造成的温度与水分差异也对土壤MBC,DOC和MBN质量分数的海拔植被带差异具有重要贡献。
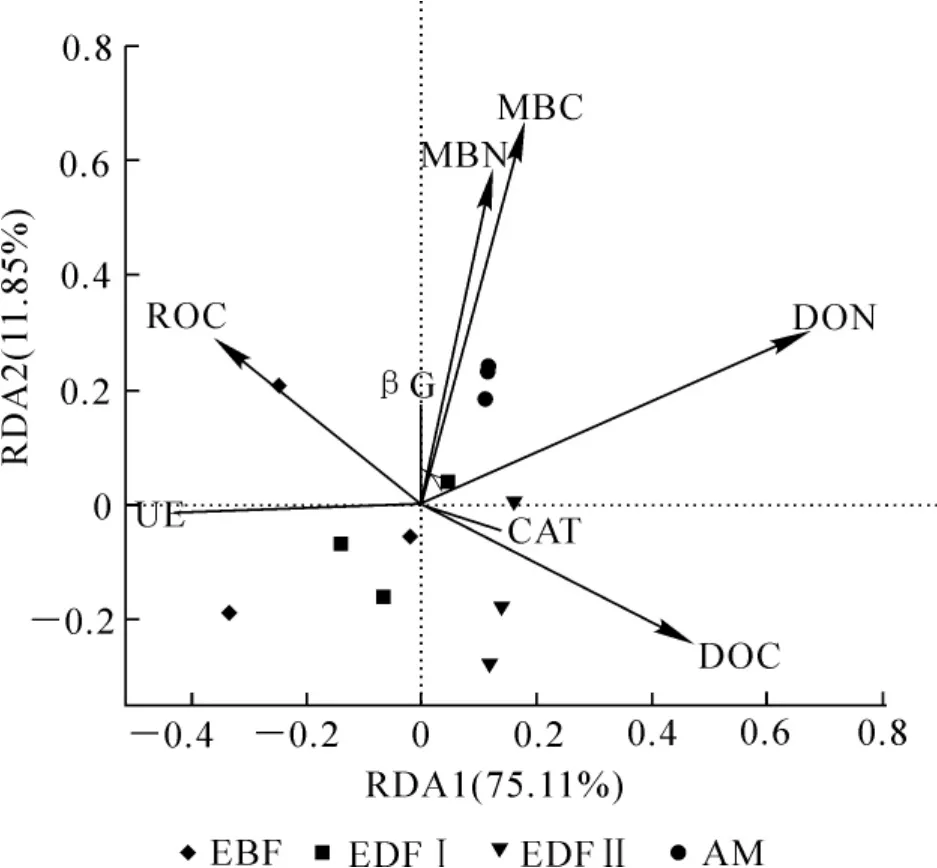
图2 土壤酶活性与土壤活性有机碳氮组分的冗余分析Figure 2 Redundancy analysis(RDA)of the enzyme activities and soil labile organic carbon and nitrogen fractions
3.2 不同海拔植被带土壤活性有机质分配比例情况
土壤微生物熵(MBC/TOC)是监测土壤有机碳或微生物生物量的敏感参数,可解释为土壤有效底物和固定在微生物细胞中土壤总碳的比例[18],比MBC更能反映植被类型对土壤有机碳的影响[5]。本研究中高山草甸的土壤微生物熵以及MBN/TN明显高于其他植被带,说明高山草甸土碳库处于积累状态,微生物对土壤氮库的利用效率较高,土壤氮素矿化和有效性也较高。ROC分配比例从有机碳自身分解方面指示有机碳活性强度,该比值越大则土壤有机碳被分解矿化的潜力越大[25]。土壤DOC/TOC比DOC更能反映林分类型对土壤碳的影响,其比值越大,说明土壤碳活性越强,稳定性越差[22]。本研究中常绿阔叶林的DOC分配比例最小,且ROC分配比例最大,说明低海拔常绿阔叶林土壤有机碳稳定性较差,不利于土壤碳的积累。DON质量分数可以影响土壤总氮的动态,较高的DON/TN说明通过淋溶作用而损失氮的可能性越大,从而影响氮的积累速率[26]。本研究结果显示:不同海拔植被带的DON/TN(1.41%~2.32%)无显著差异,可能是因为黄山地处亚热带季风气候带[13],夏季(采样时间为7月)高温多雨,淋溶作用较强。
3.3 不同海拔植被带土壤酶活性特征及各因子之间的关系
β-葡萄糖苷酶与土壤活性碳循环相关[28];脲酶对含氮有机质的水解有特殊的促进作用,与土壤中氮的形成和有效性密切相关[29];过氧化氢酶能使代谢过程中产生的过氧化物分解,从而防止其对生物体的毒性作用,其活性与土壤有机质含量相关[17]。本研究发现:随着海拔升高,土壤β-葡萄糖苷酶和过氧化氢酶活性总体上呈增强趋势,而脲酶活性总体上呈减弱趋势,该研究结果与聂阳意等[27]和宋贤冲等[28]的研究结果一致,说明高海拔土壤微生物可能更多地分解活性碳,更有利于土壤有机碳、氮的积累。本研究中DON显著影响黄山不同海拔植被带土壤酶活性分布。YANG等[29]研究发现:土壤酶活性可以作为温带森林生态系统土壤溶解性有机氮库的潜在指标。REN等[11]的研究也证明:土壤酶活性与土壤养分动态密切相关,尤其是DON。β-葡萄糖苷酶促作用产物是微生物的营养源,过氧化氢酶活性与微生物数量相关[17],因此MBC,MBN与这2种酶活性显著正相关。
除ROC外,本研究发现TOC与其他有机碳活性组分均无显著关系,究其原因是土壤有机碳活性组分对环境变化极为敏感,各组分变化难以完全与土壤有机碳变化保持一致,土壤有机碳活性组分的变化受到诸多因素的共同制约,因此需充分考虑其影响因素的复杂性及多样性[26]。土壤溶解性有机质(DOC和DON)主要由高分子和电解质组成,其溶解度由电荷密度决定,而土壤pH值是电荷密度的决定因素[22]。此外,在酸性土壤中,微生物种类受限于以真菌为基础的环境,从而导致有机体和植物体分解缓慢,土壤有机质含量降低[2]。因此,土壤DOC与pH值呈显著负相关。已有研究证明:植被多样性指数可能是影响土壤活性有机碳垂直分异的关键因子,而不是影响土壤活性有机碳沿海拔梯度分异的关键因子[20]。本研究中不同海拔植被带土壤活性有机碳与林下植被多样性之间无明显相关关系,但是未涉及土层作用,因此黄山土壤活性有机碳库与植被多样性之间的关系有待进一步研究。
4 结论
除ROC外,黄山较高海拔土壤TOC,TN及其活性组分质量分数总体上高于较低海拔,且存在比较明显的海拔植被带差异。相较于其他植被带,高山草甸的土壤TOC,TN及其活性组分质量分数均较高,MBC及MBN的分配比例也较高。低海拔常绿阔叶林土壤DOC/TOC最小,ROC/TOC最大,土壤有机碳库稳定性较差。土壤DON的分配比例整体较高且无明显海拔分异。随着海拔升高,脲酶活性总体上呈减弱趋势,β-葡萄糖苷酶和过氧化氢酶活性总体上呈增强趋势。土壤活性碳、氮组分与TOC和TN质量分数、pH值及酶活性密切相关。土壤活性碳氮组分中DON显著影响土壤酶的分布。植被类型直接或间接地影响黄山土壤碳氮及其活性组分海拔分布,因此加强对地表凋落物的科学管理,对改善森林土壤碳库以及保护区土壤管理具有重要意义。

