金樱子总多酚降脂作用
李 娜,陈 倩,刘赫男,裴 刚,何桂霞∗
(1.湖南中医药大学药学院,湖南 长沙410208;2.湖南中医药大学第二附属医院,湖南 长沙410005)
随着全球经济的快速发展和人们生活水平的提高,肥胖现已成为当今社会的一种常见和多发性疾病。由于发病原因的多样性以及发病机制的复杂性,使得肥胖成为世界卫生组织确定的疑难性疾病之一,寻找到一种具有高效的减肥降脂作用的药物成为医学界的共同愿望,同时开发具有减肥降脂作用的食品药品,对提高肥胖人群的生活质量,保护人体健康具有重要意义。
肥胖是指机体能量摄入超过能量消耗导致机体内脂肪堆积过多及分泌异常所致的一种常见的慢性代谢性疾病[1]。脂肪组织在肥胖相关代谢综合征的发展中发挥主要作用,它不仅是机体的能量贮存器官,调节能量代谢平衡,还是产生促炎细胞因子的重要场所,常见的促炎细胞因子有肿瘤坏死因子α(TNF-α)、C 反应蛋白(CRP)和白介素6(IL-6)等,最终诱发慢性炎症,因此有学者称,肥胖是一种低度的炎症状态[2-4],且相关研究表明,其炎性细胞因子正是由脂肪组织内的巨噬细胞产生[5-7]。
金樱子Rosa laevigataMichx.为蔷薇科蔷薇属植物,是一种药食同源的植物果实,含有黄酮、多酚、多糖等活性物质,具有抗氧化、抑菌消炎、抗肿瘤、抗病毒、免疫调节、降糖降脂等多种药理作用[8-10]。现代的一些研究表明,许多疾病的发生都与人体内存在过剩的自由基相关,比如某些药物具有良好的降血脂作用,其作用机制可能与增强机体抗氧化能力有关,多酚由于其含有的羟基取代具有吞噬自由基的能力,而具有很好的抗氧化活性[11-12]。近年来,代谢性炎症被认为在营养过剩导致肥胖等发生过程中起重要作用,大量研究也已证实多酚类物质具有很好的减肥降脂的作用[13-17]。因此,本研究以金樱子多酚提取物对抗氧化、营养性肥胖小鼠的减肥降脂作用及巨噬细胞的炎症作用等方面进行研究,初步探讨金樱子减肥降脂活性的机理。
1 材料
1.1 细胞株、动物 KM 雄性小鼠(清洁级,5周龄,体质量15~18 g,由湖南斯莱克景达实验动物中心提供,使用许可证号SYXK(湘)2013-0005。RAW264.7细胞株购自上海中国科学院细胞库。
1.2 试药 金樱子药材购于湖南省长沙市药房,经湖南中医药大学中药鉴定教研室肖冰梅教授鉴定为蔷薇科蔷薇属植物金樱子的干燥果实,40 ℃烘干备用;DPPH(批号217-591-8,东京化成工业株式会社);抗坏血酸(Vc)(批号B21293,上海市源叶生物科技有限公司)。GLU 试剂盒、TG 试剂盒、LDL 试剂盒、HDL 试剂盒(上海钰博生物科技有限公司);96孔板、细胞培养皿(上海晶安生物科技有限公司);胰蛋白酶(美国Sigma 公司)、LPS(美国Sigma 公司)、NO 试剂盒(批号S0023,上海碧云天生物技术有限公司)。普通饲料(脂肪占10% 热卡)、高级饲料(脂肪占60%热卡);高脂饲料配方为普通饲料65%、蛋黄粉10%、奶粉5%、猪油13%、蔗糖5%、食盐(湖南斯莱克景达实验动物有限公司提供)。
1.3 仪器 TP5102电子天平(上海光正医疗有限公司);AZ210分析天平(日本岛津公司);RE-52AA 旋转蒸发仪(上海亚荣生化仪器厂);SHz-D(Ⅲ)循环水式真空系(巩义市予华仪器有限责任公司);DHG-9145A 电热恒温鼓风干燥箱(上海一亘科技有限公司);超声波清洗机(宁波新芝生物科技股份有限公司);TU-1900双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);FRESCO 17冷冻高速离心机(美国Thermo 公司);ELx800酶标仪(美国Biotek 公司);-80 ℃超低温冰箱(美菱公司)。
2 方法
2.1 金樱子总多酚提取物制备及含有量测定 金樱子样品加入70%的乙醇溶液冷浸提取,提取液浓缩至小体积,加入NaOH 溶液调pH 为10左右,静置过夜,离心,去掉不溶杂质,加HCl 溶液,调pH 约为2,用等体积乙酸乙酯反复萃取,取乙酸乙酯层,回收溶剂,得到多酚浸膏。以没食子酸为对照品,用Folin-Ciocalteu(F-C)法测定金樱子总多酚含量为33.16%。
2.2 体内降脂药效
2.2.1 造模、分组及给药 小鼠正常水食适应性喂养3 d后,将33只KM 雄性小鼠称定质量标记后,随机分为正常组、模型组、给药组,每组11只。第1到22天正常组喂养普通饲料,模型组和给药组喂养高脂饲料,服用方式都通过自由进食;第23到44天,模型组和给药组均停止喂食高脂饲料,改为普通饲料,给药组加喂金樱子多酚提取物。
2.2.2 指标测定 每天定时记录小鼠摄食量和饮水量,每周定时记录体质量1次,观察小鼠饮食、活动和粪便等一般情况。实验结束后(第44天),禁食12 h 后,采用断头方法处死动物,收集全血,静置2 h,离心15 min 后分离血清;快速液氮冻存,血样-80 ℃冰箱保存待测。分别对小鼠血清中GLU、TG、LDL 及HDL 测定。按试剂盒要求的测定条件和程序测定,以浓度为横坐标,OD 值为纵坐标建立标准曲线,通过检测OD 值计算样品浓度。
2.3 体外抗氧化
2.3.1 供试品溶液制备 精密称取金樱子多酚提取物10 mg,置于10 mL 量瓶中,加入无水乙醇,并定容至刻度,再分别吸取0.4、0.8、1.2、1.6、2.0、2.4 mL 样品溶液置于5 mL 量瓶中,定容至刻度,将浓度分别配置成0.08、0.16、0.24、0.32、0.40、0.48 mg/mL。
2.3.2 清除率测定 精密量取不同浓度的样品溶液0.5 mL,分别加入0.004%的DPPH 溶液2.5 mL,摇匀,避光放置20 min 后在波长517 nm 测定吸光度Ai;以等体积70%乙醇代替供试品溶液,同法操作测定吸光度A0;以等体积70%乙醇代替DPPH 溶液,同法操作测定吸光度Ai0,以抗坏血酸(Vc)为阳性对照,质量浓度分别设置为0.08、0.16、0.24、0.32、0.40、0.48 mg/mL,平行测量3次,结果取平均值,DPPH 清除率=[1-(Ai-A0)/A0]×100%。
2.4 体外细胞抗炎活性
2.4.1 供试品溶液制备 取“2.1”项制备好的金樱子多酚,用二甲基亚砜(DMSO)配置成50 mg/mL 贮备液,加药时用无血清DMEM 培养基稀释成50 μg/mL 的供试品药液。
2.4.2 细胞培养 RAW264.7细胞用高糖DMEM 培养基(含10%胎牛血清、100 U/mL 青霉素及100 mg/L 链霉素)于细胞培养箱(37 ℃、5%CO2)内培养,待细胞生长至对数生长期进行传代并进行分组实验。
2.4.3 金樱子总多酚对RAW264.7细胞生长的影响 采用CKK-8法检测。按1×105/孔细胞接种RAW264.7细胞于96孔板,实验分为10组。正常对照组,细胞用终浓度含有0.5%DMSO 的培养基处理;给药组,分别用0.006 25、0.012 5、0.025、0.05、0.1、0.2、0.4、0.8、1.6 mg/mL的金樱子总多酚药物处理;空白对照组,加无细胞的0.5%DMSO 培养基处理,每组设6个复孔。以上细胞孵育24 h后,用PBS 清洗2次,每孔先加新鲜培养基100 μL,再加CCK-8溶液10 μL,37 ℃培养箱内孵育1 h。在450 nm 处测量吸光度A值。细胞存活率=[(A实验-A空白)/(A正常-A空白)]×100%。
2.4.4 金樱子总多酚对LPS 干预的RAW264.7细胞中NO的影响 培养的RAW264.7细胞以1×105/孔种于96孔板。实验分为6组,正常组,用终浓度含有0.5%DMSO 的培养基处理48 h;模型组,先用终浓度200 ng/mL LPS 处理24 h,再用终浓度含有0.5%DMSO 的培养基处理24 h;给药组分为4组,都先用终浓度200 ng/mL LPS 处理24 h,后再分别用0.006 25、0.012 5、0.025、0.05 mg/mL 的金樱子总多酚药物处理24 h,每组设6个平行复孔,取细胞培养上清液,依照NO 试剂盒的操作步骤进行,37 ℃培养箱内孵育1 h,在540 nm 处测量吸光度A 值,检测培养细胞上清液中NO 浓度。
2.5 统计学分析 采用SPSS 17.0软件进行处理,数据以()表示。多组间比较用单因素方差分析,2组间用t检验,P<0.05差异有统计学意义。
3 结果
3.1 金樱子总多酚对肥胖小鼠的体质量的影响 第0天时,正常组、模型组及给药组体重无显著性差别(P>0.05);第7天开始,模型组、给药组小鼠体质量明显高于正常组小鼠(P<0.01);第42天,与模型组比较,给药组小鼠体质量降低(P<0.01)。见表1。
表1 金樱子总多酚对肥胖小鼠的体质量的影响(, n=11)

表1 金樱子总多酚对肥胖小鼠的体质量的影响(, n=11)
注:与正常组比较,∗∗P<0.01;与模型组比较,##P<0.01
3.2 金樱子总多酚对肥胖小鼠GLU、TG、LDL 及HDL 水平的影响 给药42 d 后,与正常组比较,模型组小鼠血清中GLU、LDL-C 水平明显升高(P<0.05,P<0.01),HDLC 水平明显降低(P<0.05),TG 无显著性差异;与模型组比较,给药组能明显降低小鼠血清GLU、LDL-C(P<0.05,P<0.01)水平,升高HDL-C 水平(P<0.01)。见图1。

图1 金樱子总多酚对肥胖小鼠GLU、TG、LDL 及HDL 水平的影响
3.3 金樱子总多酚对DPPH 自由基的活性的影响 在0.08~0.48 mg/mL 浓度范围内,随着金樱子多酚的浓度增加,DPPH 的自由基清除率也增加,IC50约为0.25 mg/mL,金樱子多酚对DPPH 自由基有清除作用,但其清除能力弱于抗坏血酸。见表2。
3.4 金樱子总多酚对RAW264.7细胞存活率的影响 与正常组比较,金樱子总多酚浓度<0.05 mg/mL 细胞存活率无显著差别(P>0.05),金樱子总多酚浓度≥0.1 mg/mL 细胞存活率明显降低(P<0.01),说明金樱子总多酚质量浓度低于0.05 mg/mL 时,对巨噬细胞增殖不会产生影响。见表3。
表2 金樱子总多酚对DPPH 自由基的活性的影响(,n=3)
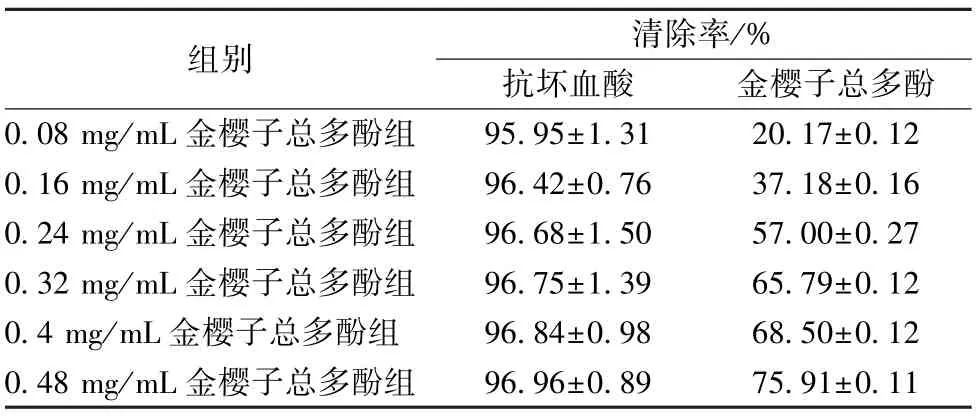
表2 金樱子总多酚对DPPH 自由基的活性的影响(,n=3)
表3 不同剂量金樱子总多酚对RAW264.7细胞存活率的影响结果(, n=6)

表3 不同剂量金樱子总多酚对RAW264.7细胞存活率的影响结果(, n=6)
注:与正常组(金樱子总多酚0 mg/mL)比较,∗∗P<0.01
3.5 金樱子总多酚对LPS 干预的RAW264.7细胞中NO 的影响 与正常组比较,模型组NO 浓度明显升高(P<0.01);与模型组比较,金樱子总多酚浓度≥0.012 5 NO 浓度显著降低(P<0.01)。见表4。
表4 金樱子总多酚对LPS 干预的RAW264.7细胞中NO的影响(, n=6)
注:与正常组比较,∗∗P<0.01;与模型组比较,##P<0.01
4 讨论
本实验以降血脂与抗氧化功能有关及肥胖是一种低度的炎症状态为依据,对药食两用植物金樱子多酚提取物对抗氧化、营养性肥胖小鼠的减肥降脂作用及巨噬细胞的炎症作用等方面进行相关研究。抗氧化活性研究中,在0.08~0.48 mg/mL 质量浓度范围内,随着金樱子多酚的质量浓度增加,对DPPH 的自由基清除率也随之增加,实验表明金樱子多酚提取物具有良好的抗氧化活性。在减肥降脂作用研究中,通过建立体外饮食诱导的小鼠肥胖模型,用金樱子多酚提取物进行干预,实验结果说明金樱子总多酚能降低小鼠体重、高脂小鼠血清的血糖浓度和LDL 浓度,升高高脂小鼠血清的HDL 浓度。在炎症反应研究中,通过体外建立炎性反应模型,用LPS 刺激RAW264.7巨噬细胞,表明金樱子总多酚能减轻巨噬细胞炎症反应。以金樱子多酚提取物分别做抗氧化、降脂和抗炎的研究只是提供了相关的理论基础,因此在今后的研究中会使用不同剂量组和增加其他模型等进一步探讨金樱子总多酚减肥降脂作用机理。

