响应面优化红毛藻多糖提取工艺及抗光氧化活性
张一非,陈艳红,2,3,4,伍 菱,2,3,4,姜泽东,2,3,4,黄高凌,2,3,4,朱艳冰,2,3,4,倪 辉,2,3,4,李清彪,2,3,4
( 1.集美大学 食品与生物工程学院,福建 厦门 361021; 2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021; 3.厦门南方海洋研究中心经济海藻资源化利用重点实验室,福建 厦门 361021; 4.厦门市食品生物工程技术研究中心,福建 厦门 361021 )
红毛藻(Bangiafusco-purpurea)又称红毛菜、红发菜等,属红藻门、红毛菜纲、红毛菜目[1],是我国东南沿海海域独有的珍贵经济海藻,福建省莆田市南日岛海域是其主要产地之一。相关研究表明,红毛藻具有祛阴去火[2]和预防动脉粥状硬化[3]、心脑血管疾病[4]等食药用功效,深受东南沿海地区人们的喜爱。研究表明,红毛藻中总糖含量占27%[5-6]。孙惠洁[7]研究发现,红毛藻多糖能够清除DPPH自由基,表明其具有体外抗氧化活性。宋田源等[8]研究表明,红毛藻多糖具有抑制血管紧张素转换酶活性,具有潜在的降血压功效。余刚等[9]研究表明,红毛藻多糖能够诱导小鼠巨噬细胞RAW264.7活化,释放一氧化氮和肿瘤坏死因子,具有潜在的免疫诱导活性。这些有益的生物活性使红毛藻多糖在生物医药、特殊膳食食品、功能性食品等领域具有的良好的应用价值和开发前景。
目前,多糖的分离一般采用沉淀法,利用大多数多糖在有机溶剂中的溶解度小的原理,向提取液中加入阳离子表面活性剂如乙醇或季胺盐类等,使水溶性多糖沉淀析出,但其特异性不高[7]。刘艳芳等[10]通过酶法辅助对毛头鬼伞(Coprinuscomatus)子实体粗多糖提取工艺进行改良,使其提取率得到显著提高;刘启顺等[11]筛选出纤维素酶、果胶酶和蛋白酶3种酶高效提取小球藻(Chorella)藻渣多糖,并采用正交试验对条件进行优化,使提取率得到显著提高。目前,关于红毛藻多糖提取工艺的研究鲜有报道。孙惠洁等[7]用物理方法(超声辅助提取法)优化了提取工艺,使红毛藻粗多糖提取率相比热水浸提法提高了38.39%。纤维素和果胶是细胞壁的主要成分,也是阻碍红毛藻细胞间质和胞内大分子物质溶出的主要因素,利用纤维素酶、果胶酶水解细胞壁可降低这种阻碍作用[12]。据此,本研究利用纤维素酶、果胶酶辅助提取红毛藻多糖,在考察不同酶和各工艺参数对多糖提取率影响的基础上,采用响应面法优化酶法辅助提取红毛藻多糖的工艺,为其规模化工业生产提供科学依据。此外,基于前期研究发现,红毛藻多糖具有潜在的抗氧化活性[7],在本研究中进一步利用人皮肤成纤维细胞抗光氧化模型分析其抗紫外损伤活性,为红毛藻多糖在抗紫外损伤生物医学敷料和护肤品领域的开发应用提供理论依据。
1 材料与方法
1.1 材料
新鲜红毛藻采集于福建莆田市南日岛海域;纤维素酶(来源于黑曲霉)(上海阿拉丁生化科技股份有限公司),果胶酶(来源于黑曲霉),100X青链双抗溶液(美国Sigma-Aldrich公司),人皮肤成纤维细胞(上海素尔生物科技有限公司),胎牛血清(FBS)(中国睿铂赛生物科技公司),高糖DMEM培养基(美国Hyclone公司);无水乙醇等试剂均为国产分析纯。
1.2 仪器设备
振荡培养箱(ZQZY-CF,上海知楚仪器有限公司),高速万能粉碎机(FW80,天津市泰斯特仪器有限公司),pH酸度计(FE20/EL20,梅特勒—托利多仪器(上海)有限公司),Free Zone 6 plus真空冷冻干燥机(美国Labconco公司),BioTek Cytation-5细胞成像多功能检测系统(美国伯腾仪器有限公司)。
1.3 试验设计
1.3.1 酶法辅助提取红毛藻多糖
红毛藻经水洗净、烘干、打粉、过筛后得红毛藻粉末。按料液比1∶20(m/V)将红毛藻藻粉与水混匀[13],加入纤维素酶(或果胶酶)(纤维素酶:2.00 U/mL;果胶酶:0.22 U/mL),于45 ℃水浴锅中酶解90 min。酶解液经热水(100 ℃)抽提2.0 h,冷却到室温,4000 r/min离心20 min弃藻渣。加入3倍体积乙醇搅拌,静置过夜,4000 r/min离心20 min,收集沉淀产物透析,冷冻干燥得红毛藻多糖。
1.3.2 单因素试验
固定条件:酶活性为纤维素酶,2.00 U/mL(或果胶酶,0.22 U/mL)[14];酶解温度50 ℃(果胶酶为45 ℃);酶解时间2.0 h(果胶酶为1.2 h);酶解pH为8.0(果胶酶为8.0)。改变单一因素,考察酶解pH、纤维素(果胶酶)酶活性、酶解时间、酶解温度对红毛藻多糖提取率的影响,试验结果取3次重复的平均值。按下式计算提取率:
提取率/%=m1/m×100%
式中,m1为红毛藻多糖粉末质量(g),m为红毛藻粉末质量(g)。
1.3.3 响应面试验设计
根据Box-Behnken中心组合试验设计原理,基于单因素试验结果,选取三因素三水平试验表1~2,利用Design-Expert 8.0.5软件进行工艺条件优化,试验结果取3次重复的平均值。
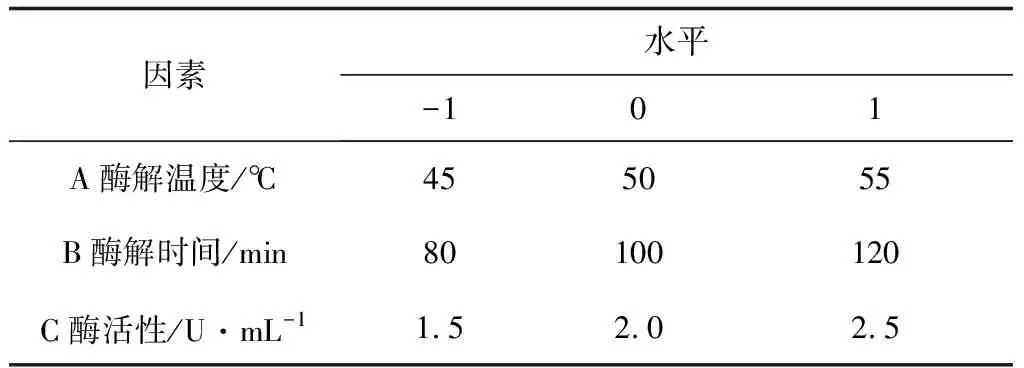
表1 Box-Behnken试验因素和水平(纤维素酶)

表2 Box-Behnken试验因素和水平(果胶酶)
1.4 红毛藻多糖的抗光氧化损伤活性分析
1.4.1 细胞培养
人皮肤成纤维细胞采用含10%胎牛血清、100 U/mL青霉素及100 μg/mL链霉素的高糖DMEM培养基,于37 ℃、5%CO2的细胞培养箱中培养[9]。
试验组:不同质量浓度(0、1、10、20、100、200 μg/mL)的红毛藻多糖;空白组:生长培养基。
试验组1与空白组1不经紫外线辐照,用于多糖对细胞活力影响的分析。
试验组2与空白组2经过紫外线辐照20 min,辐照强度16.20 J/cm2,用于抗光氧化活性分析。
对照组:生长培养基培养,不经紫外线照射。
1.4.2 红毛藻多糖对细胞活力影响及抗光氧化损伤活性分析
通过噻唑蓝法[15]测定红毛藻多糖对人皮肤成纤维细胞活力的影响。将处于对数生长时期的人皮肤成纤维细胞以3×104个/mL的密度接种于96孔细胞培养板,待细胞贴壁后,用不同质量浓度的多糖样品溶液(0~200 μg/mL)孵育2.0 h,除去上清液后,每孔加入终含量为5%的噻唑蓝—磷酸盐缓冲溶液50 μL,继续孵育30 min,移去上清液后,加入100 μL的二甲基亚砜,振荡20 min,于Cytation-5细胞成像多功能检测系统测量570 nm处吸光值(OD570)。按下式计算细胞活力。
式中,V为细胞活力,A为试验组OD570,B为空白组OD570,C为对照组OD570。
2 结果与分析
2.1 各因素对红毛藻多糖提取率的影响
2.1.1 pH的影响
酶解pH对红毛藻多糖提取率的影响见图1。pH为6.0~9.0时,随着pH的升高,纤维素酶辅助提取红毛藻多糖的提取率呈现下降的趋势,在pH为10.0时略有提高;果胶酶处理的红毛藻多糖提取率随pH的增大无显著变化,在pH为6.0时,提取率高于其他试验组且二者提取率接近。综上,将pH=6.0选为固定因素。
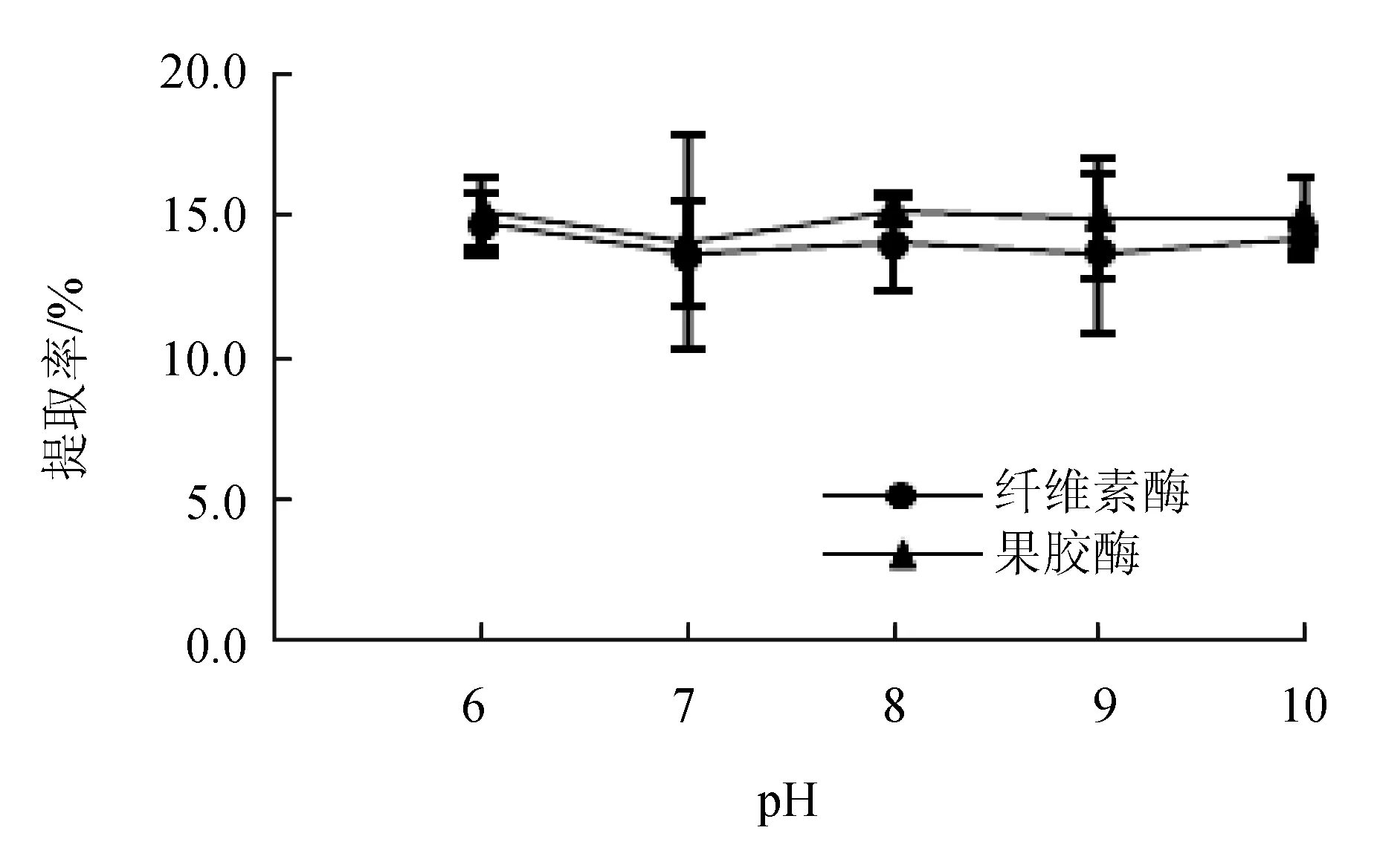
图1 pH对红毛藻多糖提取率的影响
2.1.2 酶活性的影响
纤维素酶和果胶酶的酶活性对红毛藻多糖提取率的影响见图2。纤维素酶活性在0~2.50 U/mL时,随酶活性增大,提取率升高,在酶活性达到2.50 U/mL时,提取率最高可达11.45%,活性超过2.50 U/mL时,提取率下降(图2a);果胶酶处理曲线趋势与纤维素酶相似,果胶酶活性在0.165 U/mL时的提取率最高,达到10.35%(图2b)。这是由于纤维素和果胶作为细胞壁的主要成分,在该反应体系中两种酶分别水解红毛藻细胞壁中的纤维素和果胶,仅使细胞壁被水解,而酶的活性升高可以使酶与藻粉的接触更充分,提升水解效率,由于底物与酶结合的位点有限[16],当酶活性过高时,底物质量浓度不够则会造成酶的浪费,故最佳的纤维素酶活性为2.50 U/mL,果胶酶活性为0.165 U/mL,且果胶酶催化效率高于纤维素酶。
2.1.3 酶解时间的影响
酶解时间对红毛藻多糖提取率的影响见图3。随着酶解时间的增加,提取率均呈现先升后降的趋势,而纤维素酶最佳酶解时间为100 min,果胶酶的最佳酶解时间为80 min。这是由于随着酶解时间延长细胞壁的纤维素或果胶成分逐渐被水解,多糖逐渐溶出,但由于纤维素酶和果胶酶也可水解红毛藻多糖中的糖苷键,导致分解作用加剧,提取率在接下来的一段时间内稍有下降[17]。
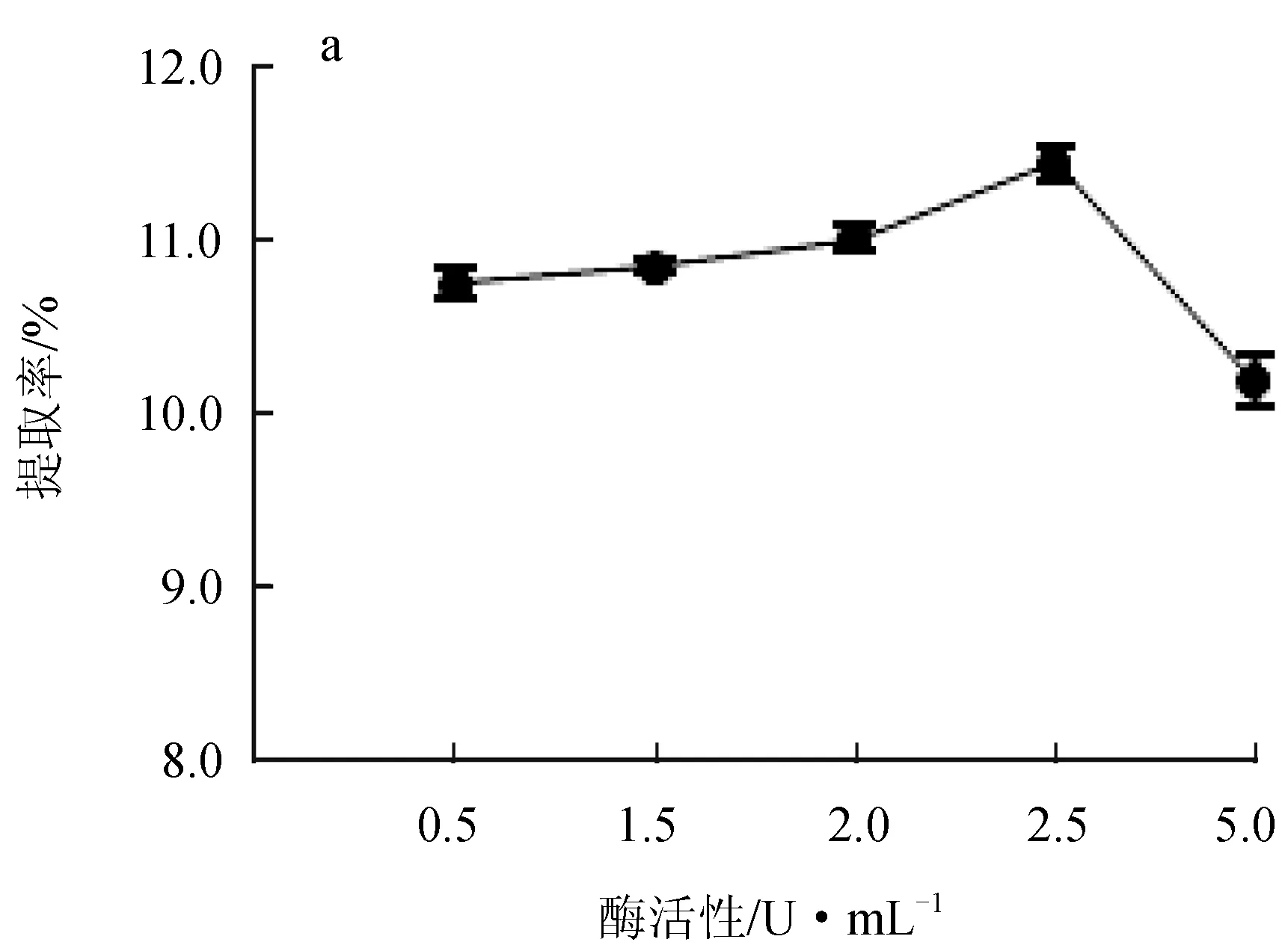
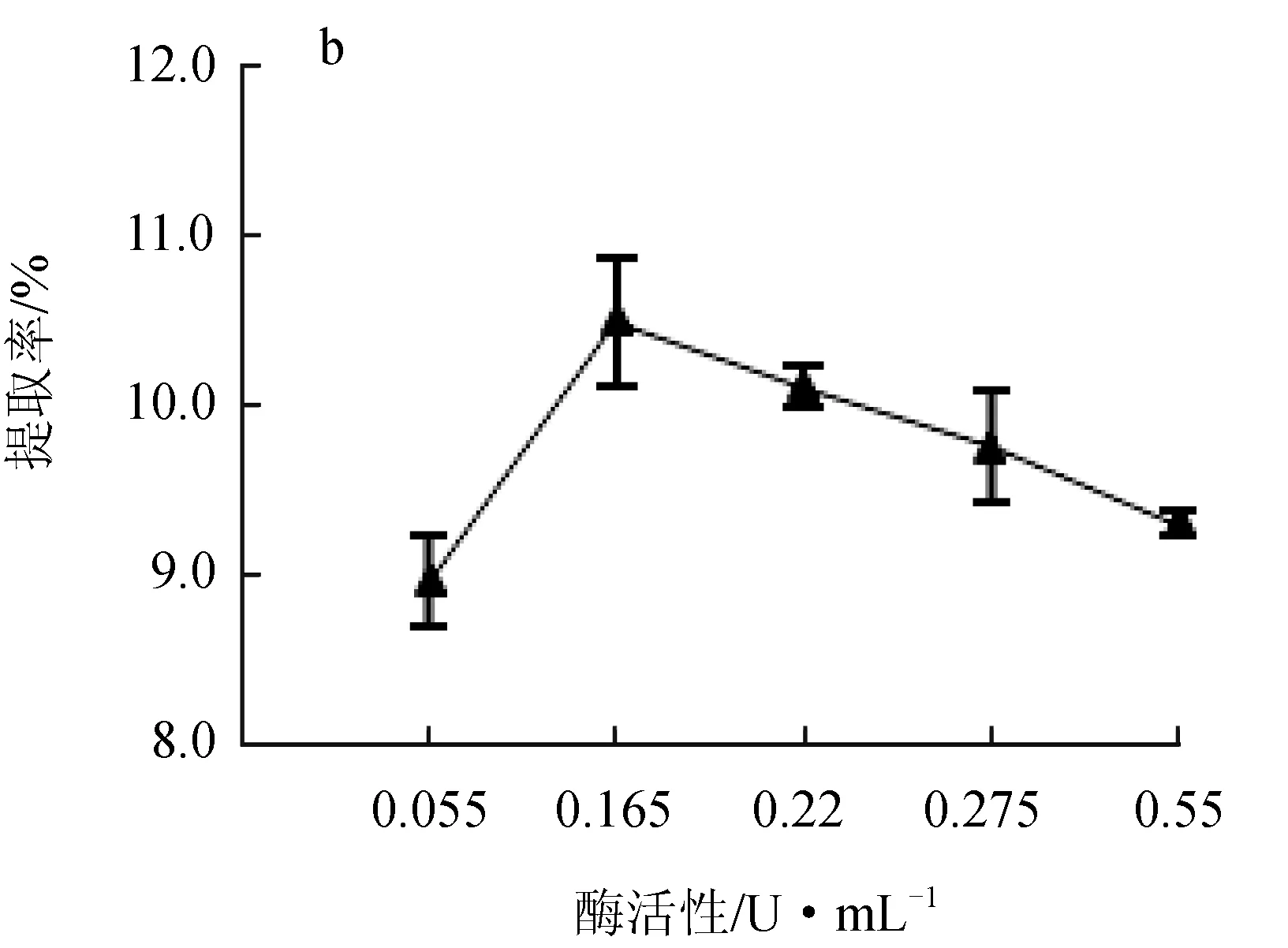
图2 纤维素酶活性(a)和果胶酶活性(b)对红毛藻多糖提取率的影响
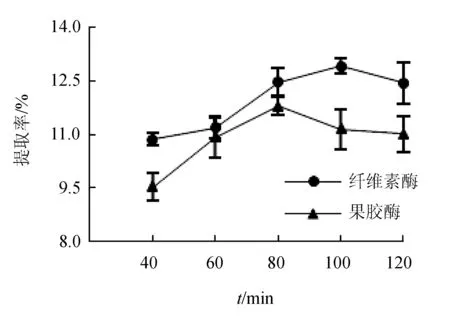
图3 酶解时间对红毛藻多糖提取率的影响
2.1.4 酶解温度的影响
酶解温度对红毛藻多糖提取率的影响见图4。结果表明,随着酶解温度的升高,提取率逐渐上升后突然下降,这是由于纤维素酶和果胶酶都存在一个最适温度即酶活性最高时的温度,在此温度下酶的催化效率最高,当温度较高时酶的稳定性降低,导致了酶活性下降,作用效率下降[16]。纤维素酶的适宜温度为45~65 ℃,果胶酶的适宜温度为20~70 ℃,以50 ℃效果最好,这与文献[18]利用果胶酶酶解果汁得到的优化结果一致。
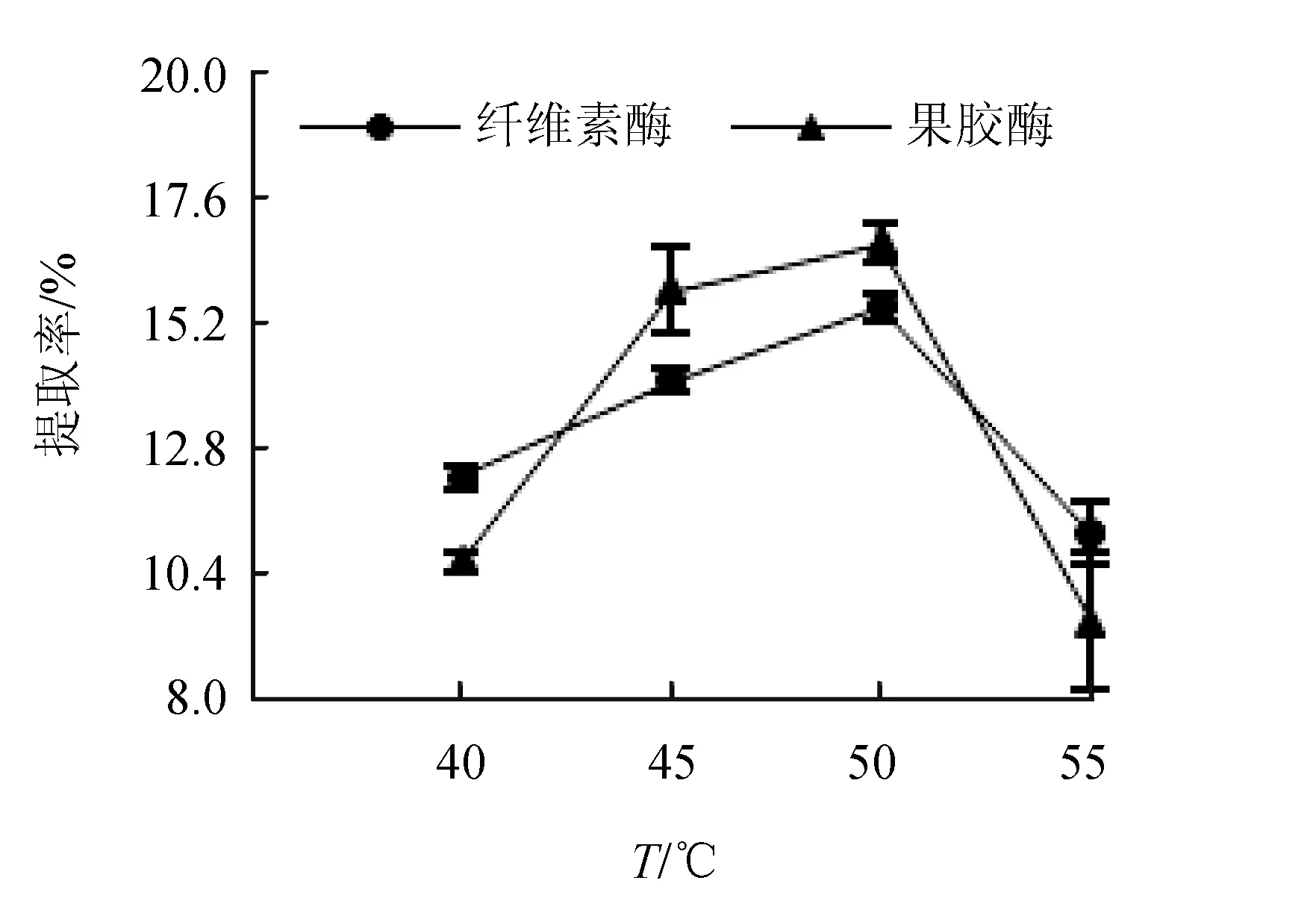
图4 酶解温度对红毛藻多糖提取率的影响
2.2 响应面试验结果
2.2.1 中心组合试验结果
考虑pH对红毛藻多糖水解的影响,故通过单因素试验选取pH=6.0作为固定因素,根据Box-Benhnken中心组合试验设计原理[19-21],选取的主要因素有酶解温度、酶解时间和酶活性,设计三因素三水平响应面分析试验,试验点共17个,其中分析因子12个,以及用于估计误差的零点5个[22]。以红毛藻多糖提取率作为响应值,进行酶辅助提取红毛藻多糖的工艺条件优化,试验方案及红毛藻多糖提取率见表3、4。
2.2.2 模型方差分析结果
根据表1、2的因素水平选取,参考表3、4结果,利用Design-Expert 8.0.5软件分析,结果见表5、6。由表5、6可见,两种酶试验所选模型均极显著(P<0.01),且果胶酶模型的纯误差不显著,纤维素酶模型的纯误差显著(失拟项P纤维素酶=0.0403,失拟项P果胶酶= 0.9262),纤维素酶模型拟合结果不理想。纤维素酶试验中一次项中酶解时间(B)对红毛藻多糖提取率影响最大;二次项中3个因素对红毛藻多糖提取率影响皆极显著(P<0.01);交互项中两两无显著影响,拟合效果不理想。果胶酶试验一次项中酶解温度(A)对红毛藻多糖提取率影响较大,达显著水平(P<0.05);二次项中酶解温度(A)、酶解时间(B)和酶活性(C)对红毛藻多糖提取率影响均极显著(P<0.01);交互项AC之间具有显著影响(P<0.05)。由此可知,响应值受各因素的影响并非线性关系,其影响程度为酶解温度>酶解时间>酶活性。采用Design-Expert 8.0.5软件对表5、6的数据进行分析,得如下回归方程:
Y纤维素酶=16.97+0.076A-0.55B+0.21C-0.51AB+0.38AC-0.11BC-4.65A2-4.84B2-3.68C2
Y果胶酶=16.72+0.37A-0.08B-0.067C+0.088AB-0.50AC+0.022BC-4.99A2-3.65B2-4.55C2
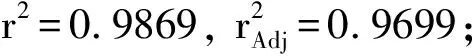
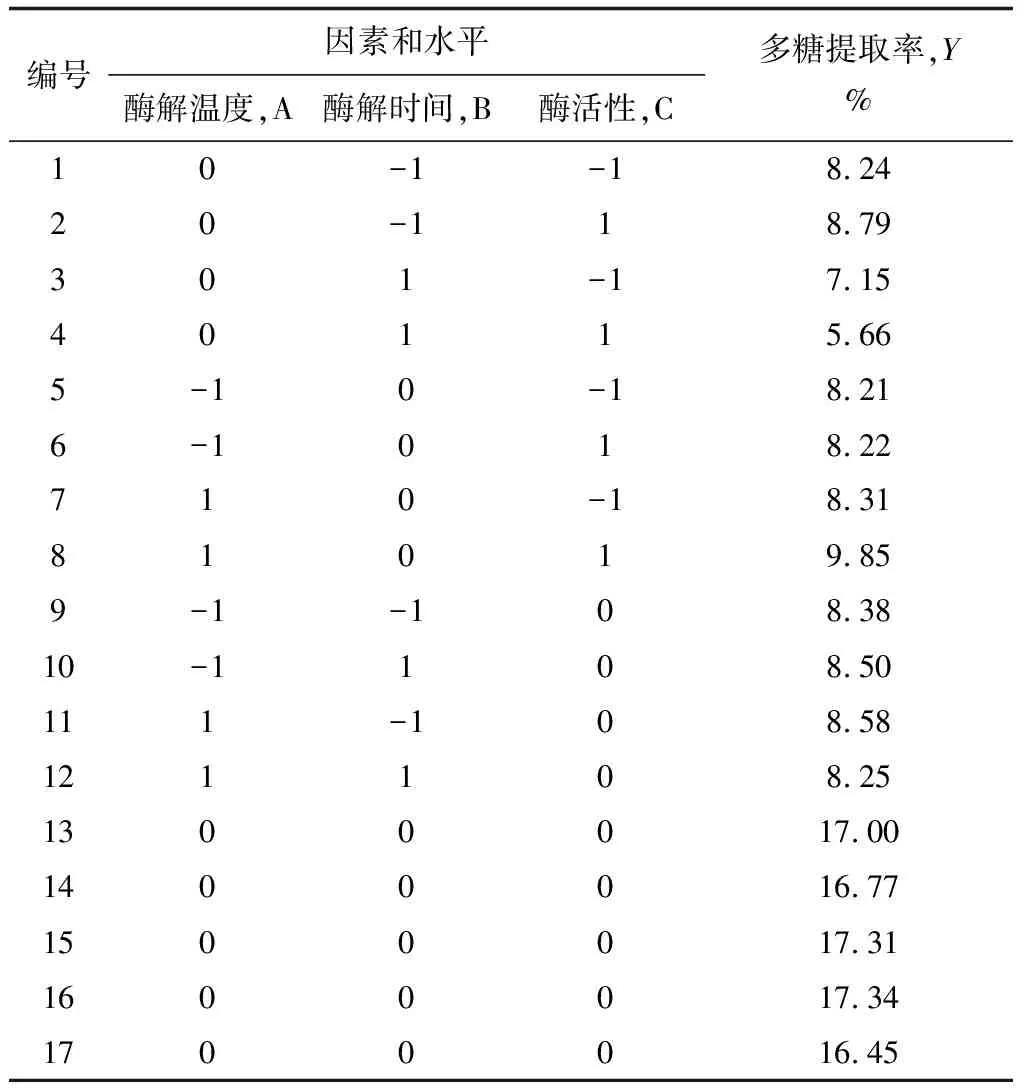
表3 纤维素酶Box-Behnken试验设计及结果
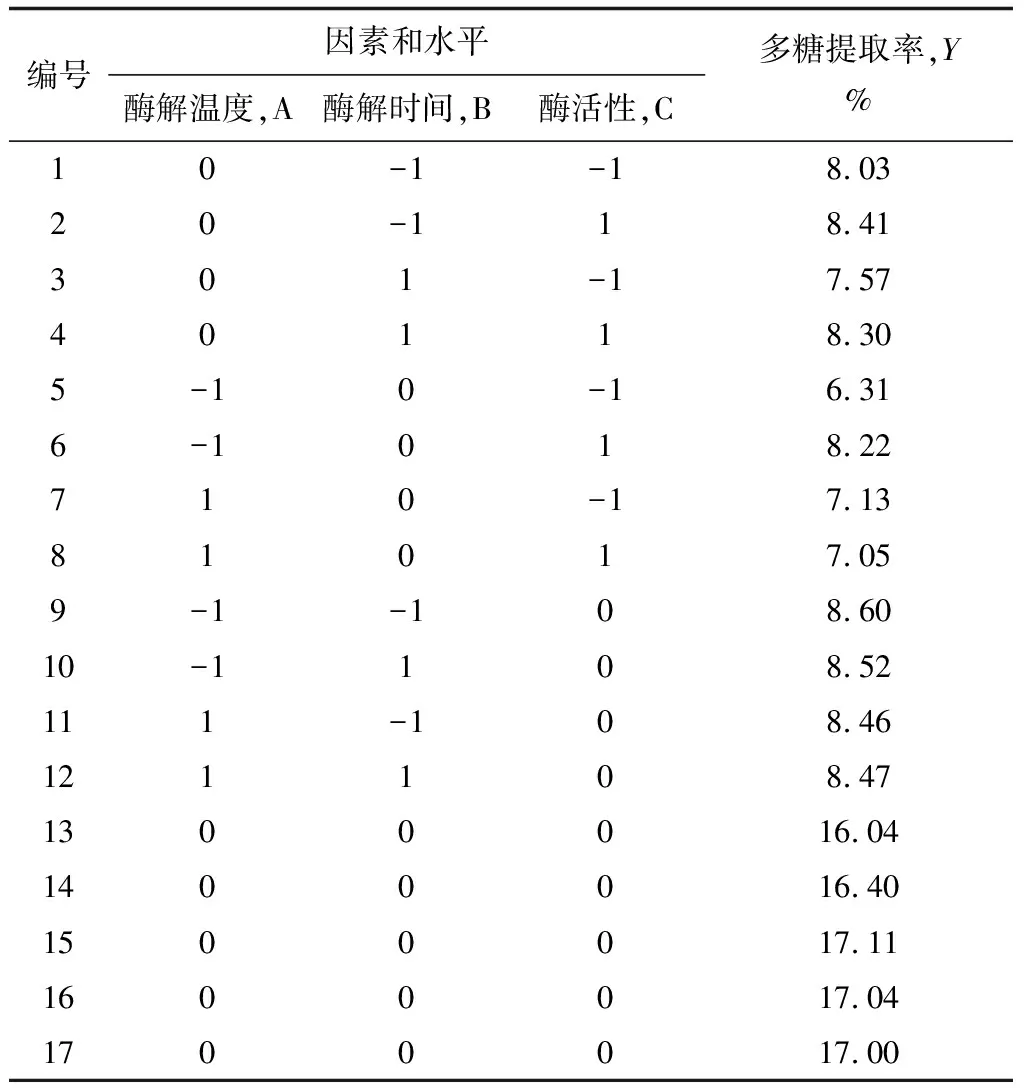
表4 果胶酶Box-Behnken试验设计及结果
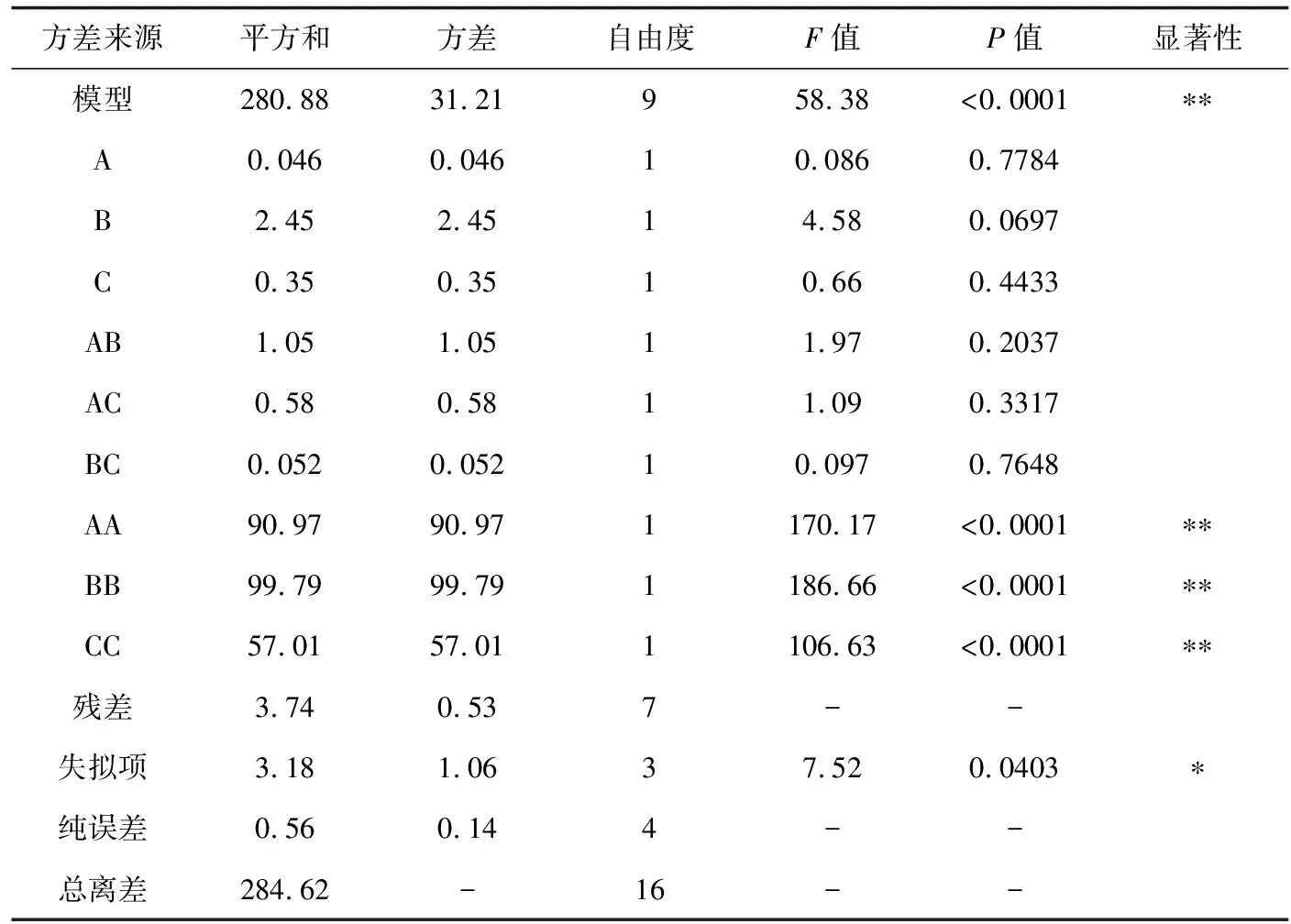
表5 纤维素酶回归模型方差分析
注:*显著影响(P<0.05);**极显著影响(P<0.01).下同.
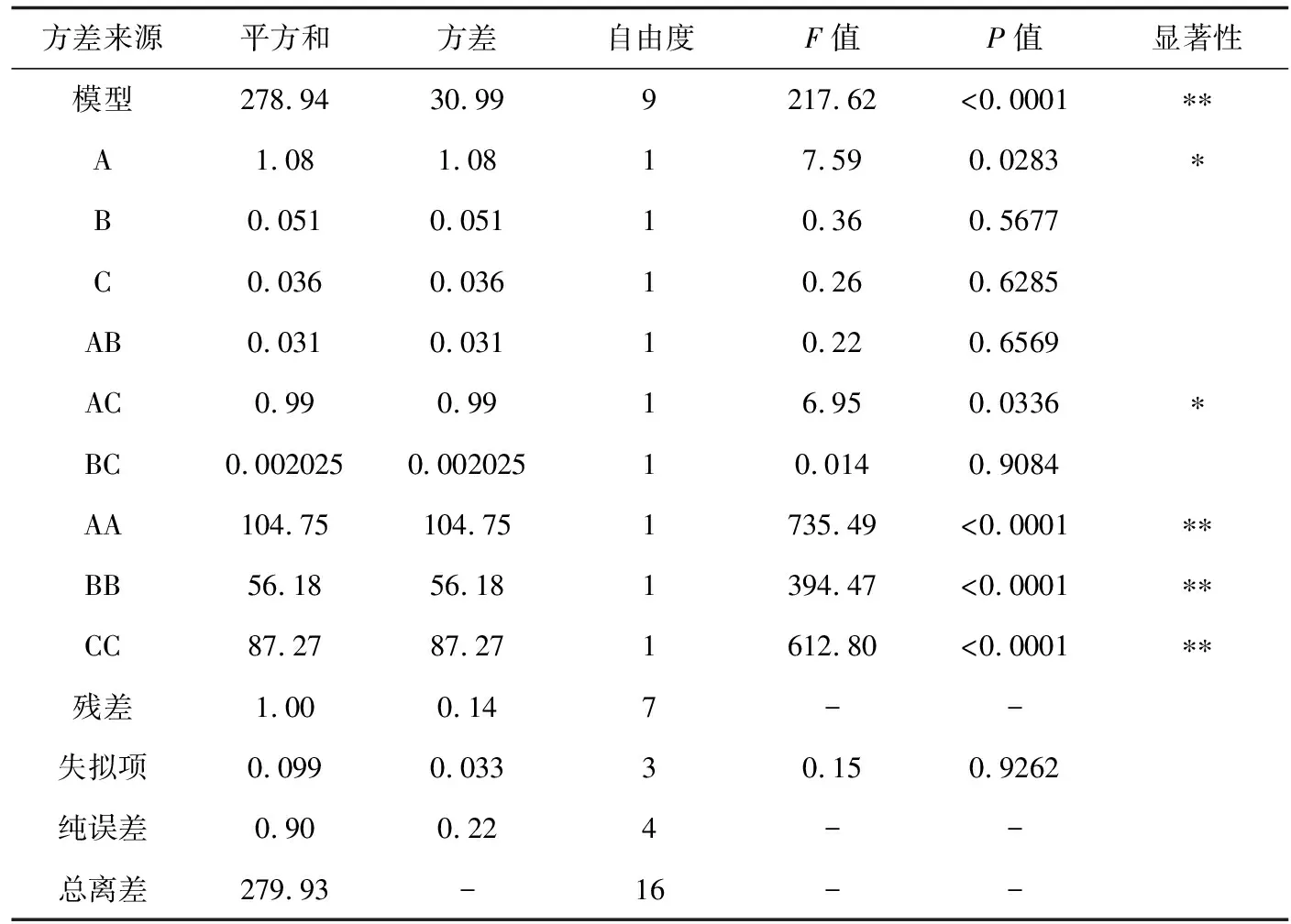
表6 果胶酶回归模型方差分析
2.2.3 响应面法优化结果
响应曲面三维图可以直观地反映各因素对响应值的影响程度和因素间的交互作用强弱。等高线的形状反映出交互作用影响效应的强弱与大小[24]。
纤维素酶辅助提取多糖的响应面优化结果见图5,其优化效果不明显,三因素之间的两两交互作用弱,故纤维素酶对红毛藻多糖提取的作用效果较差,以上结果与表5回归方程方差分析结果一致。
由图6等高线可见,当固定其中一个因素,提取率都会随另一因素的增大而增大,但增大到一个峰值后又开始缓慢下降[25]。固定酶活性为0.22 U/mL时,酶解温度(A)和酶解时间的(B)交互作用对红毛藻多糖提取率的影响与上文描述一致。响应面发生了弯曲,表明果胶酶活性(C)与酶解时间(B)对红毛藻多糖的影响不是简单的线性关系。比较图6a、c,发现酶解温度(A)与酶活性(C)的交互作用对多糖提取率的影响显著。由3D等高线图(图6d)可见,酶解时间(B)对红毛藻多糖提取率的影响大于酶活性(C)的影响,两个因素的交互作用不显著。以上结果与表5回归方程方差分析结果一致。
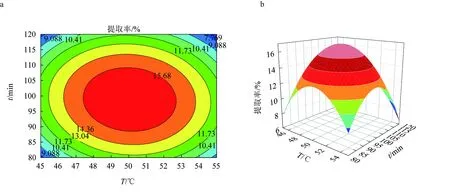
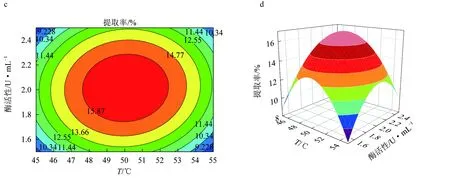

图5 纤维素酶辅助提取红毛藻多糖的响应面优化结果a.纤维素酶酶解温度和时间对提取率影响的响应曲面图; b.纤维素酶酶解温度和时间对提取率影响的等高线图; c.纤维素酶酶解温度和酶活性对提取率影响的响应曲面图; d.纤维素酶酶解温度和酶活性对提取率影响的等高线图; e.纤维素酶酶解时间和酶活性对提取率影响的响应曲面图; f.纤维素酶酶解时间和酶活性对提取率影响的等高线图.
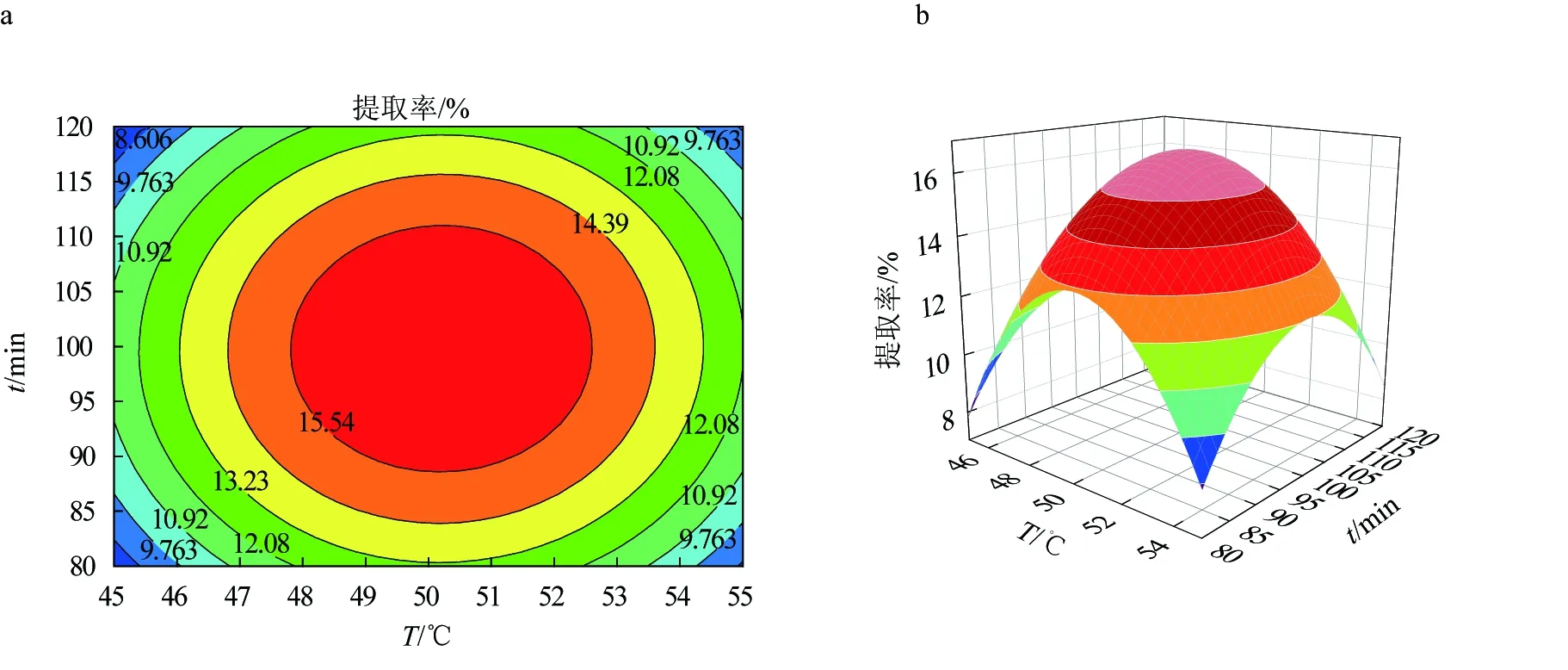
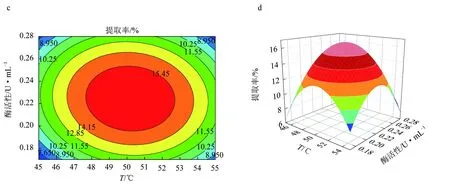
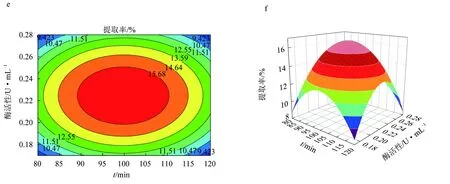
图6 果胶酶辅助提取红毛藻多糖的响应面优化结果a.果胶酶酶解温度和时间对提取率影响的响应曲面图; b.果胶酶酶解温度和时间对提取率影响的等高线图; c.果胶酶酶解温度和酶活性对提取率影响的响应曲面图; d.果胶酶酶解温度和酶活性对提取率影响的等高线图; e.果胶酶酶解时间和酶活性对提取率影响的响应曲面图; f.果胶酶酶解时间和酶活性对提取率影响的等高线图.
2.2.4 模型验证试验
用Design-Expert 8.0.5软件分析得出的最佳工艺为:选用果胶酶,酶活性0.22 U/mL、酶解时间99.78 min、酶解温度50.19 ℃。该条件下红毛藻多糖的最高提取率为16.72%。根据实际操作调整酶解时间为100 min,酶解温度为50 ℃,酶活性为0.22 U/mL,与中心组合试验的零点试验条件一致,得红毛藻多糖提取率为(16.60±0.13)%,与预测值的相对误差较小,表明回归模型与试验结果拟合程度高,回归方程能真实地反映酶解时间、酶解温度、酶活性对提取率的影响,该模型有可行性。
2.2.5 红毛藻多糖毒性及抗氧化活性
以未照射紫外线并且未添加红毛藻多糖的细胞活力为100%,在测试多糖质量浓度为1~100 μg/mL时,随着多糖质量浓度的升高,细胞活力无显著变化,表明多糖质量浓度为1~100 μg/mL时,对人皮肤成纤维细胞无显著毒性作用,当多糖质量浓度达到200 μg/mL时,对人皮肤成纤维细胞活力产生抑制作用(图7a)。参考文献[26]试验方法,16.20 J/cm2辐射20 min后人皮肤成纤维细胞活力为56.26%,接近50%。随着多糖质量浓度的升高,细胞活力逐渐上升,当多糖质量浓度为10~20 μg/mL时,细胞活力可恢复至96.53%~98.49%,表明红毛藻多糖具有抵抗人皮肤细胞光氧化紫外线损伤的能力,且多糖质量浓度为10~20 μg/mL时效果最佳(图7b)。
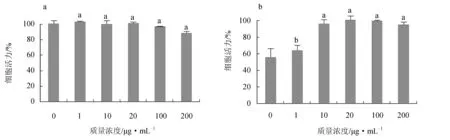
图7 不同质量浓度的红毛藻多糖对细胞毒性的影响(a)和对细胞抗光氧化活力的影响(b)不同字母表示差异显著(P<0.05).
3 讨 论
3.1 红毛藻多糖的提取工艺研究
近年来,随着海藻多糖优良的理化性质(如凝胶、乳化、保湿)和有益生物活性的逐渐发掘,海藻多糖被广泛应用于食品、生物医药和化妆品等领域,因此对多糖的高效提取工艺的研究与开发越来越受到关注。海藻多糖的提取通常采用机械粉碎藻体,对得到的藻粉中的多糖类物质进行热水抽提,继而通过利用多糖在有机溶剂中的溶解度小的原理,向抽提液中加入乙醇或季胺盐类等使多糖沉淀析出[7]。为提高多糖提取率,Rodriguez-Jasso等[27]利用微波提取法自褐藻中提取硫酸酯化多糖,与原始方法相比提取率提高了31.01%。孙惠洁[7]利用超声波辅助提取法提取红毛藻多糖的提取率为9.69%,比用热水提取红毛藻多糖的提取率高38.39%。周峙苗[28]利用纤维素酶辅助提取羊栖菜(Sargassumfusiforme)多糖,是热水浸提工艺的粗多糖得率的2.2倍,使其提取效率显著提高。纤维素和果胶是海藻细胞壁的主要成分,也是海藻细胞间质和胞内大分子物质溶出的主要屏障。因此,本研究分别利用纤维素酶和果胶酶辅助提取红毛藻多糖,经正交法考察各工艺参数以及响应面法优化红毛藻多糖的酶解工艺,由于纤维素酶提取效果不理想,选出果胶酶进行辅助提取,模拟得到最佳提取工艺为pH 6.0、酶活性0.22 U/mL、酶解时间100 min、酶解温度50 ℃,试验结果与热水浸提法相比提升了64.04%,与孙惠洁[7]利用物理方法辅助提取红毛藻多糖的提取率相比提升了41.62%。
3.2 红毛藻多糖的抗氧化生物活性
由于海藻多糖能够有效地抑制和清除自由基,海藻多糖的抗氧化活性被广泛研究。刘洪丽等[29]通过观察马尾藻(Sargassum)多糖对小鼠细胞内抗氧化能力的影响,得到马尾藻多糖能够有效清除羟自由基并且随着多糖质量浓度的增加,对抗过氧化氢溶血的能力有所提高。刘亮等[30]选取紫菜(Porphyra)多糖进行抗氧化作用研究,发现紫菜多糖能有效清除DPPH·和·OH,并且抑制小鼠肝组织的脂质过氧化,保护由于Fe2+和H2O2引起的肝组织损伤。红毛藻多糖具有潜在的降血压和抗氧化等作用。孙惠洁[7]利用DPPH法对红毛藻多糖的体外抗氧化进行初步的研究,发现经DEAE Cellulose-52得到3种红毛藻多糖片段均具有清除DPPH自由基的活性,随着多糖质量浓度的升高,对DPPH自由基的清除能力显著增强。本试验在红毛藻多糖体外抗氧化试验基础之上对其进行细胞抗氧化损伤研究,以紫外诱导人皮肤成纤维细胞的光氧化为模型,探究其红毛藻多糖对细胞作用效果。试验结果表明,10~20 μg/mL的红毛藻多糖能够使受到UVA损伤的人皮肤成纤维细胞活力恢复至初始状态的96.53%~98.49%,具有极强的防止紫外线氧化损伤效果,因此为红毛藻多糖在护肤品和抗紫外损伤的生物医学敷料中的开发和应用提供科学依据。
综上,本试验优化了红毛藻多糖的提取工艺,并初步揭示了其具有抵抗人皮肤细胞光氧化紫外损伤的活性,研究结果为进一步研究红毛藻多糖抗紫外光氧化损伤奠定研究基础,同时也为红毛藻多糖的工业化生产提供理论依据。
4 结 论
研究了酶辅助提取红毛藻多糖的最优条件,通过单因素试验、响应面法优化了红毛藻多糖提工艺,得到如下结论:
(1)酶辅助提取红毛藻多糖的优化工艺条件为:选用果胶酶,pH 6、酶活性0.22 U/mL、酶解时间100 min、酶解温度50 ℃。
(2)此优化条件下得到红毛藻多糖提取率为(16.60±0.13)%,与预测值(16.72%)的相对误差在允许范围内(0.12%),表明该模型拟合效果合理可靠。
(3) 红毛藻多糖在1~100 μg/mL时对人皮肤成纤维细胞无显著毒性作用,红毛藻多糖具有抵抗人皮肤成纤维细胞光氧化能力,当多糖质量浓度为10~20 μg/mL时细胞活力可恢复至96.53%~98.49%。

