裂褶菌液体菌种培养技术研究
马布平,李朝东,闻绍峰,曹 瑶,陈孟迪,罗祥英
(云南菌视界生物科技有限公司,云南 昆明 650200)
裂褶菌(Schizophyllum communeFr.),俗称白参,属于伞菌目(Agaricales) 裂褶菌科(Schizophyllaceae) 裂褶菌属 (Schizophyllum)[1]。野生资源分布广,食用价值高,但随着生活水平提高,野生裂褶菌的口感已不符合市场需求,人工栽培的裂褶菌在口感上得到很大的改善,且克服了子实体单生、细小的缺点。
国内裂褶菌相关研究始于20世纪80年代,历经二十多年。2006年,在福建省古田县实现了裂褶菌商业化栽培,发展速度慢[2]。2017年,本课题组进行了裂褶菌工厂化栽培技术研究,并取得一定成果,但相对于金针菇、杏鲍菇等成熟的工厂化栽培品种来看,裂褶菌工厂化栽培需要探索的内容还很多,首要急需解决的是液体菌种的生产。
近年来,裂褶菌多糖成为研究热点,在抗肿瘤、护肤等方面有所进展,也有相应的产品出现,比如抗肿瘤药物“Sizofiran”及护肤产品“IOPE”[3]。裂褶菌多糖主要是从发酵液中获得菌丝,利用热水法、超声波法实现多糖提取[4],而关于裂褶菌液体发酵的相关研究较少,无系统的介绍。通过本试验,希望可以为裂褶菌深层发酵提供一定的参考。
1 材料与方法
1.1 材料
试验材料:麦麸、黄豆粉、马铃薯、蛋白胨、磷酸二氢钾、硫酸镁、棉籽壳、麦麸、木屑、玉米粉、石灰;裂褶菌母种由云南菌视界生物科技有限公司保存。
主要仪器设备:发酵罐、pH计、摇床、灭菌锅、烘箱、游标卡尺、电子天平、锥形瓶等。
1.2 试验方法
1.2.1 裂褶菌种子液培养条件优化
1) 培养基筛选
种子液是液体菌种制备的关键,其菌丝活性及菌丝量直接关系到液体菌种质量。从前期不断试验得到的以下4个配方中筛选出适合裂褶菌菌丝生长的种子液,培养温度23℃,培养时间为4 d,接种时接种块大小统一为直径3.8 mm,接种量为10个。
马铃薯培养基:马铃薯 3%、葡萄糖 1.5%、KH2PO40.2%、MgSO40.15%;麦麸培养基:麦麸3%、葡萄糖 1.5%、KH2PO40.2%、MgSO40.15%;玉米粉培养基:玉米粉 3%、葡萄糖1.5%、KH2PO40.2%、MgSO40.15%;黄豆粉培养基:黄豆粉3%、葡萄糖 1.5%、KH2PO40.2%、MgSO40.15%。
干重测定:将培养好的液体菌液300 mL过滤,清水冲洗菌丝球,在烘箱中80℃烘干至恒重,精确称量,每个处理3次重复,计算菌丝干重的平均值。
菌球直径测定:每一种培养液中选取15个菌球排成一长列,测量总长度,计算平均值。
菌落数测定:移液枪吸取液体菌种1 mL,加入9 mL无菌水稀释,再取1 mL稀释的液体菌种涂布在PDA培养基上,25℃条件培养,记录萌发时间及培养36 h的菌落萌发数。
2) 培养条件优化
结合种子液培养基筛选情况,选择一种培养基作为基准培养基,单因素筛选 pH (4.5、5.0、5.5、6.0、6.5、7.0、7.5)、温度 (20℃、22℃、24℃、26℃、28℃)、转速 (110 r·min-1、130 r·min-1、150 r·min-1、170 r·min-1、190 r·min-1)以及通气量(摇瓶使用1层、2层及不透气封口膜封口),测定指标同 1)。
1.2.2 深层发酵优化
发酵罐培养目的是菌丝扩大培养,满足生产需要。以种子液最佳培养基作为发酵培养基,培养条件参照1.2.1中培养条件优化。
以发酵罐中培养基体积的2%、3%、4%、5%提前制备种子液,接种后,每天测量发酵液的pH,以推测菌丝生长过程中分泌酸性物质的情况,指标测定同1.2.1中培养基筛选外,还需测定液体菌种在培养料中的生长情况,包括生长势及生长速度。指标测定时间为接种后的第3天、第4天,旨在得到适合的种子液接入量以及培养时间。
根据1.2.1试验得到的结果,在发酵罐中扩大培养,发酵罐内蒸汽压力达到121℃、0.105 MPa,保持时间30 min~40 min,以达到彻底灭菌的效果。培养条件,冷却至室温接种,并调节罐压保持在0.02 MPa~0.04 MPa,通气量在 1 ∶(0.5~1.2)(料液体积 ∶空气体积)。记录数据,测定指标。
1.2.3 出菇验证
根据本试验中优化的培养条件培养的液体菌种,按照一定接种量接种到栽培袋(15 cm×55 cm)中,记录吃料情况、子实体个数、出菇周期、出菇整齐度、生物学效率及鲜菇农艺性状等指标,以评价液体菌种质量。
2 结果与分析
2.1 种子液最优培养基
在4种种子液培养基中,其菌丝干重、萌发情况、菌丝球直径均有所差异,详见表1。
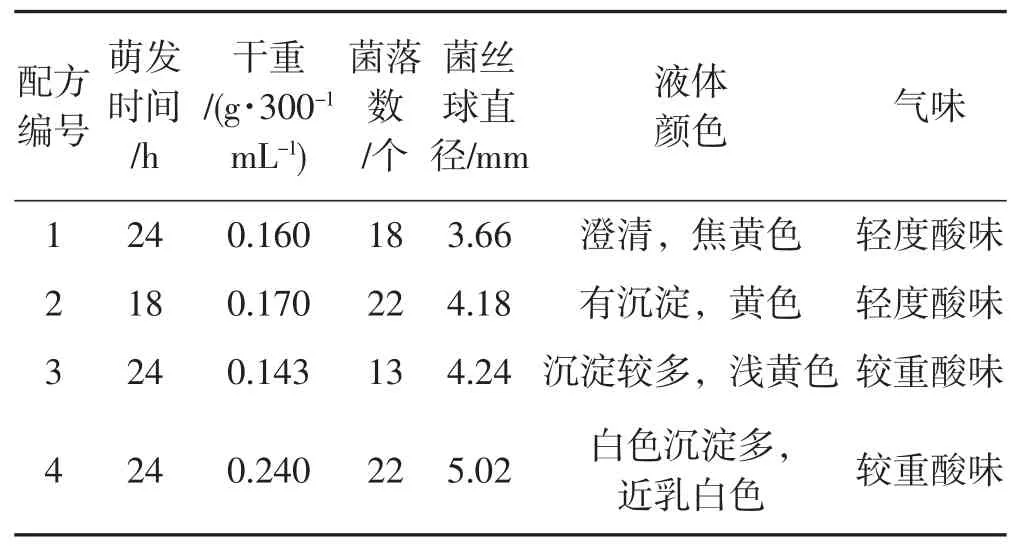
表1 菌丝在不同配方中的生长情况Tab.1 Growth of mycelium in different formula
从表1可以看出,马铃薯、麦麸、玉米粉及黄豆粉均能为裂褶菌菌丝生长提供一定的营养,相对于常见的以马铃薯汁液为主要培养基添加物外,使用麦麸、玉米粉、黄豆粉更为简便,用时较短,利用这些汁液作为培养基添加物是较好的选择。根据液体菌种指标检测结果可以看出,菌丝在配方2中生长相对较好,其干重达0.17 g·300-1mL-1,且菌丝活力好,萌发快,在PDA培养基中仅18 h即可萌发,菌丝球直径相对适中,不会造成管道堵塞。此外,由于裂褶菌菌丝发酵过程中会产生一定量的酸,而黄豆粉遇酸会凝结成豆腐块,不适宜作为培养裂褶菌的液体培养基添加物。
在发酵过程中,发现发酵液气味各异,在配方1和配方2中,酸味较配方3和配方4轻,可能与菌丝在不同配方中产酸能力有关,总体来说,发酵液酸味小的培养基培养的菌丝优于酸味大的培养基。综上,适宜裂褶菌菌丝生长的液体培养基为配方2。
2.2 种子液培养条件
2.2.1 pH
不同pH对种子液的影响情况见表2。
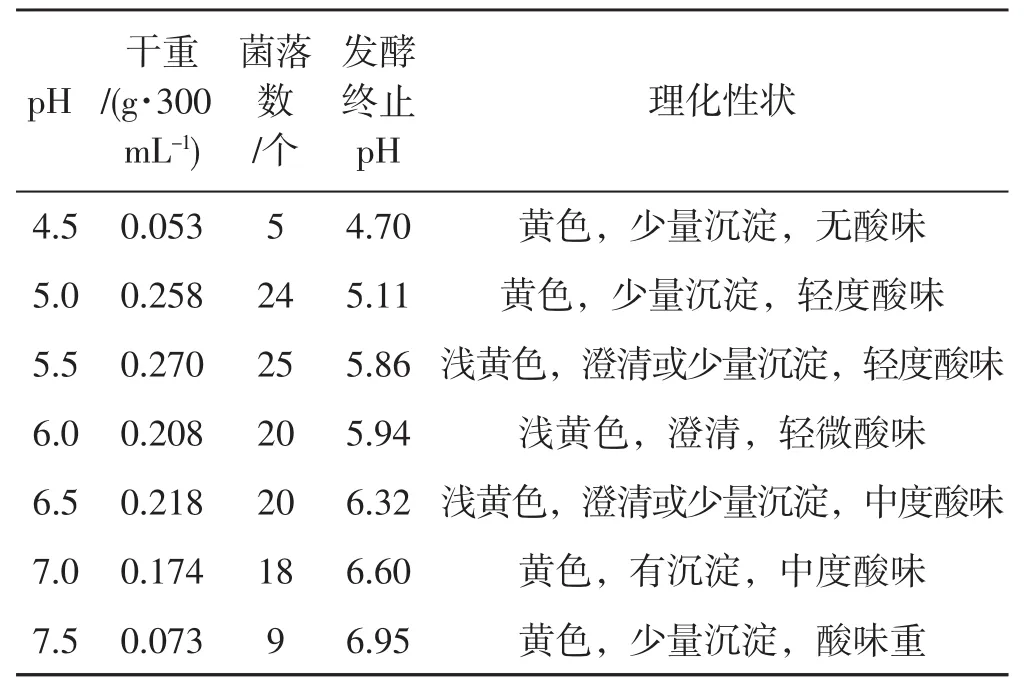
表2 不同pH对种子液的影响Tab.2 Effect of different pH values on spawn liquid
从表2可知,总体看弱酸条件更适宜裂褶菌菌丝生长,pH在5.0~6.5,菌丝干重、活力均优于强酸及弱碱条件培养的菌丝。随着pH逐渐增大,菌丝干重变化明显,呈现出“少-多-少”的规律,在pH 4.70 时,干重仅 0.053 g·300-1mL-1,此时的菌丝活力较弱,萌发时间不低于24 h,菌落数仅5个;pH达到 5.50 时,菌丝干重也到达最大 0.270 g·300-1mL-1,菌丝活力旺盛,萌发时间仅为18 h,生长势好。其后,菌丝干重逐渐下降,到pH 7.50时,菌丝干重低于 0.073 g·300-1mL-1,菌丝量极少。
在菌丝发酵过程中,液体气味跟pH有关,pH越小,发酵液酸味越小,反之越大,指标测定结果表明,裂褶菌菌丝在偏弱酸性培养基中生长势好,活力强。在弱碱性环境中菌丝活性降低,生长势差,实际生产过程中,可根据发酵液酸味轻重程度作为裂褶菌菌丝生长情况的一个重要指标。
2.2.2 通气
为验证通气量对种子液培养的影响,设计了3个不同的处理,结果见表3。
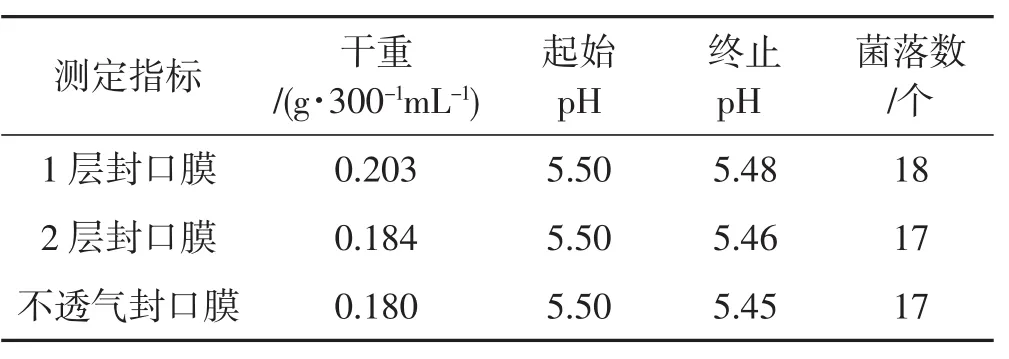
表3 通气对种子液的影响Tab.3 Effect of ventilation on spawn liquid
由表3可知,1层封口膜培养的菌丝干重比2层封口膜和不透气封口膜培养的菌丝干重多出0.019 g·300-1mL-1、0.023 g·300-1mL-1,且菌丝活力好,萌发时间均为18 h,菌落数差异不大。此外,3个处理的pH均有所下降,但变化幅度小。综上,培养4 d的种子液对于通气量需求不大,因此,在制备种子液时通气无需特别处理。
2.2.3 温度
不同温度对种子液的影响情况见表4。
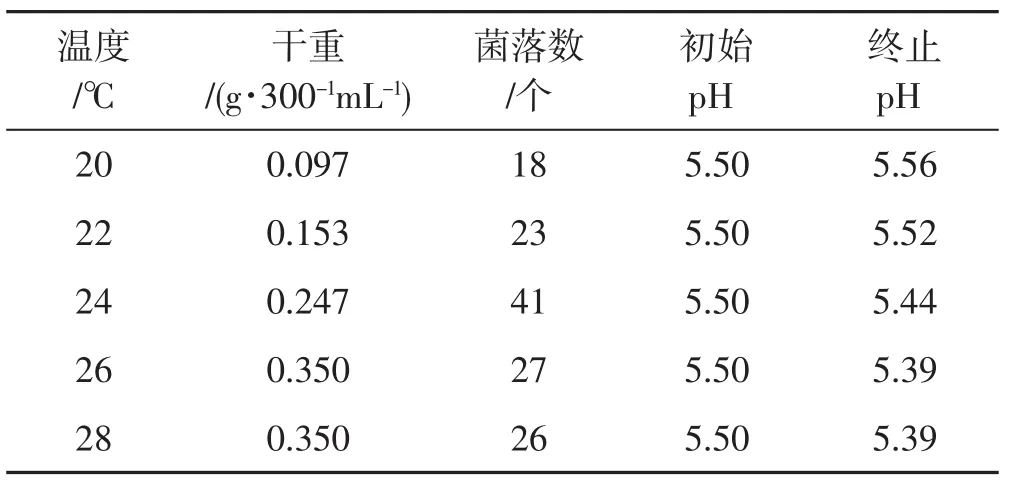
表4 温度对种子液的影响Tab.4 Effect of temperature on spawn liquid
由表4可知,总体来看,随着温度升高,菌丝干重及菌落数均呈现出先上升后下降的趋势,而pH保持逐渐降低趋势。在温度为20℃、22℃时,菌丝量极少,菌丝干重量分别为 0.097 g·300-1mL-1、0.153 g·300-1mL-1,分别不到 26℃时菌丝干重的 1/3、1/2,菌落数相对较少。温度升高到24℃时,菌丝干重为0.247 g·300-1mL-1,此时的菌丝萌发情况较好,菌落数最多,表明此时的菌丝活性强,随着温度继续增加至26℃和28℃时,菌丝干重达到最大为0.35 g·300-1mL-1并保持恒定,但菌落数逐渐减少,这与温度高、菌丝老化严重有关。因此,适合裂褶菌种子液培养的最适温度为24℃~26℃。
2.2.4 转速
不同转速对种子液的影响情况见表5。
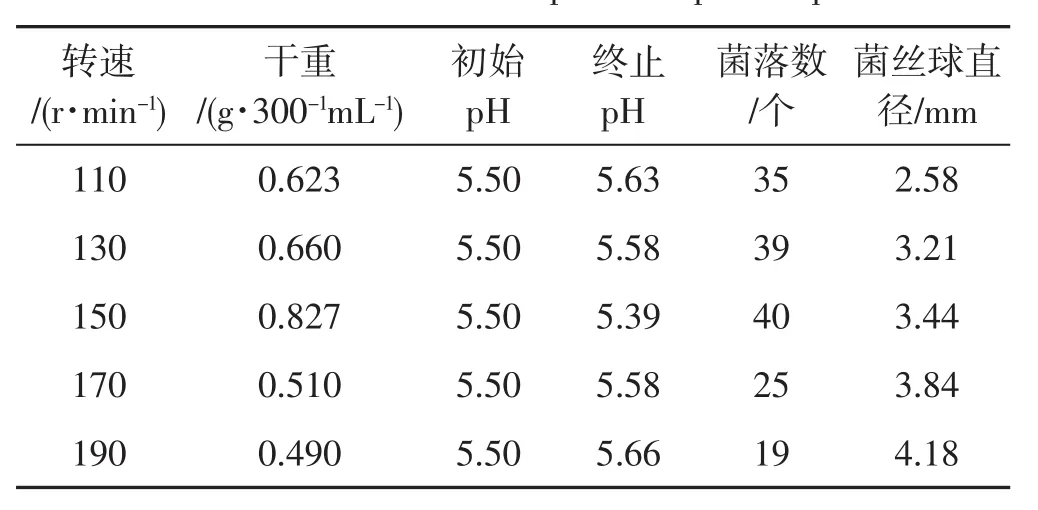
表5 转速对种子液的影响Tab.5 Effect of rotation speed on spawn liquid
由表5可知,随着转速增加,菌丝干重及菌落数先增加后减少,在转速为150 r·min-1时,菌丝球直径大,菌丝干重相对最重,菌丝活力强,萌发快,菌落数最多,且菌丝形态多呈鹅毛状,菌丝球占少部分,发酵液中菌丝均匀;而转速在110 r·min-1时,恰好相反。当转速达到 170 r·min-1、190 r·min-1时,菌丝球直径大,在摇瓶中菌丝数量少,不宜作为种子液。作为种子液来源,选择菌丝数量多的接入发酵罐更容易增加萌发点,且培养的菌丝球相对均匀。综上,适合裂褶菌种子液培养的转速为150 r·min-1。
2.3 菌丝扩大培养
2.3.1 发酵罐接种量
在筛选出种子液配方后,按照上述条件进行种子液的制备,参照上述培养条件,使用发酵罐对菌丝进行扩大培养,并且对种子液接种量进行了试验,以保证菌丝活力旺盛同时缩短培养周期。根据食用菌液体菌种生产技术规程标准(DB21/T 1693-2008)中规定的食用菌液体菌种量(湿重>8 g·100-1mL-1),即可作为生产菌种。试验验证,35 g湿重可烘干得到1 g干重。根据实际情况,菌丝球直径大小无具体标准,在菌丝球均匀、浓度正常、活力好的情况下,保证菌丝球不会造成管道堵塞均可。
从接种量来看,当接种量为2%、3%、4%、5%时,培养3 d和4 d的菌丝,平均干重分别是0.578 g·300-1mL-1、1.137 g·300-1mL-1、1.488 g·300-1mL-1、1.428 g·300-1mL-1,具体见图 1。
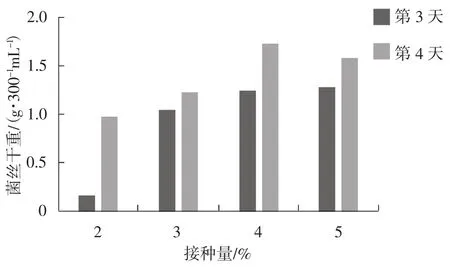
图1 菌丝干重情况Fig.1 The dry weight of mycelial
由图1可知,接种量为2%时,菌丝量少(湿重<8 g·100-1mL-1);接种量增至3%时,菌丝量增加了近2倍;随后,接种量增加,菌丝量变化幅度小;4%接种量时,菌丝量达到最大,随后呈现下降趋势。从培养天数来看,培养时间越长,菌丝量越大。菌丝生长速率情况见图2。
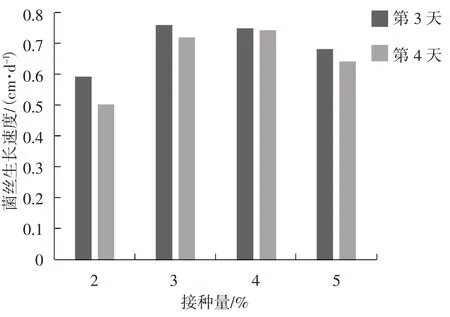
图2 菌丝生长速度情况Fig.2 The growth rate of mycelial
由图2可知,液体菌种接入培养料中的生长速度与培养天数、接种量均有关。在菌丝培养3 d时,随接种量增大,菌丝生长速度先增大,后逐渐降低,在接种量3%时达到最大,为0.761 cm·d-1。在菌丝培养4 d时,随接种量增大,菌丝生长速度也呈现出相同规律,在接种量4%时达到最大,为0.741 cm·d-1,但仍小于培养3 d时的最大生长速度。菌丝萌发情况见图3。
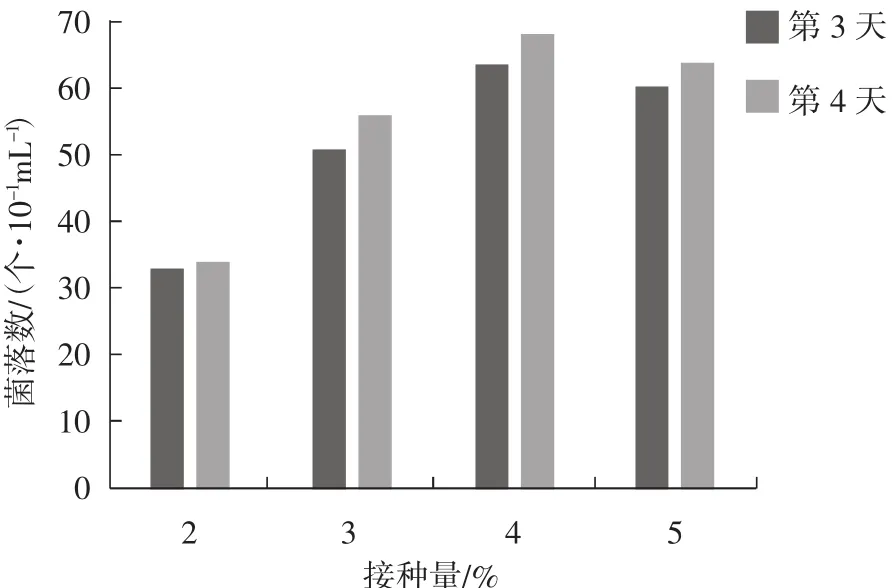
图3 菌丝萌发情况Fig.3 Mycelial germination situation
计算菌落萌发时间均为涂平板后的第24小时,由图3可以看出,对接种量而言,接种量增大,菌落数呈现出先增加后减少的趋势。在接种量4%时,菌落数最多,表明此时的菌丝活力好,相同时间条件下菌落萌发数多。接种量2%、3%时,由于菌丝量较少,菌落萌发数少于接种量4%时,但在PDA培养基上培养超过48 h后,菌落数均呈指数级上升;在接种量5%时,菌丝量多,可能由于菌丝活性下降,多数菌丝萌发时间稍有滞后,只有部分菌丝萌发。从培养时间来看,培养时间越长,菌落数增多,但相差不明显。综上,4%的接种量培养3 d或者4 d对于菌丝生长最合适。菌丝扩大培养情况见表6。
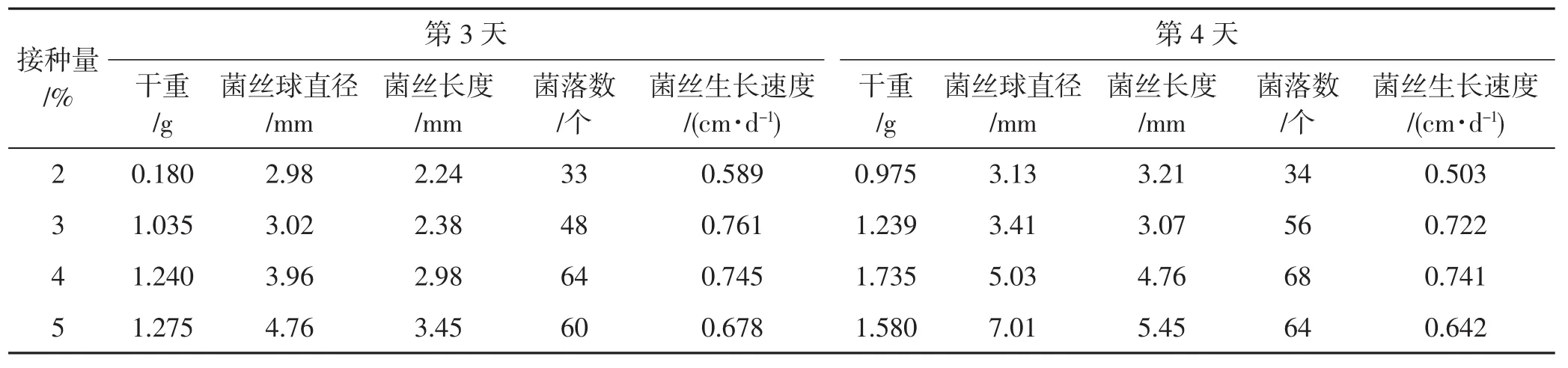
表6 菌丝扩大培养情况Tab.6 Mycelial expansion cultivation situation
由表6可知,接种量、培养天数不同,菌丝球直径及菌丝形态有所差异,菌丝球直径随接种量、培养天数增加而增多,且鹅毛状菌丝与菌丝球比例也相对增多。但在接种量为5%、培养天数为4 d时,菌丝球直径达7.03 mm,使用时会造成管道堵塞且菌丝老化明显。因此,接大接种量、延长培养时间并不是最好的处理。
综上,发酵罐扩大培养裂褶菌菌丝的条件可设定为温度24℃、接种量为3%或4%、培养3 d,按照此培养方法得到的液体菌种湿重分别为12.1 g·100-1mL-1、14.5 g·100-1mL-1,且活力好,菌丝球及菌丝大小均匀、生长速度快,可用于生产。
2.3.2 发酵终止pH变化趋势分析
从种子液试验结果来看,发酵终止pH呈弱酸性时菌丝生长好,为进一步了解pH与发酵过程中菌丝生长情况之间的联系,对发酵液的pH进行检测,结果见图4。
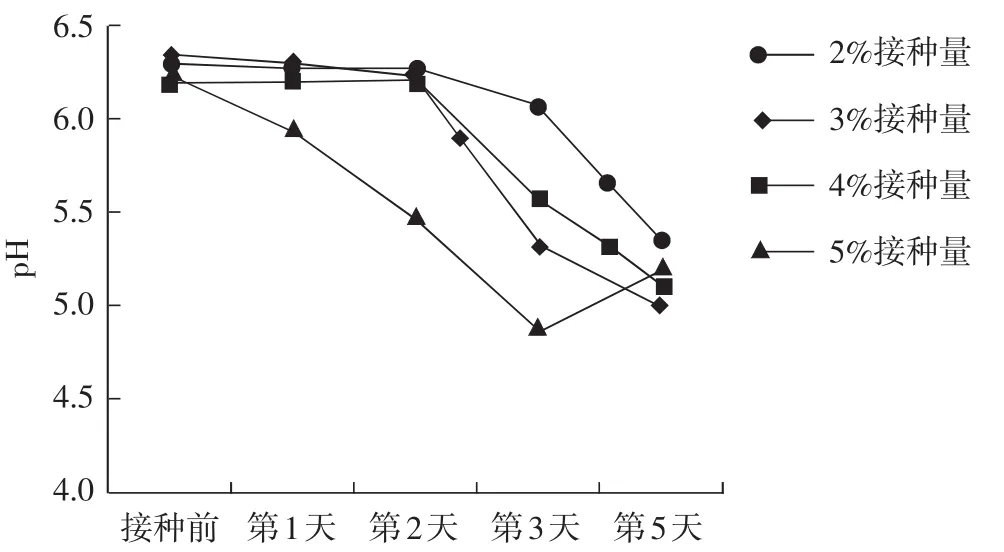
图4 pH变化趋势Fig.4 pH change trend
由图4可知,在接种前培养基自然pH均维持在6.2~6.3,接种前2 d的pH变化趋势不大,但接种量为5%时,培养第2天的pH呈直线下降。在培养3 d时,pH相差较大,这与菌丝量多少有关,此时5%接种量对应的pH已低于5.0,而2%接种量对应的pH仍维持在6.0以上。由 2.3.1分析结果来看,此阶段不建议使用2%的液体菌种,而3%、4%接种量对应的pH均在5.5左右,这与种子液结果中表明的pH为5.5时,菌丝生长良好相一致,是合格的液体菌种。在培养4 d时,4个处理的pH接近,均在5.0~5.5,结合表6中的结果,此时的菌丝量较大,2%接种量的菌丝量与第3天相比高5倍。因此,培养条件相同,无论接种量多少,pH维持在5.0~5.5,表明菌丝量已达到湿重>8 g·100-1mL-1,可用于生产。
综上,裂褶菌液体菌种培养过程中可以通过pH来监测液体菌种生长情况。结合以上试验结果,以配方2为液体培养基,在温度24℃、培养基初始pH自然或者调节到6.0,在pH为5.5左右时完成培养,此方法简单,操作便捷。
2.4 液体菌种出菇情况
依据上述试验参数培养的液体菌种用于栽培出菇,菌种接入到培养料中,仅18 h就萌发,时间短,且菌丝生长旺盛,生长势好,养菌时间为9 d即可诱导出菇。由于工厂化栽培成本高,本次试验选择粗放的管理条件。在此情况下仍出菇整齐,朵型(菊花型)与工厂化栽培的一致,颜色灰白,从接种到采收整个周期为23 d~25 d,采收子实体60个,生物学效率达14.7%。出菇情况如图5所示。

图5 出菇情况Fig.5 Mushroom production
图5试验结果表明,液体菌种生长快,萌发点多,出菇时间比使用传统的固体菌种缩短1 d~2 d;简易厂房栽培裂褶菌,其产量虽不及工厂化栽培,但仍可行,一潮菇生物学效率达14.7%,已高于传统栽培产量;除菇峰整齐度及出菇周期(长)不及工厂化栽培外,其余农艺性状差异不大。
综上,本试验培养的液体菌种用于生产是可行的。随后,继续将液体菌种应用到工厂化栽培中,以完善裂褶菌工厂化栽培工艺。
3 结论
近年来,液体菌种已成为重点研究对象,目前国内成熟的工厂化栽培品种,如杏鲍菇、海鲜菇、金针菇等,液体菌种的研究相对透彻,推进了食用菌工厂化栽培进程。液体菌种相对于固体菌种而言,有培养周期短、菌龄一致、萌发快、接种速度快等优点,是食用菌栽培、优选、必选模式[5]。
裂褶菌栽培起步较晚,在2012年时才有商业化栽培的报导,且栽培效果并不理想。在2017年时才进行工厂化初探,并取得一定成果[6]。在这之前,有学者对裂褶菌液体菌种进行研究,但研究多集中于多糖提取,很少或几乎未应用到栽培中,因此,使用液体菌种进行裂褶菌人工栽培这一领域的研究是脱节的。本试验在之前的液体菌种研究基础上创新性地用麦麸代替了马铃薯作为液体培养基添加物,减少成本的同时操作更方便,培养的菌丝活力好、长势好;发酵液的pH可作为初步判断液体菌种是否达到培养完成度的重要指标,此方法简捷,易检测;本研究获得了裂褶菌液体菌种培养的基本工艺条件,将此条件下培养的液体菌种用于出菇验证,缩短了养菌时间,且出菇效果要优于传统使用固体菌种,因此可以认为使用液体菌种进行栽培是可行的。后续将裂褶菌液体种投入到工厂化生产中,形成一套标准的、成熟的工艺,是亟需研究的课题。

