抑制Sonic hedgehog信号通路对Hela细胞增殖与凋亡的影响
刘洁 朱清 江梅 丁涛 姜经航 曹玉平 王开秀 蔡丽丽 王婷婷 邵帅
湖北省荆门市第二人民医院1病理科,3生殖医学中心(湖北荆门448000);2广州医科大学人体解剖教研室(广州511436)
宫颈癌是女性最常见的恶性肿瘤之一,其发病率在女性恶性肿瘤中仅次于乳腺癌[1]。宫颈癌大约占全球癌症新发病率的9%,女性癌症病死率的8%[2],2018年宫颈癌新增病例大约57 万,并且宫颈癌死亡人数为31.1 万,但在美国20 ~39 岁的女性中,宫颈癌的死亡率排第2 名[3-4]。80%以上的宫颈癌病例发生在发展中国家,而我国又是发展中国家宫颈癌高发地区,宫颈癌的发病率高居世界前列,发病率逐年上升,并且发病年龄逐渐年轻化[5]。因此,从机制上探索宫颈癌的治疗方法已经刻不容缓了。
增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)与细胞DNA 合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的有效指标[6]。PCNA 参与宫颈癌疾病的发生、疾病发展以及浸润,并且与宫颈癌的分化程度也密切相关[7];γ-三烯生育酚抑制宫颈癌细胞的增殖以及诱导细胞的凋亡也与PCNA 有关[8]。因此,PCNA 在宫颈癌细胞的增殖凋亡中扮演着重要的作用。
研究发现与肿瘤增生有关的Sonic hedgehog(Shh)信号通路与宫颈癌的发生发展密切相关[9],Shh 信号不仅参与宫颈癌细胞的增殖、侵袭以及转移等,而且与宫颈癌的上皮间质转化有关[10];研究[2]显示Shh 基因沉默抑制Shh 信号通路后能够抑制宫颈癌细胞上皮间充质转化、侵袭以及转移。尽管Shh 信号通路在宫颈癌中的发生发展中关系密切,然鲜有关于抑制Shh 信号通路对宫颈癌细胞增殖凋亡影响以及相关机制的研究报道,因此,本研究主要探讨抑制Shh 信号通路对宫颈癌细胞增殖凋亡影响是否与PCNA 有关,以便为宫颈癌的临床治疗提供基础理论指导。
1 材料与方法
1.1 材料Hela 细胞株为广州医科大学人体解剖教研室所有。RPMI-1640 培养基、胎牛血清、0.25%胰蛋白酶(含EDTA)、青霉素、链霉素均购自美国GIBCO 公 司;Cyclopamine 购 自 美 国Santa Cruz 公司;Trizol 购自美国Invitrogen 公司;RT-PCR反转录试剂盒、荧光定量PCR 试剂盒、RNase-free H2O 购自TakaRa 公司;CCK-8 试剂盒、Caspase-3、Caspase-9活性检测试剂盒购自碧云天公司;PCNA 抗体购自美国Santa Cruz 公司、Bax、Bcl-2 抗体购自Abcam 公司;β-actin、HRP-山羊抗兔购自中杉金桥生物技术有限公司;引物由invitrogen 公司合成。
1.2 方法
1.2.1 Hela 细胞培养将Hela 细胞培养于RPMI-1640 培养液(含10%胎牛血清和1%青链霉素)中,置于37 ℃、含5%CO2空气的培养箱中培养,每天更换液体。
1.2.2 细胞处理及分组Hela 细胞贴壁生长状态良好后消化细胞,以1×105/mL 接种于6 孔板培养,每孔加入2 mL 完全培养基。第2 天换液后将细胞分为对照组和Cyclopamine 组:Cyclopamine 组包括Cyc-1 组、Cyc-2 组、Cyc-3 组,分别给予10、20、40 μmol Cyclopamine 孵育;对照组给予等量生理盐水。
1.2.3 实时荧光定量PCR 检测Trizol 法提取各组细胞总RNA,采用RT-PCR 反转录试剂盒将RNA 逆转录为cDNA,以cDNA 为模板,添加相关引物扩增各基因。采用NanoDrop-1000 分光光度计、ABI 7500 软件检测Caspase-3、Caspase-8、Caspase-9 mRNA 表达水平。荧光定量PCR 扩增条件:95 ℃30 s;95 ℃5 s,60 ℃34 s,共40 个循环;95 ℃15 s,60 ℃1 min,95 ℃15 s,扩增完毕后分析扩增曲线和溶解曲线,每组实验均重复3 次。β-actin、Smo、Gli1 的引物序列见表1。
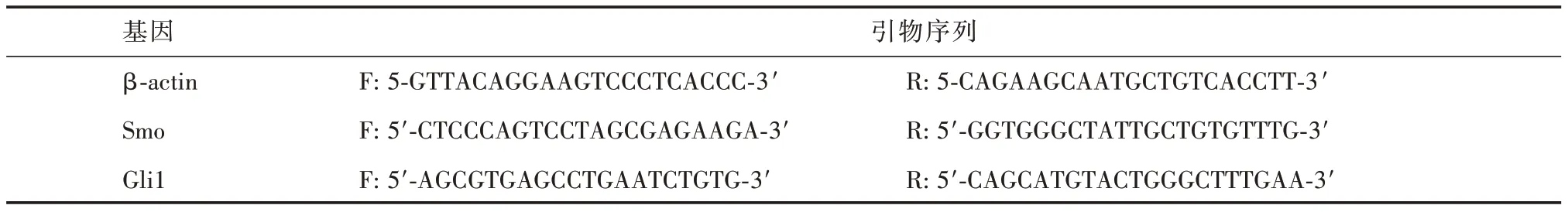
表1 RT-PCR 检测β-actin、Smo、Gli1 的引物Tab.1 Primer sequences of β-actin,Smo,Gli1
1.2.4 MTT 检测细胞抑制率将Hela 细胞以1 ×104/100 μL 接种于96 孔板中,实验分为对照组和Cyclopamine 组(Cyc-1、Cyc-2、Cyc-3),每组6 个重复。96 孔板周围一圈用灭菌PBS 代替,空白组只加入培养液。培养48 h 后,弃去培养基,加入新鲜培养基180 μL,再加20 μL MTT 溶液(5 μg/mL),继续培养4 h 后加入150 μL 的DMSO 振荡至蓝紫色结晶溶解,最后酶标仪检测OD值。细胞抑制率= 1-(用药组平均OD值-空白组平均OD值)/(对照组平均OD值-空白组平均OD值)× 100%。
1.2.5 Caspase-3 和Caspase-9 活性检测将Hela细胞接种于6 孔板中,待细胞生长过夜后,按上述方法培养和处理细胞后,胰酶消化收集细胞,PBS洗涤后加入裂解液重悬细胞,冰浴裂解15 min,4 ℃,12 000 r/min 条件下离心10 min 收集上清液。根据试剂盒说明,以405 nm 波长测定吸光度OD值,建立标准曲线并测定Caspase-3、Caspase-9 的含量。
1.2.6 Western Blot 检测PCNA、Bax 和Bcl-2 蛋白表达按上述方法培养和处理细胞后提取细胞总蛋白,BCA 法检测蛋白浓度,调平各组细胞浓度,各组取40 μg 蛋白样品于聚丙烯酰胺凝胶电泳,然后275 mA 电流2 h 将蛋白转印至PVDF 膜,用封闭液(50 g/L BSA、0.1% Tween-20 TBS)封闭后,加β-actin、PCNA、Bax 和Bcl-2 抗体(1∶1 000)4℃孵育过夜;次日,二抗于室温孵育2 h,化学发光显影。
1.3 统计学方法采用SPSS 13.0 软件进行统计学分析,数据以均数± 标准差表示,数据经正态性和方差齐性检验,多组均数间比较采用单因素方差分析,两两比较采用LSD-t法。以P <0.05 为差异具有统计学意义。
2 结果
2.1 Cyclopamine 对Shh 信号通路的抑制情况Q-PCR 结果显示:与对照组相比,Cyclopamine 药物浓度为10 μmol 时Shh 信号通路处于抑制状态(P<0.01);随着Cyclopamine 药物浓度的增大,Shh信号通路抑制情况更加明显(P<0.01)。见表2。
表2 Cyclopamine 对Shh 信号通路的抑制情况Tab.2 Effects of Cyclopamine on Shh signaling pathway ± s
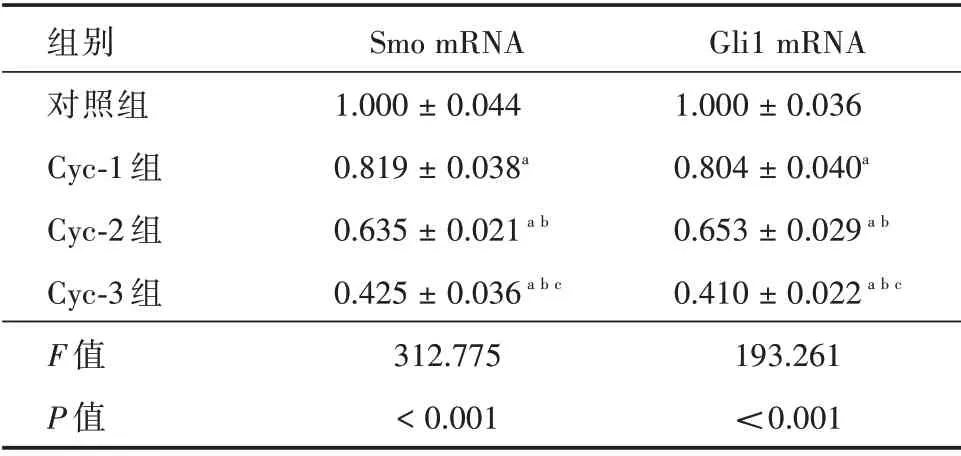
表2 Cyclopamine 对Shh 信号通路的抑制情况Tab.2 Effects of Cyclopamine on Shh signaling pathway ± s
注:与对照组相比,aP <0.01;与Cyc-1 组相比,bP <0.01;与Cyc-2 组相比,cP <0.01
组别对照组Cyc-1 组Cyc-2 组Cyc-3 组F 值P 值Smo mRNA 1.000 ± 0.044 0.819 ± 0.038a 0.635 ± 0.021a b 0.425 ± 0.036a b c 312.775<0.001 Gli1 mRNA 1.000 ± 0.036 0.804 ± 0.040a 0.653 ± 0.029a b 0.410 ± 0.022a b c 193.261<0.001
2.2 Cyclopamine 对Hela 细胞增殖的影响MTT检测结果显示:与对照组相比,当Cyclopamine 药物浓度为10 μmol 时两者没有明显变化;当Cyclopamine 药物浓度为20μmol 时能够抑制Hela 细胞的增殖(P<0.01);当Cyclopamine 药物浓度为40 μmol 时Hela 细胞的抑制情况更加明显(P<0.01)。见图1。
2.3 Cyclopamine 对Caspase-3 和Caspase-9 含量表达的影响ELISA 结果显示:与对照组相比,Cyclopamine 药物浓度为10μmol 时Caspase-3 表达升高(P<0.01),而Caspase-9 无明显变化;与Cyc-1组相比,当Cyclopamine 药物浓度为20μmol 时Caspase-3 表达升高(P<0.05),而Caspase-9 升高更加明显(P<0.01);与Cyc-2 组相比,当Cyclopamine 药物浓度为40 μmol 时Caspase-3 和Caspase-9 均表达升高(均P<0.01)。见表3。
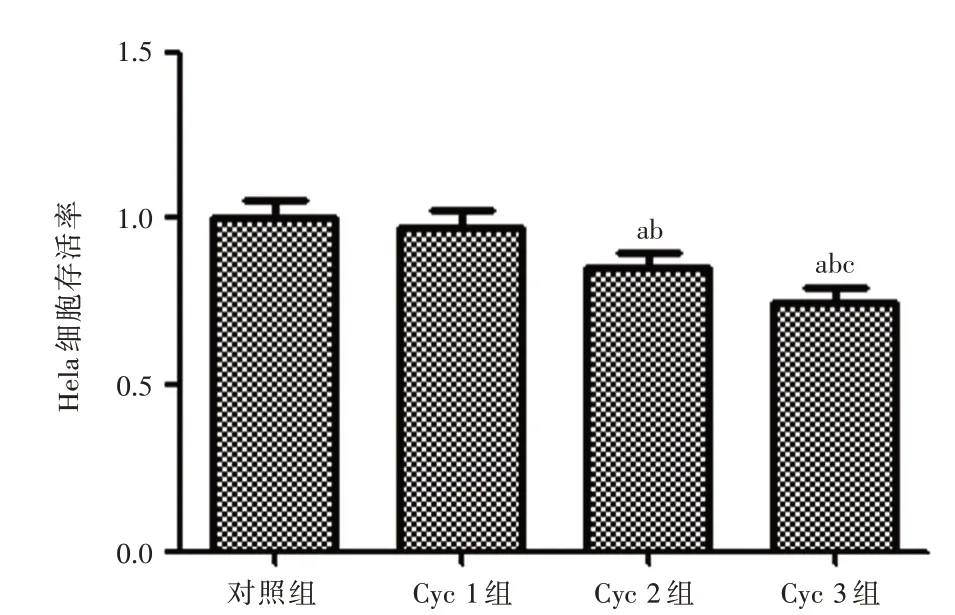
图1 Cyclopamine 对Hela 细胞增殖的影响Fig.1 Effect of Cyclopamine on Hela cell proliferation
表3 Cyclopamine 对Caspase-3 和Caspase-9 含量表达情况的影响Tab.3 Effects of Cyclopamine on the expressions of Caspase-3 and Caspase-9 ± s
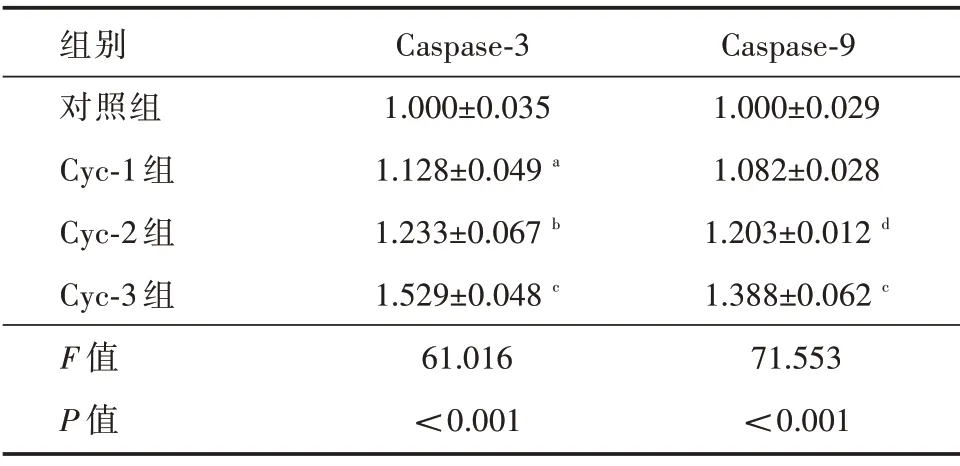
表3 Cyclopamine 对Caspase-3 和Caspase-9 含量表达情况的影响Tab.3 Effects of Cyclopamine on the expressions of Caspase-3 and Caspase-9 ± s
注:与对照组相比,aP <0.05;与Cyc-1 组相比,bP <0.05,dP <0.01;与Cyc-2 组相比,cP <0.01
组别对照组Cyc-1 组Cyc-2 组Cyc-3 组F 值P 值Caspase-3 1.000±0.035 1.128±0.049a 1.233±0.067b 1.529±0.048c 61.016<0.001 Caspase-9 1.000±0.029 1.082±0.028 1.203±0.012d 1.388±0.062c 71.553<0.001
2.4 Cyclopamine 对PCNA、Bcl-2 和Bax蛋白的表达情况影响Western Blot 结果显示:与对照组相比,Cyclopamine 药物浓度为10 μmol 时增殖相关蛋白PCNA、抗凋亡蛋白Bcl-2 和促凋亡蛋白Bax 均无明显变化;与Cyc-1 组相比,当Cyclopamine 药物浓度为20 μmol 时Bax 表达升高(P<0.05),而PCNA和Bcl-2 表达下降(均P<0.01);与Cyc-2 组相比,当Cyclopamine 药物浓 度为40μmol 时Bax 表达升高(均P<0.01),而PCNA 和Bcl-2 表达下降(均P<0.01)。见图2~5。
3 讨论

图2 Cyclopamine 对PCNA、Bcl-2 和Bax 蛋白的表达情况影响Fig.2 Effects of Cyclopamine on the expression of PCNA,Bcl-2 and Bax proteins
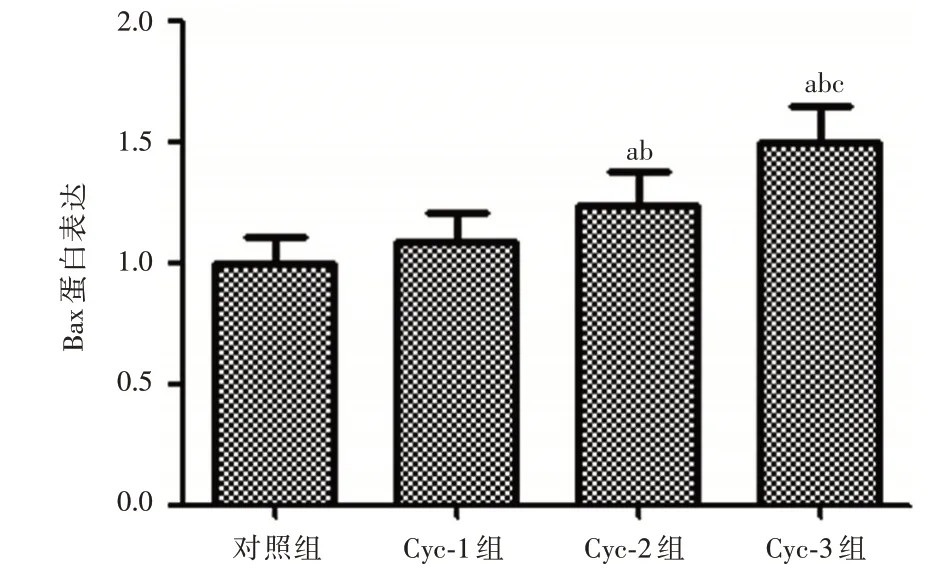
图3 Cyclopamine 对Bax 蛋白的表达情况影响Fig.3 The effect of Cyclopamine on the expression of Bax protein
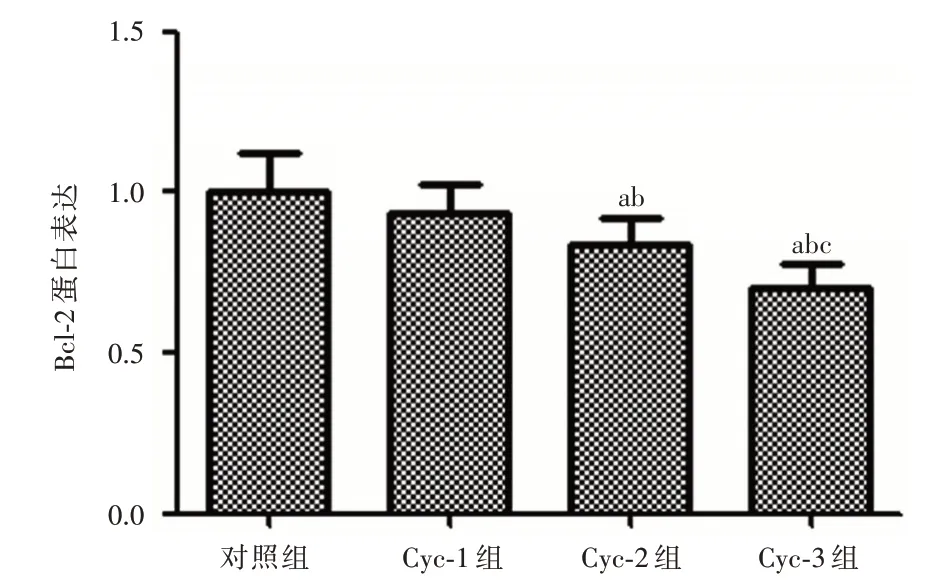
图4 Cyclopamine 对Bcl-2 蛋白的表达情况影响Fig.4 The effect of Cyclopamine on the expression of Bcl-2 protein
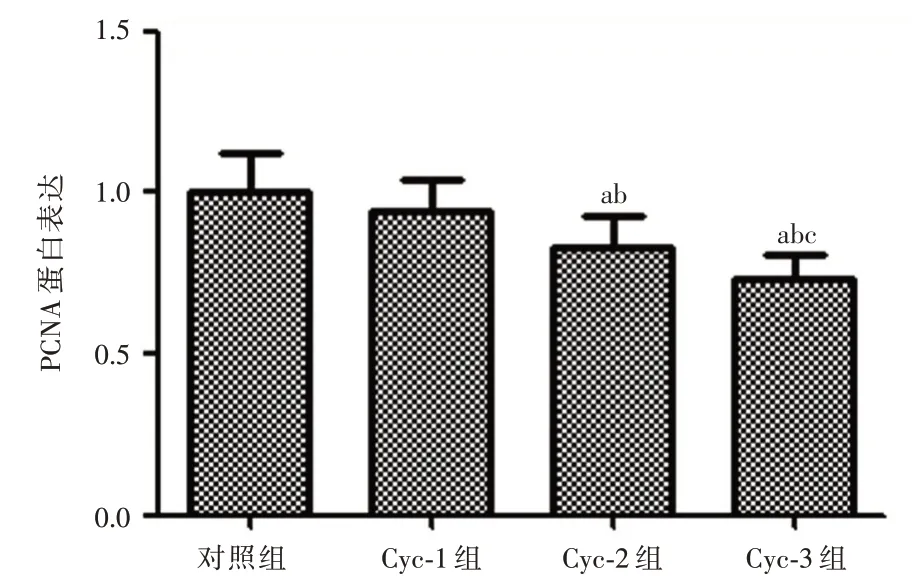
图5 Cyclopamine 对PCNA 蛋白的表达情况影响Fig.5 The effect of Cyclopamine on the expression of PCNA protein
宫颈癌伴淋巴结转移是女性常见的恶性肿瘤之一[11]。数据显示,大约90%的宫颈癌患者为低中等收入国家居民,有转移或复发的患者,其总体预后仍然不佳[12]。手术、放疗、化疗等方法对早期宫颈癌比较有效,但对于晚期宫颈癌就显得极其有限了。因此,从发病机制探讨宫颈癌的治疗方法就显得极其重要。研究发现Shh 信号通路与宫颈癌存在一定的关联,在宫颈癌组织中有Shh 信号和其相关下游分子FOXM1 表达[13];在原位异种宫颈癌移植治疗中抑制Shh 信号通路可以增强放疗和顺铂的疗效[14]。鉴于Shh 信号与宫颈癌的相互作用,因此,本实验以Hela 细胞为宫颈癌细胞研究对象,抑制Shh 信号通路观察其对宫颈癌细胞增殖和凋亡的影响以及可能的机制。
本研究结果显示,Shh 信号通路抑制剂Cyclopamine 对Hela 细胞有一定的抑制作用,随着Cyclopamine 浓度增大抑制效果更明显,这与Shh 蛋白激活Shh 信号通路能够促进Hela 细胞增长相一致[15]。本实验与YU等[16]的研究结果相一致,Cyclopamine 能够抑制Hela 细胞的增殖,并且具有药物浓度依赖性,浓度越大抑制情况更加明显。宫颈癌细胞凋亡途径包括:(1)Caspase-9/Caspase-3细胞凋亡途径。Caspase-9 和Caspase-3 凋亡途径在内源性凋亡的过程中扮演重要作用,Caspase-9作为内源性凋亡途径的执行者,而Caspase-3 则被认为是凋亡最终执行者,因此检测Caspase-9 和Caspase-3 的表达水平变化可以反映凋亡的发生。研究[17]显示来自粉煤灰的沸石X 可以通过激活Caspase-9 和Caspase-3 途径来诱导宫颈癌细胞进入凋亡状态;而在本研究中Cyclopamine 能够使凋亡相关因子Caspase-3 和Caspase-9 的表达升高,而且随着浓度增大,Caspase-3 和Caspase-9 的表达升高也明显,说明抑制Shh 信号通路能够激活Caspase-3 和Caspase-9 途径来诱导细胞凋亡;(2)Bcl-2/Bax 细胞凋亡途径。SHI 等[18]通过岩白菜素抗癌治疗发现其可以通过上调Bax 蛋白表达以及下调Bcl-2 蛋白表达来促使宫颈癌细胞的凋亡;本实验研究也有相一致的结果,Cyclopamine 抑制Shh信号通路后能够使抗凋亡蛋白Bcl-2 表达下降和促凋亡蛋白Bax 表达上升,而且Bcl-2 表达下降和Bax 表达上升具有Cyclopamine 药物浓度依赖性,说明抑制Shh 信号也能够通过Bcl-2/Bax 细胞凋亡途径来影响细胞凋亡。PCNA 是DNA 聚合酶的辅助因子,不仅在DNA 复制合成以及细胞周期中起着重要的调控作用,而且许多细胞内外增殖信号都须经过PCNA 的参与[19]。PCNA 水平在DNA 合成周期的改变与细胞增殖过程一致,是一种衡量肿瘤恶性程度与增殖力的可靠指标。柯里拉京对宫颈癌Hela 细胞抑制作用也与上调凋亡蛋白Caspase-3 和Caspase-9 以及下调PCNA 蛋白有关[20];本研究中,随着Cyclopamine 的药物浓度增大,PCNA蛋白表达逐渐下降,PCNA 蛋白表达明显被抑制,说明Cyclopamine 抑制Shh 信号通路后能通过抑制PCNA 的表达来抑制Hela 细胞DNA 合成及分裂增殖,其可能的机制与通过G0/G1 细胞周期阻滞抑制细胞增殖有关[8]。
综上所述,本研究发现Cyclopamine 抑制Shh信号通路后,随着Cyclopamine 药物浓度增大能够抑制Hela 细胞增殖,抑制Bcl-2 表达、促进Bax、Caspase-3 和Caspase-9 来诱导细胞凋亡,其可能的机制与PCNA 蛋白表达逐渐下降,抑制Hela 细胞DNA 合成及分裂增殖有关。本实验存在一定的局限性,宫颈癌细胞系只研究了一株,需要多研究几株细胞系保证实验可靠性,凋亡途径以及增殖有关蛋白研究有限,具体机制有待进一步研究查证,以期为宫颈癌的靶向治疗提供有益的线索。

