杏鲍菇菇头多糖的结构鉴定及生物活性评价
郑恒光,沈恒胜,杨道富,翁敏劼,陈君琛*
(福建省农业科学院农业工程技术研究所,福建 福州 350003)
杏鲍菇(Pleurotus eryngii)是一种集食用、药用、食疗于一体的珍稀食用菌,富含多糖等生物活性物质[1]。近年来,随着工厂化杏鲍菇产量的成倍增加,栽培副产物的开发利用引起广泛重视,尤以杏鲍菇菇头的开发利用最紧迫[2]。
杏鲍菇菇头是杏鲍菇子实体和栽培料之间的海绵状菌体,质量可达子实体的20%~30%[3],它由杏鲍菇菌体组成,其口感风味虽然与商品菇差异不大,但由于形状各异,且易夹带栽培料碎屑而难以作为商品销售,目前未得到有效利用。尽管如此,多数学者仍看好这一数量巨大的加工副产物资源,希望将其开发为提取杏鲍菇多糖的廉价原料[4]。目前,杏鲍菇子实体多糖的提取、纯化、结构分析以及生物活性已经得到广泛研究,已有研究表明,杏鲍菇多糖主要由葡萄糖单元组成,链接方式以β-1,3-糖苷键为主,具有抗氧化、抗肿瘤、增强免疫力、保肝、降血脂、抑菌、抗病毒等多种生物活性[5]。然而,目前关于杏鲍菇菇头多糖的研究报道仍比较少,仅有研究结果表明,杏鲍菇菇头多糖和杏鲍菇多糖相似,同样由葡萄糖单元组成,但链接方式尚不清楚;此外,它同样具有多种生物活性,具体包括:体外抑制子宫颈癌Hela细胞、抗氧化和抑菌等生物活性[6-8]。为进一步阐明杏鲍菇菇头多糖和子实体多糖在特征营养成分方面的共性,本研究对杏鲍菇菇头粗多糖的结构特征及生物活性进行研究,以期为其在食品及医药领域的广泛应用提供参考依据。
1 材料与方法
1.1 材料与试剂
杏鲍菇菇头由福建省成发农业开发有限公司提供,经60 ℃烘干,中药粉碎机粉碎,再过100 目筛后备用。
牛血清白蛋白、VC、单糖及多糖标准品 美国Sigma公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT) 美国Amresco公司;RPMI Medium 1640培养基 美国GIBCO公司;胎牛血清 杭州四季青生物有限公司;MGC-803和人宫颈癌U14细胞 中国科学院上海生命科学院细胞资源中心;ICR小鼠(雄性20~22 g)(合格证号:Scxk(沪)2017-0005) 上海斯莱克实验动物中心。
1.2 仪器与设备
DG5032型酶联免疫检测仪 南京华东电子集团医疗设备有限公司;HH·CP-01W型细胞培养箱 上海博讯实业有限公司医疗设备厂;SP-756P紫外-可见分光光度计上海光谱仪器有限公司;7890N气相色谱仪 美国安捷伦科技有限公司;GCMS-QP 2010气相色谱-质谱联用仪 日本岛津公司;515泵系统凝胶渗透色谱(gel permeation chromatography,GPC)仪 美国Waters公司;RI-101示差折光指数检测器(refractive index detector,RID)仪 日本SHOKO公司;十八角激光散射(multiangle light scattering,MALLS)仪 美国Wyatt公司。
1.3 方法
1.3.1 杏鲍菇菇头粗多糖的制备
取100 g杏鲍菇菇头粉,于95%乙醇溶液中室温浸泡24 h脱脂,过滤、晾干,将滤渣分散于20 倍体积水中,100 ℃电磁炉蒸煮2 h,用纱布过滤出粗滤渣,然后5 000 r/min离心20 min弃去沉淀,收集上清液。用电磁炉煮沸,将提取液的体积浓缩至原来的1/5,冷却后加入3 倍体积的95%乙醇溶液,过滤收集乙醇沉淀物,加少量热水复溶后冷冻干燥[9],得到7.8 g粗多糖,置于干燥器内室温保存。
1.3.2 GPC-RID-MALLS联用法检测粗多糖的分子质量分布
1.3.2.1 凝胶色谱条件
Shodex SB-806 HQ凝胶柱(Φ8 mm×300 mm);流速0.5 mL/min;流动相氯化钠溶液+0.02%叠氮钠,流速0.1 mL/min;进样量100 μL[10]。
1.3.2.2 样品溶液制备
用流动相配制质量浓度5 mg/L多糖样品溶液,用0.2 μm柱头过滤器过滤后进样。
1.3.2.3 分子质量分布检测
采用RID和激光检测器分别记录供试品质量浓度和供试品在不同角度的光散射强度,折光指数增加量(dn/dC)值为0.135,通过数据处理软件ASTRA6.1获取供试样品的分子质量分布图。
1.3.3 粗多糖的单糖组成测定
采用糖精乙酸酯衍生物气相色谱法对杏鲍菇菇头粗多糖的单糖组成进行分析[11]。
1.3.3.1 粗多糖样品的水解
称取粗多糖样品20 mg,加入4 mol/L三氟乙酸溶液5 mL,110 ℃水解2 h。水解液于50 ℃真空旋转蒸发至干,用色谱纯甲醇清洗3 次,得粗多糖水解物。
1.3.3.2 粗多糖水解物的衍生反应
在粗多糖水解物中依次加入10 mg盐酸羟胺、1 mg内标肌醇和2 mL吡啶,密封,90 ℃水浴30 min后加入2 mL醋酸酐90 ℃水浴30 min,加入2 mL水终止反应。加入2 mL二氯甲烷萃取,重复2 次,合并二氯甲烷相,加入无水硫酸钠干燥过膜备用。
1.3.3.3 气相色谱测定
使用HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm),恒流模式,流速3 mL/min。升温程序:初始柱温100 ℃,保持1 min;然后以2 ℃/min升至160 ℃,保持5 min;以5 ℃/min升至180 ℃,保持3 min;再以20 ℃/min升到300 ℃,保持5 min。进样口采用分流模式,分流比10∶1;温度250 ℃;氮气为载气。氢火焰离子检测器温度250 ℃,氮气、氢气、空气流速分别为25、30 mL/min和400 mL/min;进样体积1 μL。单糖标准品(鼠李糖、阿拉伯糖、岩藻糖、木糖、甘露糖、葡萄糖和半乳糖)按照相同步骤进行实验,并且按照相同的检测程度,将处理后的标准品单糖进行气相色谱分析。
1.3.4 粗多糖糖苷键连接方式测定[12]
1.3.4.1 粗多糖甲基化衍生反应
粗多糖样品20 mg,加入8 mL无水二甲基亚砜,超声溶解10 min,快速加入200 mg NaOH粉末,超声溶解15 min,室温静置30 min,加入3 mL碘甲烷,室温避光反应24 h,加入4.0 mL蒸馏水终止反应。甲基化粗多糖用氯仿萃取,每次3 mL,共4 次。合并萃取液,用蒸馏水洗涤(10 mL×2),于60 ℃减压旋干。
1.3.4.2 甲基化产物的水解、还原和乙酰化
旋干后粗多糖样品加入4 mol/L三氟乙酸10 mL,100 ℃反应2 h,水解液于60 ℃减压旋干,再加入少量乙醇,旋干,重复3 次,烘干。水解后旋干样品加入4 mL蒸馏水溶解,用1% NaOH溶液调节pH值至10,加入20 mg NaBH4,室温反应6 h,再加入冰乙酸,调节pH值至5.5,终止反应。水解液浓缩至干后,再加入2 mL吡啶,2 mL乙酸酐,100 ℃反应1 h,随后加入2 mL蒸馏水终止反应。加入2 mL二氯甲烷萃取,重复2 次,合并二氯甲烷相,加入无水硫酸钠干燥过膜备用。
1.3.4.3 气相色谱-质谱联用分析
HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm);恒压模式20 psi;升温程序:柱温度起始150 ℃,维持3 min,以10 ℃/min升到260 ℃,再维持5 min。柱流速0.6 mL/min,分流比50∶1,进样口温度260 ℃,离子源温度280 ℃,进样量1 μL。
1.3.5 粗多糖的ABTS阳离子自由基清除率测定
1.3.5.1 ABTS工作液的配制
取7.4 mmol/L 2,2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid),ABTS)和2.6 mmol/L K2S2O8各0.2 mL,混匀,在暗处放置12 h,用去离子水稀释50 倍得到ABTS工作液[13]。
1.3.5.2 空白组吸光度A0的测定
取0.8 mL ABTS工作液,加入0.2 mL去离子水,振摇使之充分混匀,静置6 min后,在734 nm波长处测定A0。
1.3.5.3 处理组吸光度的测定
取6 只比色皿,分别加入5 mg/mL待测样液0.04、0.08、0.12、0.16、0.20、0.24 mL,加入去离子水使总体积为2.00 mL,再加入8.00 mL ABTS溶液,混合,静置6 min,在734 nm波长处测定吸光度A。
1.3.5.4 ABTS阳离子自由基清除率计算
按式(1)计算ABTS阳离子自由基清除率:
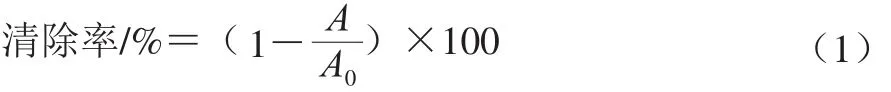
式中:A0为空白组吸光度;A为样品组吸光度。
1.3.6 粗多糖的体外抗肿瘤活性测定[14]
1.3.6.1 MGC-803细胞培养
将复苏后的MGC-803细胞接入灭菌的RPMI1640培养基(含10%的胎牛血清和青霉素、链霉素各100 IU/mL),于二氧化碳培养箱(37 ℃、5% CO2)中培养。
1.3.6.2 粗多糖对MGC-803肿瘤细胞增殖的抑制率
采用MTT法检测。取对数生长期的MGC-803细胞,经台盼蓝染色后计数,以1×105的密度接种于96 孔板中,每孔加入细胞悬液100 μL。培养24 h后,空白组每孔加入100 μL灭菌后RPMI1640培养基溶液,而样品组分别加入体积为100 μL不同质量浓度的杏鲍菇粗多糖溶液,设置粗多糖溶液的质量浓度梯度分别为25、50、100、200、400 μg/mL和800 μg/mL。粗多糖溶液与MGC-803肿瘤细胞接触72 h后,每孔加入20 μL质量浓度为5 mg/mL的MTT溶液,置于培养箱孵育4 h,1 000 r/min离心5 min后移除上清液,每孔再加入180 μL二甲基亚砜溶液,轻微振荡96 孔板10 min,使用酶标仪在492 nm波长处测定每孔吸光度。重复实验3 次,按式(2)计算细胞相对生长抑制率:
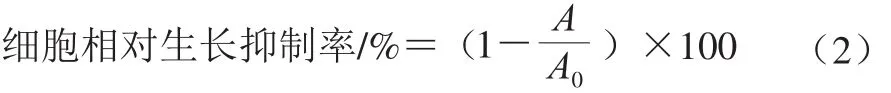
式中:A0为空白组吸光度;A为样品组吸光度。
1.3.7 粗多糖的体内抗肿瘤活性测定[15]
1.3.7.1 荷瘤小鼠移植瘤模型的建立
取腹水瘤小鼠,在无菌操作台内抽取腹水,用生理盐水稀释成约1×107个/mL的细胞悬液,接种于小鼠右腋皮下,每只接种体积为0.2 mL。
1.3.7.2 动物分组与给药
小鼠称质量,随机分成5 组,每组10~12 只,即模型对照组(等体积生理盐水组)、环磷酰胺(cyclophosphamide,C T X)阳性组(C T X 2 0 m g/(k g·d))、杏鲍菇粗多糖高、中、低剂量组(剂量分别为200、100 mg/(kg·d)和50 mg/(kg·d))。均灌胃给药,小鼠预先给药3 d,小鼠接种肿瘤后,继续给药,阳性组在接种肿瘤后第1、3、5天分别灌胃CTX一次,给药组灌胃不同质量浓度的药物,模型对照组和阳性对照组灌胃等体积的生理盐水。模型组给予等体积生理盐水,连续给药12 d。
1.3.7.3 样本采集
末次给药后24 h,颈椎脱臼处死各组小鼠,解剖,剥离瘤块,称体质量、瘤质量,抑瘤率按式(3)计算:
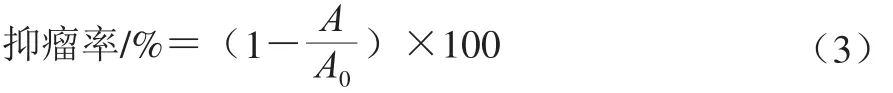
式中:A0为模型对照组吸光度;A为处理组吸光度。
1.4 数据处理
采用SPSS 17.0软件进行统计学分析。组间采用配对样本t检验,P<0.05,差异显著;P<0.01,差异极显著。图表绘制采用Microsoft Office Excel 2007软件。数据以表示。
2 结果与分析
2.1 杏鲍菇菇头粗多糖的分子质量分布分析
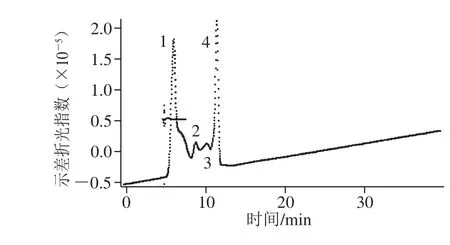
图1 杏鲍菇菇头粗多糖样品的分子质量分布Fig. 1 Molecular distribution pro file of crude polysaccharide extracted from the stalk residue of P. eryngii
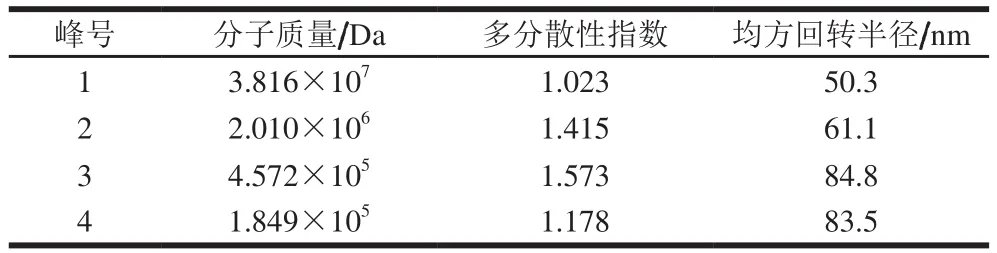
表1 分子质量与均方回转半径Table 1 Molecular masses and mean square radii of four polysaccharide fractions
如图1、表1所示,杏鲍菇菇头粗多糖的分子质量分布范围宽泛,最高达到千万道尔顿级别,主要由3.816×107、2.010×106、4.572×105Da以及1.849×105Da 4 个峰组成,其中,高分子质量(1号峰)和低分子质量(4号峰)所占比重较大。聚合物分散指数表明,1号峰和4号峰的粒径均一度高于2号峰和3号峰,均方回转半径随着分子质量增大而缩小。聚合物的均方回转半径通常取决于分子质量和支化度2 个关键因素[16],这表明,杏鲍菇菇头粗多糖中,大分子质量组分比小分子质量组分的支化度小。
2.2 杏鲍菇菇头粗多糖的单糖组成分析
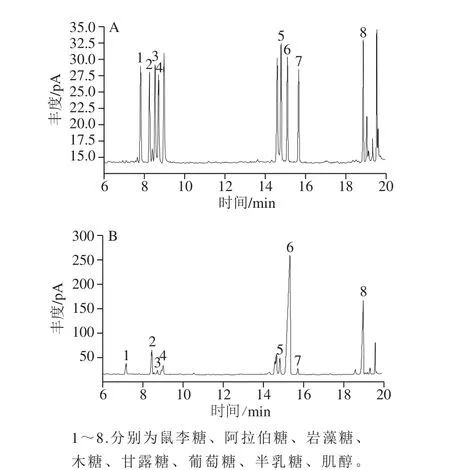
图2 混合标准品(A)和杏鲍菇菇头粗多糖样品(B)的单糖组成气相色谱图Fig. 2 Gas chromatograms for mixed monosaccharide standards (A)and composition analysis of the crude polysaccharide extracted from the stalk residue of P. eryngii (B)
如图2所示,各单糖出峰时间依次为7.20、8.41、8.68、8.88、14.91、15.25、15.92 min和18.94 min。各标准单糖出峰分离度较好,无干扰现象,可作为多糖组成进一步分析的依据。根据标准品与样品的保留时间确定单糖种类,由各峰面积比计算其物质的量比。如图3所示,杏鲍菇菇头粗多糖中,5 种单糖残基的物质的量比为阿拉伯糖∶岩藻糖∶甘露糖∶葡萄糖∶半乳糖=2.06∶0.24∶1∶17.60∶0.37。其中,葡萄糖的物质的量比最大,其质量百分比大约占84.4%。另外,由于实验条件及材料限制,还有7.0~7.5、9、14.5~15 min等个峰未能确定。
2.3 杏鲍菇菇头粗多糖的糖苷键连接方式分析
由表2可知,杏鲍菇菇头粗多糖的糖苷键链接主要方式有1,3-葡萄糖(占42.7%)和1,6-葡萄糖(占35.5%)。该分析结果也印证了单糖组成分析结论,即:该粗多糖主要由葡萄糖组成,其他种类单糖在粗多糖分子结构中所占比例不大。
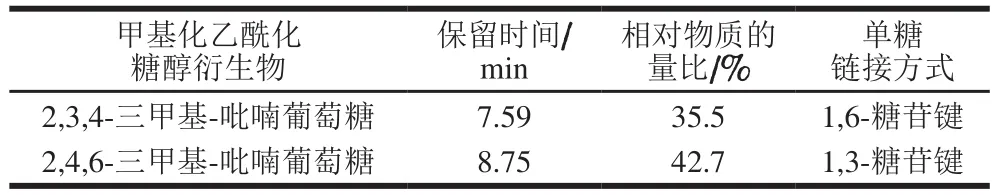
表2 杏鲍菇菇头粗多糖的甲基化Table 2 Methylation analysis of crude polysaccharide extracted from the stalk residue of P. eryngii
2.4 杏鲍菇菇头粗多糖对ABTS阳离子自由基清除效果
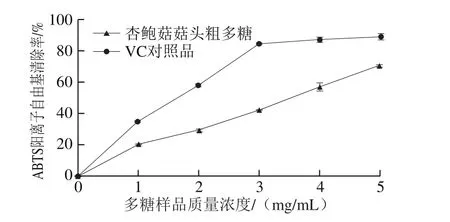
图3 杏鲍菇菇头粗多糖对ABTS阳离子自由基的清除率Fig. 3 Scavenging activity against ABTS radical cation of crude polysaccharide extracted from the stalk residue of P. eryngii
从图3可以看出,阳性对照VC在0~3 mg/mL质量浓度范围内呈剂量依赖关系,对ABTS阳离子自由基清除率增加迅速,质量浓度为3 mg/mL时的清除率约为85.0%;质量浓度超过3 mg/mL后,清除率趋于稳定,维持在90%左右。虽然杏鲍菇菇头粗多糖对ABTS阳离子自由基的清除率低于VC。但在0~5 mg/mL质量浓度范围内,随着质量浓度的增加,杏鲍菇菇头粗多糖对ABTS阳离子自由基清除率呈逐渐上升趋势;质量浓度为5 mg/mL时的清除率可达到70.9%。
2.5 杏鲍菇菇头粗多糖的体外抗肿瘤活性分析

表3 杏鲍菇菇头粗多糖质量浓度对人胃癌MGC-803细胞的抑制作用(n=10)Table 3 Inhibitory effects of different concentrations of crude polysaccharide extracted from the stalk residue of P. eryngii on proliferation of human gastric cancer MGC-803 cells (n= 10)
如表3所示,2~4组与1组的吸光度相比,有显著差异(P<0.05);5、6组与1组的吸光度相比,有极显著差异(P<0.01)。结果表明,杏鲍菇菇头粗多糖在低质量浓度下(0.01 mg/mL)即可显著抑制人胃癌MGC-803细胞的生长,当质量浓度大于0.5 mg/mL后,可达到极显著的抑制效果,说明该抑制作用基本呈剂量依赖关系。
2.6 杏鲍菇菇头粗多糖的体内抗肿瘤活性分析
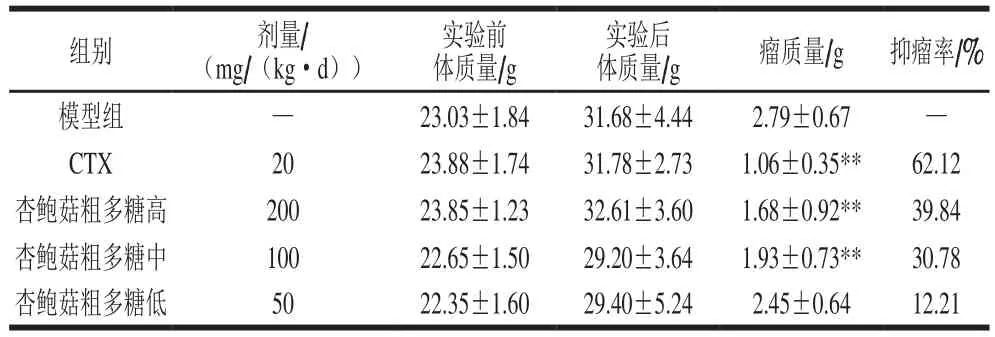
表4 杏鲍菇菇头粗多糖对U14荷瘤小鼠体质量和肿瘤质量的影响(n=10)Table 4 Effects of crude polysaccharide extracted from the stalk residue of P. eryngiion body and tumor massof U14 tumor-bearing mice (n= 10)
如表4所示,杏鲍菇菇头粗多糖的低、中、高各剂量组对U14荷瘤小鼠的抑瘤率分别达到了12.21%,30.78%和39.84%,存在明显的剂量-效应关系。中、高剂量组与模型组比较具有极显著差异(P<0.01),而低剂量组没有差异。初步判定,该粗多糖对荷瘤小鼠的体质量增加无抑制作用,安全且无副作用。
3 讨 论
杏鲍菇菇头是伴随杏鲍菇大量栽培而产生的非商品化廉价资源。从中提取粗多糖,是直接而有效利用这一加工副产物的重要方式。研究和开发杏鲍菇菇头粗多糖的生物活性,可以提升该多糖的利用价值,增加企业效益,推动相关技术的产业化。然而,目前科技水平对多糖结构的测定仍有一定困难。这主要是因为多糖的生物合成由遗传基因间接控制,不具备蛋白质严格一致的化学结构[17],而这种复杂易变的多糖分子结构容易导致其生物活性呈现多样性。对于食用菌多糖而言,其化学结构及生物活性还容易受到菌种、栽培工艺、提取方法等多种因素的影响[18],尽管如此,大量研究表明,在各个制备参数固定的条件下,多糖的结构和活性相对稳定,实验结果仍具有一定的重复性。鉴于不同研究者在不同制备条件下得到的多糖分析结论有可能存在一定的差异,仅依据少数几个研究还难以有效概括杏鲍菇菇头多糖的特性,所以很有必要进行广泛和深入的研究。
杏鲍菇菇头多糖研究方面,国内外相关的研究报道均较少,主要集中在杏鲍菇粗多糖的提取及抗氧化活性等研究。在结构研究方面,Ma Gaoxing等[6]将菇头粗多糖使用超滤法进行分级,并检测各个组分的结构和活性,结果发现,菇头粗多糖以分子质量大于100 000 Da的组分为主,占79.12%;单糖组成均以葡萄糖为主(>74.8%);该结论和本研究基本一致。与前人研究比较,本研究不仅利用GPC-RID-MALLS联用仪对菇头粗多糖分子质量分布进行更为精确的测定,而且还对其糖苷键的链接方式进行测定,进一步明确了该粗多糖一级结构的构成方式。在抗氧化性研究方面,本研究印证了前人研究结论[7],即:杏鲍菇菇头多糖对ABTS阳离子自由基具有较强的淬灭作用,表明该多糖具有显著的抗氧化性。在抗肿瘤活性研究方面,Ma Gaoxing等[6]发现:杏鲍菇菇头多糖组分对人肝癌细胞HepG-2的体外增殖生长具有显著抑制作用。Yang Zengyue等[19]通过动物实验发现,杏鲍菇子实体多糖组分具有体内抑制人肾癌Renca细胞在小鼠增殖生长的生物活性。本研究进一步发现杏鲍菇菇头粗多糖在体外对人胃癌MGC-803细胞以及体内对人宫颈癌U14细胞具有显著的抑制作用,对已有研究结果进行了印证和补充。
尽管目前有大量的研究表明:食用菌多糖具有抗氧化以及抗肿瘤等多种生物活性,但仍需进一步验证。以多糖的抗氧化活性为例,由于目前的抗氧化评价体系不完善,检测方法包括1,1-二苯基-2-三硝基苯肼、ABTS、还原力、金属螯合能力、羟自由基、超氧离子自由基等数十种[20]。这些检测方法基于各自的抗氧化体系和机理,尚无法统一为单一的检测方法[21-22]。因此,不同物质的抗氧化性只能在同一种检测方法下比较强弱,不同检测方法间则无法比较[23]。同时,多糖的体外抗氧化性也存在争议,有学者认为,单纯的多糖没有抗氧化性,粗多糖的体外氧化性主要是由其分子内部夹带的蛋白质、多酚、半乳糖醛酸等非糖组分决定的[24-25]。与多糖体外抗氧化活性广受争议相比,多糖的体内抗氧化活性似乎具有更强的说服力。多糖的抗氧化体内实验是通过测定小鼠心、肝、脾、肾组织和全血的脂质过氧化物含量、谷胱甘肽过氧化物酶及超氧化物歧化酶的活性,反映多糖对机体各组织及全血抗氧化能力的影响[26]。因此,多糖的抗氧化研究应尽量选择体内抗氧化活性检测方法,以免体外抗氧化活性因自身检测方法不够完善而导致错误结论[27-28],同时更有利于功能性食用菌多糖在食品和药品中的实际应用。此外,多糖的抗肿瘤活性检测目前大多采用体外检测方法,该方法具有方便筛查、费用低等诸多优点[29],同时适用于难以进行动物造模实验的肿瘤细胞的检测。但实际检测中发现,在进行多糖体外抗肿瘤实验时,由于在检测波长下容易受到多糖颜色深和溶解度差的干扰,将导致吸光度检测结果不准确,可能会产生假阳性或假阴性的结果。此外,体外实验还未考虑药物在动物体内消化吸收和代谢等复杂影响因素。因此,在条件允许情况下,同时开展体内抗肿瘤实验,便于印证其抗肿瘤活性[30-31]。当然,杏鲍菇菇头多糖的生物活性最终仍需通过人体临床实验进行验证。
4 结 论
杏鲍菇菇头粗多糖的结构特征:主要由葡萄糖组成(占84.4%),其分子质量分布较广且由4 个峰组成(3.816×107、2.010×106、4.572×105Da和1.849×105Da),糖苷键主要链接方式为1,3-糖苷键(占42.7%)和1,6-糖苷键(占35.5%)。生物活性研究表明该粗多糖具有一定的抗氧化和抗肿瘤活性。

