表面活性剂在生物转化法合成普鲁兰中的作用及生理机制
王大慧,巨晓敏,卫功元*
(苏州大学基础医学与生物科学学院,江苏 苏州 215123)
普鲁兰是一种由麦芽三糖经α-1,6-糖苷键聚合而成的微生物多糖,通常由出芽短梗霉(Aureobasidium pullulans)合成并分泌到胞外[1]。作为一种化学结构独特的水溶性高分子物质,普鲁兰具有良好的可塑性、成膜性和稳定性,因而可以安全地应用于食品、医药、环保和轻工等诸多领域[2-4]。2002年,普鲁兰被美国食品药品监督管理局认证为GRAS(Generally Regarded As Safe)的微生物多糖[5]。2006年5月19日,国家卫生部发布第8号公告,将普鲁兰列为新增的4种食品添加剂之一。此后,普鲁兰在市场上的需求量日益增长。
目前,普鲁兰的生物合成主要采用发酵法[1,6]。为提高普鲁兰的产量以及合成效率,科研人员分别从培养基设计、发酵条件控制、关键酶活性提升以及跨膜运输等角度对普鲁兰的合成过程进行研究,确定了一些关键的影响因素[7-9]。其中,表面活性剂的添加对于促进普鲁兰的合成具有明显的积极作用[10]。常天俊等[11]考察了吐温40、吐温60和吐温80在普鲁兰发酵生产中的作用,结果发现3 种表面活性剂均能促进细胞分泌多糖,添加0.05%吐温80时效果最好,不仅能提高约25%普鲁兰产量,而且还可以将发酵时间缩短近2 d。Sheng Long等[12-13]发现在发酵培养基中加入0.5%(体积分数)吐温80可以显著提高普鲁兰的产量,认为吐温80加速了细胞对营养物质的摄取,增加了葡萄糖基转移酶活性,提高了细胞膜脂肪酸的含量,加速了普鲁兰向胞外分泌。Tu Guangwei等[14]在培养基中添加0.05%(体积分数)吐温80,将聚苹果酸和普鲁兰的产量分别提高了75.08%和27.21%,认为吐温80提高了氧气摄取速率和CO2释放速率,上调了相关跨膜转运因子的转录水平,最终提高了联产发酵的产量。除此之外,鲜见其他表面活性剂影响普鲁兰生物合成的报道。
近年来,研究发现普鲁兰还可以利用全细胞生物转化的方法合成得到[15]。在生物转化过程中,普鲁兰合成代谢途径中的3 个关键酶α-磷酸葡萄糖异构酶(α-phosphoglucose mutase,PGM)、尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGP)和葡萄糖基转移酶(glucosyltransferase,FKS),能量物质ATP的供给与消耗速率,以及细胞膜的通透性都是决定普鲁兰能否高效合成的影响因素[16]。与调控细胞内物质和能量代谢过程的复杂性不同,增加微生物细胞膜通透性可以通过添加表面活性剂得以实现[17]。然而,表面活性剂对生物转化合成普鲁兰是否具有促进作用以及其中蕴含的生理生化机制至今不得而知。为此,本研究分析食品工业的非离子型表面活性剂斯潘和吐温对生物转化合成普鲁兰的影响,并从细胞特性、关键酶活性、胞内物质和能量代谢等角度解析表面活性剂的作用机制,研究结果将为进一步提高普鲁兰生物合成效率提供新的思路。
1 材料与方法
1.1 材料与试剂
出芽短梗霉CCTCC M 2012259,由苏州大学微生物生理与代谢调控研究室保藏。
种子培养基:采用PDA培养基。马铃薯200 g/L,葡萄糖20 g/L,自然pH值。
发酵培养基[15]:葡萄糖63.97 g/L,酵母粉3.57 g/L,(NH4)2SO40.6 g/L,NaCl 1.0 g/L,K2HPO45.0 g/L,MgSO4·7H2O 0.18 g/L,pH 6.5。
转化液:葡萄糖50 g/L,MgSO4·7H2O 0.2 g/L,pH 6.8。
磷酸葡萄糖变位酶联免疫分析测试盒 上海皓尘生物科技有限公司;尿苷二磷酸葡萄糖焦磷酸化酶联免疫分析测试盒 上海将来实业股份有限公司。
1.2 仪器与设备
1525型高效液相色谱仪 美国Waters公司;BIOTECH-5BGZ搅拌式发酵罐 上海保兴生物设备工程有限公司;HZ-2010K恒温摇瓶柜 太仓市华利达实验仪器设备有限公司;J6-MI型冷冻离心机 美国Beckeman公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;LDZX-50KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.3 方法
1.3.1 静息细胞制备
将在-70 ℃超低温冰箱中保藏的菌种(1 mL)接入装有50 mL种子培养基的500 mL三角瓶中,于30 ℃、200 r/min摇床中培养24 h获得种子。按10%(体积分数)的接种量将种子接入装有3 L发酵培养基的5 L发酵罐中,在30 ℃、400 r/min和通气量3 L/min条件下培养36 h。将发酵液12 000 r/min离心10 min,用无菌生理盐水洗涤2 次后制得静息细胞。
1.3.2 生物转化
将静息细胞均匀悬浮于装有50 mL转化液的500 mL三角瓶中,置于30 ℃、200 r/min摇床中转化24 h或48 h,初始菌体控制在10 g/L左右(按干细胞质量计)。将无任何表面活性剂添加的生物转化过程定义为空白对照。
1.3.3 细胞干质量与普鲁兰产量测定
取20 mL转化液(或发酵液),80 ℃水浴灭活15 min,冷却至室温后12 000 r/min离心10 min。细胞沉淀用蒸馏水洗涤3 次,离心后于70 ℃烘干至质量恒定,计算得到细胞干质量;取10 mL上清液,加入2 倍体积无水乙醇混匀,4 ℃处理12 h,12 000 r/min离心10 min,将沉淀于70 ℃烘干至质量恒定,计算得到普鲁兰产量。
1.3.4 普鲁兰合成能力的计算
细胞转化合成普鲁兰能力的计算方法参见文献[15]。生物转化反应24 h,取样检测普鲁兰质量浓度。将1 g静息细胞(干质量)在1 h内转化葡萄糖合成的普鲁兰质量定义为1 个普鲁兰合成能力,单位为mg/(g·h)。
1.3.5 细胞存活率的测定
分别取培养24 h和48 h的转化液,用无菌水稀释至10-5倍,取100 μL在含有PDA培养基的平板上进行涂布,30 ℃恒温培养48 h,计数并计算细胞存活率。
1.3.6 无细胞提取物的制备
取5 mL转化液,4 ℃、12 000 r/min离心10 min,生理盐水洗涤2 次后,将湿细胞重新悬浮在5 mL 0.2 mol/L磷酸缓冲溶液(pH 7.0)中,超声破碎10 min(破碎10 s,间隔10 s),4 ℃、12 000 r/min离心20 min,得到的上清液即为无细胞提取物,用于测定胞内物质含量和关键酶活性。
1.3.7 酶活性测定
FKS活性测定方法参见文献[18]。将0.2 mL含有10 mmol 4-硝基-α-D-吡啶葡萄糖苷的乙酸钠缓冲液(0.1 mol/L,pH 4.0)与0.2 mL待测酶液快速混合均匀,在40 ℃水浴中反应5 min,随后加入3 mL甘氨酸-NaOH缓冲液(0.4 mol/L,pH 10.5)终止反应。测定405 nm波长处的吸光度,由标准曲线计算产生的4-硝基酚含量。一个FKS活性单位定义为每分钟释放1 μmol 4-硝基酚所需要的酶量。
PGM活性:采用磷酸葡萄糖变位酶联免疫分析测试盒进行测定;UGP活性:采用尿苷二磷酸葡萄糖焦磷酸化酶联免疫分析测试盒进行测定,操作步骤参照试剂盒说明书执行。
1.3.8 细胞膜通透性测定
采用流式细胞仪进行检测[19-20]。将离心收集的细胞重悬于0.1 mol/L磷酸缓冲溶液(pH 7.0)中,细胞密度控制在约106个/mL。将100 μL细胞悬浮物与1 μL 2.5 mg/L碘化丙啶(propidium iodide,PI)混合,37 ℃避光孵育50 min,加入900 μL磷酸缓冲溶液混匀。利用流式细胞仪检测含有荧光探针的细胞数,激发光波长488 nm,发射光波长625 nm。细胞流速为500 个/s,计数10 000 个细胞,计算PI摄取率。
1.3.9 胞内尿苷二磷酸葡萄糖测定
胞内尿苷二磷酸葡萄糖(uridine diphosphate g l u c o s e,U D P G)利用高效液相色谱法进行检测[21]。Sigma-Aldrich Supelcosil LC-18-DB柱(4.6 mm×250 mm),流动相为40 mmol/L三乙胺-乙酸溶液(pH 6.0),流速1 mL/min,检测波长254 nm,柱温22 ℃,进样量10 µL。
1.3.10 胞内ATP和ADP测定
利用高效液相色谱法进行检测[21]。Waters 1525反相SunFire C18柱(4.6 mm×250 mm,5 µm),流动相为0.01 mol/L磷酸缓冲溶液(pH 6.5),流速1 mL/min,检测波长254 nm,柱温35 ℃,进样量10 µL。
1.4 数据统计
所有实验数据均为3 组平行样品检测结果的平均值。Excel 2010软件作图。
2 结果与分析
2.1 斯潘对生物转化合成普鲁兰的影响
向转化液中分别添加不同质量浓度的斯潘20、斯潘40、斯潘60和斯潘80,研究斯潘在生物转化合成普鲁兰中的作用。由图1可以看出,在考察的质量浓度范围内(0~20 g/L),斯潘20对细胞的普鲁兰合成能力几乎没有影响。斯潘40和斯潘60的添加降低了细胞合成普鲁兰的能力,且添加质量浓度越高,普鲁兰合成能力降低的幅度越大。斯潘80可以提高普鲁兰的合成能力,当添加质量浓度为20 g/L时,普鲁兰的合成能力提高了46.5%。因此,在底物充足供给的前提下,斯潘80可以显著提高普鲁兰的生物合成效率。
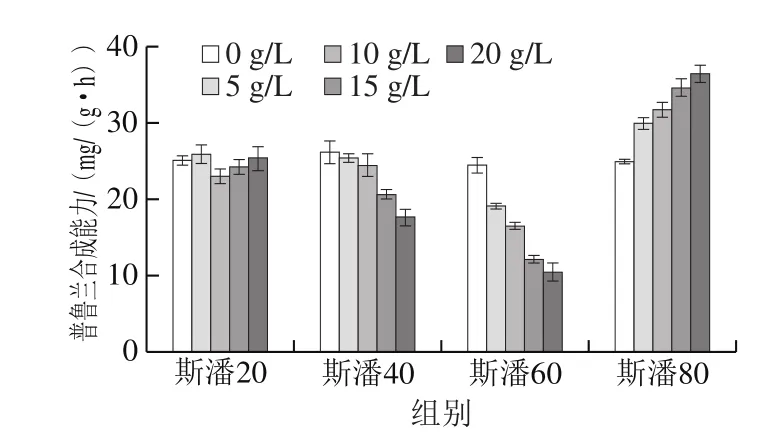
图1 斯潘对生物转化合成普鲁兰的影响Fig. 1 Effect of Span on pullulan production
2.2 吐温对生物转化合成普鲁兰的影响
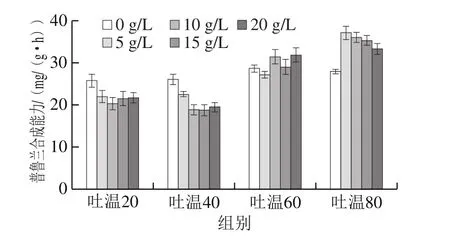
图2 吐温对生物转化合成鲁兰的影响Fig. 2 Effect of Tween on pullulan production
向转化液中添加不同质量浓度的吐温20、吐温40、吐温60和吐温80,研究吐温在生物转化合成普鲁兰中的作用,结果见图2。与对照相比,吐温20和吐温40的添加降低了细胞的普鲁兰合成能力;吐温60对生物转化的影响不显著;而吐温80则显著提高了细胞的普鲁兰合成能力。当吐温80质量浓度为5 g/L时,细胞合成普鲁兰的能力比对照提高了32.9%。同样地,当底物供给充足时,吐温80也可以明显提高普鲁兰生物合成的效率。
2.3 斯潘80和吐温80复配在生物转化合成普鲁兰中的作用
斯潘80和吐温80的分子结构中都含有失水山梨醇单油酸酯,彼此的碳氢分子链之间能够很好地相互吸引,二者复合使用时还可以增加体系的稳定性[22]。为此,将20 g/L斯潘80和5 g/L吐温80进行复配,考察其在生物转化合成普鲁兰中的作用。为便于比较,将斯潘80和吐温80单独添加后的普鲁兰产量(24 h和48 h)一并列出,结果见图3。与空白对照相比,无论是单独添加还是复配使用,斯潘80和吐温80均提高了普鲁兰产量。斯潘80和吐温80复配使用的效果最好,但是并未显示出累加效应。
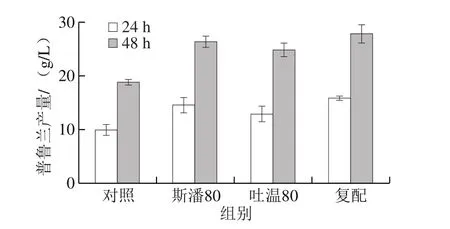
图3 斯潘80和吐温80复配对生物转化合成普鲁兰的影响Fig. 3 Separate and combined effect of Span 80 and Tween 80 on pullulan production
2.4 表面活性剂提高生物转化合成普鲁兰效率的作用机制
2.4.1 细胞存活率
部分表面活性剂与微生物长期接触会影响细胞生长,甚至会溶解细胞膜的部分成分而实现杀菌作用[23]。为考察20 g/L斯潘80、5 g/L吐温80及其复配对细胞存活率的影响,采用涂布平板的方法,对参与转化反应24 h和48 h后的细胞进行培养并计数统计,结果见表1。与生物转化反应起始时的细胞总数(2.15×108个/mL)相比,单独添加斯潘80时的活细胞数略有减少;单独添加吐温80以及复配对活细胞数影响不大。总体上,斯潘80和吐温80对细胞存活率没有显著影响。
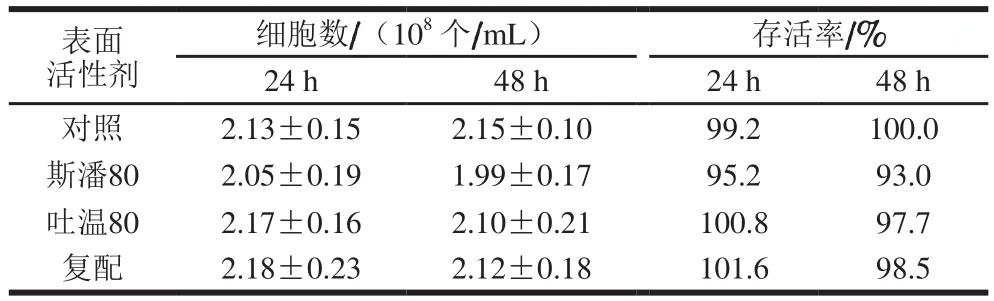
表1 表面活性剂对细胞存活率的影响Table 1 Effect of surfactants on survival rate of cells
2.4.2 细胞膜通透性
在普鲁兰的生物合成过程中,麦芽三糖单体首先在胞内合成,然后跨过细胞膜分泌到胞外并聚合成普鲁兰[1,24],所以,细胞膜通透性的大小将影响到普鲁兰合成速率的高低。采用流式细胞仪对细胞通透性进行测定,以PI摄取率定量表示细胞通透性的大小,结果见图4。与对照相比,吐温80对PI摄取率的影响很小,而斯潘80则大幅度地提高了PI摄取率(4~5 倍);复配条件下的PI摄取率与单独添加斯潘80的结果相近。由此可见,斯潘80极大地提高了细胞膜的通透性,但斯潘80和吐温80的作用没有累加性。
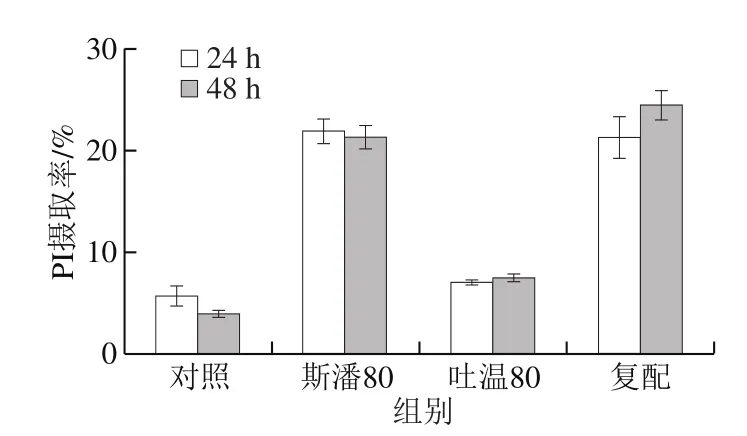
图4 表面活性剂对细胞PI摄取率的影响Fig. 4 Effect of surfactants on PI uptake of cells
2.4.3 普鲁兰合成关键酶活性分析
研究表明,吐温80在普鲁兰分批发酵过程中会提高FKS活性水平[12]。本研究考察斯潘80和吐温80对普鲁兰生物合成途径中3 种关键酶(PGM、UGP和FKS)活性的影响,结果见图5。可以发现,在转化反应第24小时,除吐温80对FKS活性没有显著影响外,其他添加条件下的PGM、UGP和FKS活性均明显高于对照。在第48小时,斯潘80单独添加仍然能提高PGM、UGP和FKS的活性,吐温80对3 种关键酶活性均无影响,复配物仅可以提高FKS活性。此外,由图5还可以看出,在转化反应的前期(24 h),PGM和UGP具有更高的活性;而在转化后期(48 h),FKS活性更高。以上酶活结果表明,在生物转化合成普鲁兰的过程中,斯潘80对关键酶活性的提高均具有积极作用,而吐温80仅在转化前期提高了PGM和UGP的活性。
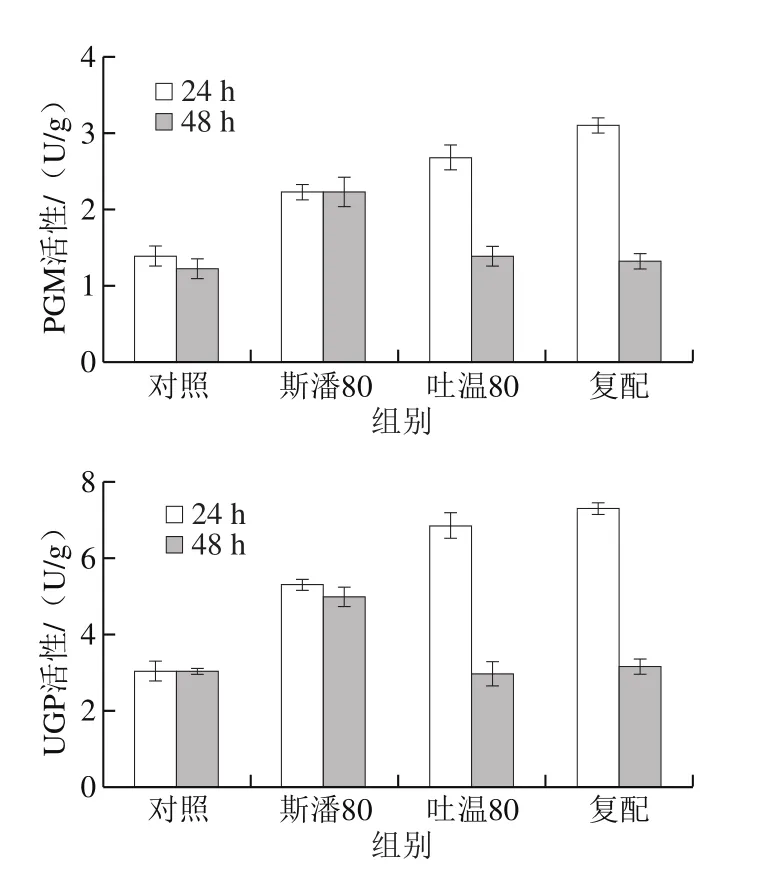
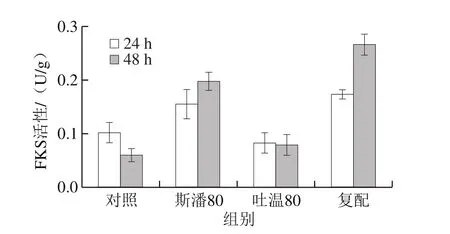
图5 表面活性剂对普鲁兰合成关键酶活性的影响Fig. 5 Effect of surfactants on activities of key enzymes involved in pullulan biosynthesis
2.4.4 胞内UDPG水平
作为普鲁兰生物合成的最重要的前体物质之一,胞内UDPG水平是事关普鲁兰能否高效合成的关键因素[1,21]。在生物转化的24 h和48 h,不同表面活性剂添加方式下的胞内UDPG含量见图6。可以发现,在底物充足的情况下,普鲁兰快速合成时(第24小时)的胞内UDPG水平比第48小时的高。与对照相比,斯潘80和吐温80分别将第24小时胞内UDPG含量提高了40.7%和102.4%。至第48小时,由于底物葡萄糖基本耗尽(数据未给出),胞内UDPG含量均下降至较低的水平(约1.2 mg/g)。
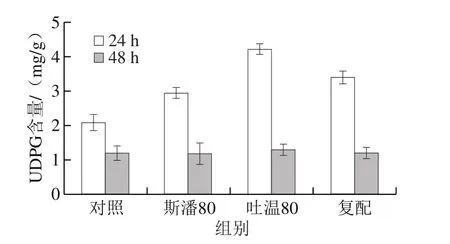
图6 表面活性剂对胞内UDPG水平的影响Fig. 6 Effect of surfactants on intracellular UDPG level
2.4.5 胞内能量代谢物质水平及比率
普鲁兰的生物合成离不开能量物质的充足供给[16]。测定不同表面活性剂添加条件下的胞内能量物质ATP和ADP含量,计算ATP/ADP比率,结果见图7。在第24小时,斯潘80和吐温80均可以提高胞内ATP含量和ATP/ADP比率,体现出比对照具有更强的ATP再生能力,最终胞内有充足的ATP供给用于普鲁兰的快速合成。特别地,吐温80在提高胞内ATP含量和再生方面发挥着更为重要的作用。至第48小时,斯潘80和吐温80虽然仍能将胞内ATP维持在较高的水平,但ATP的再生能力均低于对照。
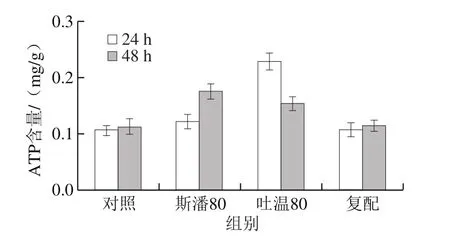
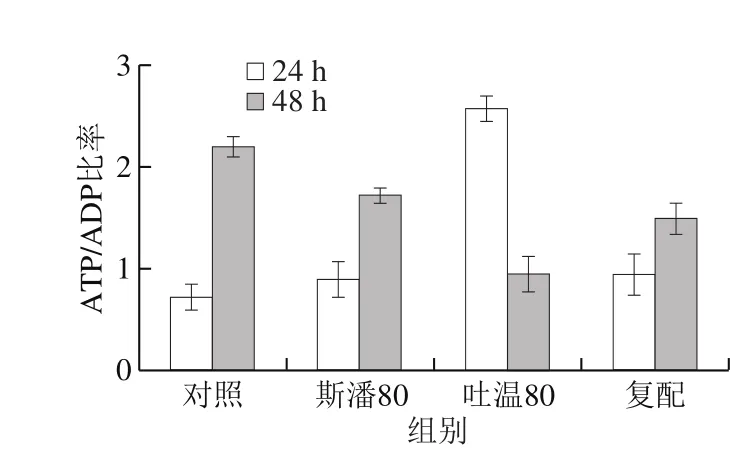
图7 表面活性剂对胞内ATP水平和ATP/ADP比率的影响Fig. 7 Effect of surfactants on intracellular ATP level and ATP/ADP ratio
3 讨 论
表面活性剂素有“工业味精”的美称,是一类用途广泛的精细化工产品,在食品、药品以及化妆品制造等领域中均有广泛应用[25]。在微生物发酵领域,表面活性剂可以通过增大细胞膜的通透性、改变酶活性调控细胞的生长和产物合成[26-29]。作为非离子型表面活性剂,斯潘和吐温常以乳化剂的形式应用于食品加工中[30]。已有文献报道表明,吐温80在普鲁兰发酵生产中对于提高目标产物的产量起到了积极作用[11-13]。本研究发现,20 g/L斯潘80和5 g/L吐温80在全细胞生物转化合成普鲁兰过程中提高了细胞合成普鲁兰的能力,同时,普鲁兰的合成效率均高于前人研究的结果[11-13]。为探究斯潘80和吐温80提高普鲁兰合成效率的生理机制,分别从细胞特性、关键酶活性、物质与能量代谢等多个角度进行了探索。
在全细胞转化过程中,将细胞始终保持在较高活性是实现高效转化的基本保障,而部分表面活性剂(如Triton X-100)却对细胞活性表现出一定的抑制作用[31]。本研究细胞存活率的结果表明,斯潘80和吐温80对细胞活性几乎没有影响,可以确保不同转化条件下的出芽短梗霉细胞均能维持正常的生理代谢。在此基础上,斯潘80和吐温80的添加提高了细胞膜的通透性,不仅有利于底物进入胞内与酶作用,还加速了胞内合成的普鲁兰跨膜向胞外分泌,进而提高了普鲁兰的合成效率。
根据出芽短梗霉合成普鲁兰的代谢途径,底物葡萄糖首先在PGM和UGP的催化下合成前体物质UDPG,然后UDPG在FKS的作用下合成麦芽三糖单体物质,最终麦芽三糖在FKS的作用下跨膜聚合形成普鲁兰[1,18,32]。因此,提高PGM和UGP的活性有利于增加胞内UDPG的供给,而提高FKS的活性将加速UDPG的消耗,最终促进普鲁兰的合成。本研究普鲁兰合成关键酶活性和胞内UDPG水平的结果表明,斯潘80和吐温80在普鲁兰合成期(24 h)均提高了PGM和UGP的活性,提升了胞内UDPG水平。特别地,斯潘80提高了FKS活性,加速了UDPG向普鲁兰的转化。由于吐温80更有利于胞内UDPG的供给,而斯潘80更有利于UDPG的消耗,因此在相同转化时间下,添加斯潘80获得的普鲁兰产量比添加吐温80的结果要高,体现出更高的普鲁兰合成效率。
与此同时,能量物质ATP的供给与消耗速率也是影响普鲁兰生物合成效率的重要因素。胞内ATP含量体现ATP合成和利用的综合结果,而ATP/ADP比率则反映ATP的再生能力[33]。本研究结果表明,吐温80在提高胞内ATP含量和促进ATP再生方面比斯潘80有更好的效果,能将胞内ATP维持在较高的水平,从而为普鲁兰的快速合成提供充足的能量供给。
斯潘80和吐温80有类似的分子结构,使得它们可以复配使用而增加效果[34]。本研究在单独添加的基础上,也考察了斯潘80和吐温80复配在生物转化合成普鲁兰中的作用,复配条件下的普鲁兰产量和合成效率只比单独添加略高,没有体现出累加效应。该结果可能与斯潘80和吐温80复配比例不当有关,有待今后进一步研究。
综上,本研究考察了多种表面活性剂在全细胞生物转化合成普鲁兰中的作用,发现在转化液中添加20 g/L斯潘80或/和5 g/L吐温80均有利于普鲁兰合成效率的提高。在此基础上,检测了细胞存活率、细胞膜通透性、普鲁兰合成关键酶活性、胞内UDPG含量以及能量代谢物质水平和比率,部分解析了斯潘80和吐温80提高普鲁兰合成效率的生理机制。研究结果为实现普鲁兰高产提供了一种可行的方法,同时也为其他类似结构微生物多糖的高效合成提供新的思路。

