体质指数与乳腺癌患者临床及病理特征的相关性分析
赵帅 李永峰
[摘要] 目的 探讨体质指数与早期乳腺癌患者临床及病理特征的相关性。 方法 回顾性收集2017年1月~2019年1月浙江省肿瘤医院乳腺外科收治的早期乳腺癌患者726例,根据体质指数(BMI)将患者分为正常组(BMI<24 kg/m2)和超重组(BMI≥24 kg/m2),分析比较两组乳腺癌患者的临床分期、病理分级和免疫组化指标[雌激素受体(ER)、孕激素受体(PgR)、人表皮生长因子受体2(Her-2)、细胞增殖核抗原(Ki-67)]的表达差异。 结果 正常组与超重组乳腺癌患者的临床分期Ⅲ期比例分别为13.8%和19.5%(P=0.041),病理分级Ⅲ级比例分别为28.5%、36.3%(P=0.028),ER阳性率分别为67.0%、75.7%(P=0.012),Her-2阳性率分别为24.7%、32.5%(P=0.020),以上两组间各指标比较,差异均有统计学意义。两组乳腺癌患者的PgR、Ki-67阳性率比较,差异无统计学意义(P>0.05)。 结论 在早期乳腺癌患者中,肥胖与更高的临床分期、病理分级相关,且肥胖患者ER、Her-2指标阳性表达率更高,控制体重在乳腺癌的预防中具有重要意义。
[关键词] 体质指数;乳腺癌;临床分期;病理分级;免疫组化
[中图分类号] R737.9 [文献标识码] A [文章编号] 1673-9701(2019)26-0009-04
[Abstract] Objective To investigate the correlation between body mass index and clinicopathological features of patients with early breast cancer. Methods A total of 726 patients with early breast cancer admitted to the Breast Cancer Surgery Department of Zhejiang Cancer Hospital from January 2017 to January 2019 were retrospectively collected. They were divided into normal group (BMI<24 kg/m2) and overweight group(BMI≥24 kg/m2) according to body mass index (BMI). The differences in the clinical stage, pathological grade and immunohistochemical index (ER, PgR, Her-2, Ki-67) between the two groups of breast cancer patients were analyzed. Results Clinical stage Ⅲ proportion of the normal group and overweight group were 13.8% and 19.5%, respectively(P=0.041), and the pathological grade Ⅲ ratios were 28.5% and 36.3%, respectively (P=0.028), The ER positive rates were 67.0% and 75.7%, respectively (P=0.012), and the positive rates of Her-2 were 24.7% and 32.5%, respectively(P=0.020), there were significant differences in each index between the two groups. There was no statistical difference in the positive rates of PgR and Ki-67 between the two groups(P>0.05). Conclusion In patients with early breast cancer, obesity is associated with higher clinical stage and pathological grade, and the positive expression rate of ER and Her-2 indicators in obese patients is higher. And weight control is an great significancein the prevention of breast cancer.
[Key words] Body mass index; Breast cancer; Clinical stage; Pathological grade; Immunohistochemistry
2018年全球癌癥统计数据表明乳腺癌仍高居女性癌症发病率第一位[1]。而随着我国人民生活水平的提高和饮食习惯的改变,肥胖成为越来越普遍的亚健康疾病。许多研究已证实肥胖与乳腺癌的发病和预后密切相关[2,3]。过高的体质指数会增加乳腺癌的发病风险,也使乳腺癌患者预后较差[4,5]。因此,肥胖与乳腺癌患者的关系值得深入研究和探讨。
既往的研究发现,由于堆积的脂肪组织创造了有利于肿瘤细胞生长的炎症肿瘤微环境,同时影响血性激素结合蛋白和雌激素水平,肥胖间接地“操纵”着乳腺癌患者的疾病进展,使患者预后较差[6,7]。但是临床经验表明,肿瘤的临床分期、病理分级和分子分型等生物学信息与乳腺癌患者的预后关系更为密切。不同肿瘤亚型的乳腺癌患者复发风险不同,因此,临床治疗决策不同,预后也有明显差异。如三阴性乳腺癌,其预后明显差于腔面型乳腺癌[8]。肥胖是否与乳腺癌患者的临床分期、病理分级和分子分型有关,从而影响患者的治疗效果与预后,是一个值得研究的问题。
目前,国际上对于肥胖与乳腺癌患者病理分级和肿瘤亚型等生物学信息的相关性研究还很少。本研究收集了浙江省726例早期乳腺癌患者病例,根据体质指数(BMI)将患者分为正常组(BMI<24 kg/m2)和超重组(BMI≥24 kg/m2),分析两组乳腺癌患者间有无临床分期、病理分级和免疫组化指标的分布差异。现报道如下。
1 资料与方法
1.1 一般资料
回顾性收集2017年1月~2019年1月在浙江省肿瘤医院乳腺外科接受治疗的早期乳腺癌患者726例。纳入标准:①女性患者;②组织病理学诊断为浸润性乳腺癌;③按美国国立综合癌症网络(NCCN)乳腺癌管理指南接受规范治疗;④病例各项随访资料完整。排除标准:①合并有其他部位恶性肿瘤者;②初诊时发现远处转移的患者。
1.2 方法
体质指数(BMI)=体重(kg)/身高2(m2)。参考《中国成人超重和肥胖症预防控制指南》,以BMI值“24 kg/m2”作为中国成人超重的界限,基于BMI数值将患者分为两组,正常组(BMI<24 kg/m2)和超重组(BMI≥24 kg/m2)。根据病历收集两组患者的年龄、月经状态、肿瘤家族史、基础疾病等一般信息,根据术后病理报告收集患者的肿瘤大小(T)、淋巴结转移(N)、病理分级和分子分型特征,如雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PgR)、人表皮生长因子受体2(human epidermal growth factor receptor-2,Her-2)、细胞增殖核抗原(nuclcar-associated antigen Ki-67,Ki-67)。根据美国癌症联合委员会(AJCC)乳腺癌分期系统(第7版),将患者分为Ⅰ/Ⅱ/Ⅲ期(按入组标准,本项研究未纳入0或Ⅳ期患者)。根据中国抗癌协会乳腺癌诊治指南与规范(2017版),ER、PgR、Ki-67表达的判定值采用报告阳性细胞的百分比。以肿瘤细胞核阳性染色≥1%作为ER阳性的判定标准,以≥20%作为PgR阳性的判定标准,以≥20%作为Ki-67阳性的判定标准。Her-2检测结果1+判定为阴性,3+判定为阳性,2+患者进一步行原位杂交检测以确定阴性或阳性。
1.3 统计学方法
数据录入与整理软件采用Microsoft Excel 2010,采用SPSS 19.0统计学分析软件进行数据分析。根据Cut-off值将计量资料进行分类,转化为计数资料,以率(%)表示,采用χ2检验,计量资料用均数±标准差(x±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组早期乳腺癌患者临床特征比较
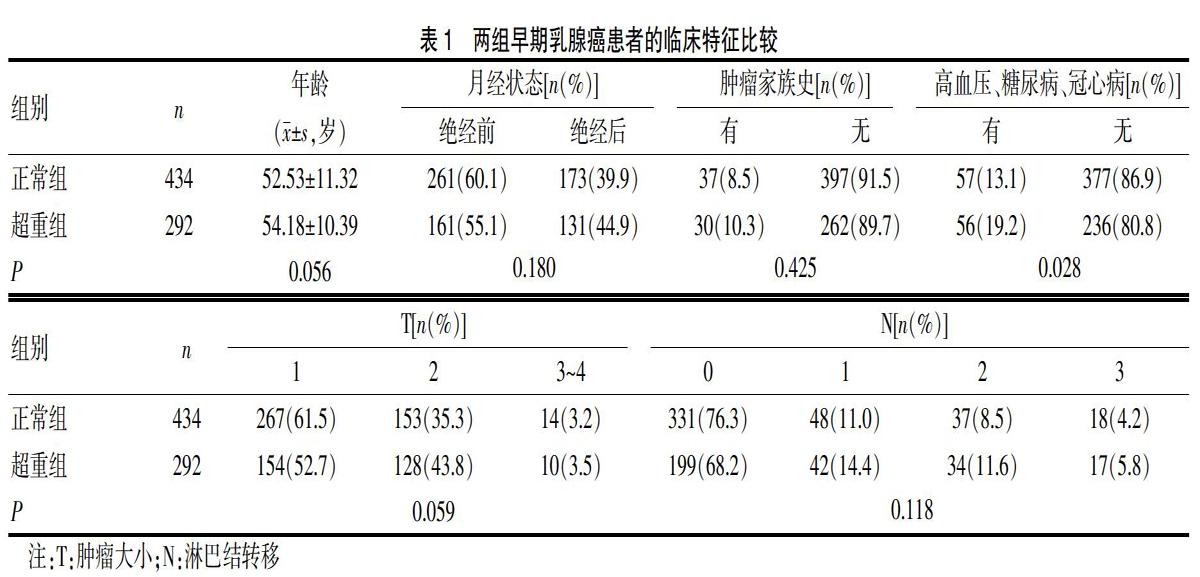
本研究共计纳入726例早期原发乳腺癌患者,其中正常组(BMI<24 kg/m2)434例,占59.8%;超重组(BMI≥24 kg/m2)292例,占40.2%。两组乳腺癌患者的年龄、月经状态、肿瘤家族史等基本资料比较,差异无统计学意义(P>0.05),且两组患者的肿瘤大小(T)、淋巴结转移(N)比较,差异无统计学意义(P>0.05);超重组乳腺癌患者罹患高血压、糖尿病、冠心病等基础疾病的比例高于正常组(P<0.05)。见表1。
2.2 两组早期乳腺癌患者免疫组化指标、临床分期、病理分级比较
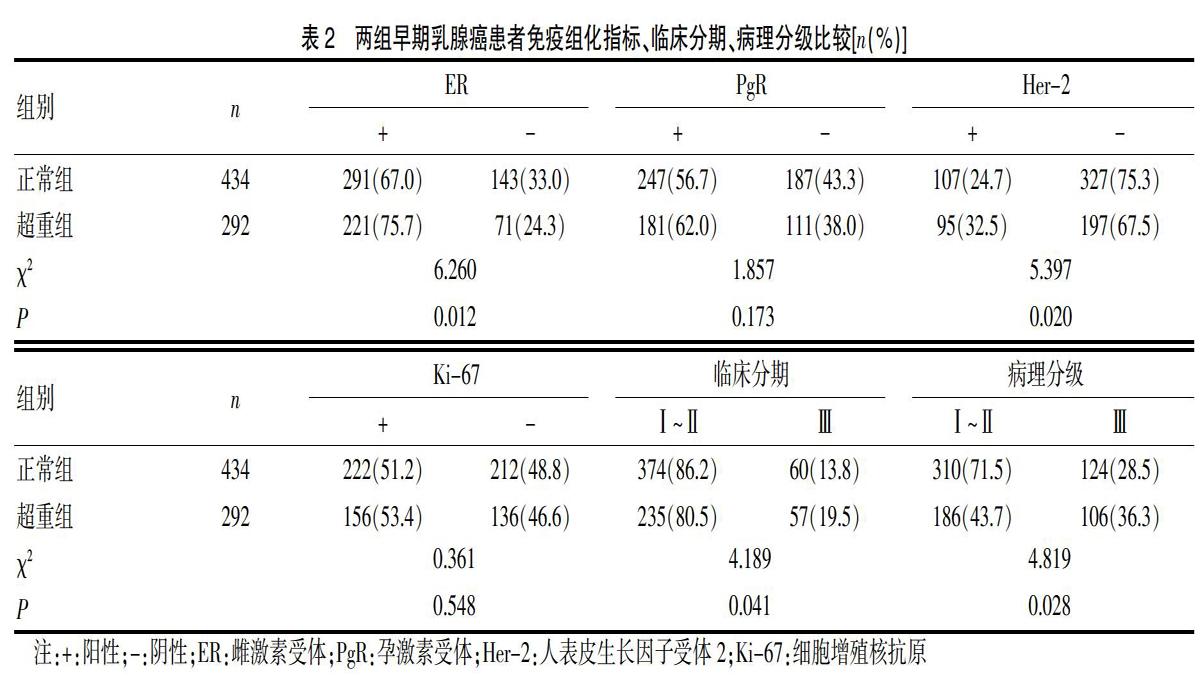
体重正常组中ER阳性患者共291例(占67.0%),超重组中ER阳性患者221例(占75.7%)。两组比较,差异有统计学意义(χ2=6.26,P=0.012);体重正常组中Her-2阳性患者共107例(占24.7%),超重组中Her-2阳性患者95例(占32.5%)。两组比较,差异有统计学意义(χ2=5.397,P=0.020)。体重正常组与超重组间PgR与Ki-67阳性表达情况比较,差异无统计学意义(P>0.05)。体重正常组中临床分期Ⅰ~Ⅱ期患者共374例(占86.2%),Ⅲ期患者60例(占13.8%),超重組中临床分期Ⅰ~Ⅱ期患者共235例(80.5%),Ⅲ期患者57例(占19.5%)。两组比较,差异有统计学意义(χ2=4.189,P=0.041)。体重正常组中病理分级Ⅰ~Ⅱ级患者共310例(占71.5%),Ⅲ级患者124例(占28.5%),超重组中病理分级Ⅰ~Ⅱ级患者共186例(占43.7%),Ⅲ级患者106例(占36.3%),两组比较,差异有统计学意义(χ2=4.819,P=0.028)。见表2。
3 讨论
本研究发现在纳入研究的726例患者中,超重组具有更高的ER、Her-2阳性表达率,且TNM临床分期、病理学分级较体重正常组更高,提示BMI超重的早期乳腺癌患者可能在初治时有更多不良预后因素,由此导致超重的乳腺癌患者预后不佳。
众所周知,脂肪组织能够分泌芳香化酶将雄烯二醇转化为雌二醇,这条通路也被认为是绝经后女性体内雌激素的主要来源[9]。同时,过多的脂肪组织会增加女性体内芳香化酶的活性,进一步加强转化效率[10]。两者的结合效应使肥胖患者体内的雌激素水平较正常人更高,因此表现出更高的雌激素受体阳性率。而雌激素水平升高会刺激乳腺肿瘤细胞的生长与增殖[11]。在既往的临床实践中发现,激素受体(HR)阳性的乳腺癌患者具有显著的长期复发风险,即使完成了5年的内分泌辅助治疗,早期乳腺癌患者5~20年的远期复发率仍达14%[12]。提示在肥胖的乳腺癌患者中,有必要延长辅助内分泌治疗的时间,以达到较好的预后获益[13]。
本研究发现超重的乳腺癌患者表现出较高的Her-2阳性表达率,其可能形成机制为受到组织中瘦素的调节作用[14]。临床上肥胖症患者多有不同程度的循环瘦素浓度升高,提示体内脂肪比例与瘦素的基线水平呈正相关[15]。人表皮生长因子受体(HER)家族属于酪氨酸激酶的跨膜蛋白受体,包括HER1(erbB1,EGFR)、HER2(erbB2,NEU)、HER3(erbB3)及HER4(erbB4)四个成员[16]。有研究已证明瘦素与ErbB酪氨酸激酶受体的相互作用有关,瘦素能够促进ErbB受体形成同源或异二聚体,从而激活PI3K/AKT和RAS/RAF/MEK/MARK通路,诱发乳腺癌细胞的增殖与生长[17-19]。提示对于体重超重的乳腺癌患者,在传统的曲妥珠单抗靶向治疗的基础上,添加帕妥珠单抗双靶向治疗也许是值得考虑的治疗方法。
本研究發现在体重超重的乳腺癌患者中,TNM临床分期Ⅲ期和病理分级Ⅲ级的比例较正常体重组更高。这一临床特征可能归因于以下多个因素:首先,肥胖患者往往乳腺组织体积较大且脂肪比例高,客观上增加了乳腺肿块早期触诊检出的难度。而我国女性每年常规钼靶、B超筛查乳腺癌的普及率仍不高,导致肥胖女性因自检触及乳腺肿块就医时,肿块体积已达2 cm以上。其次,肥胖患者较正常患者更易发生淋巴结转移。Kaviani A等[20]分析了646例乳腺癌患者,发现肥胖的乳腺癌患者检出腋窝淋巴结转移数目更多(P=0.017)。Boivin L等[21]对1599例乳腺癌患者数据分析后也得到相同的结论,高BMI乳腺癌患者的肿瘤体积更大,淋巴结转移分期更高,差异有统计学意义(P<0.05)。总上,由于乳腺癌肿瘤细胞受到体内更高水平的雌激素刺激,且Her-2阳性表达率高,因此局部的肿瘤微环境决定了肥胖患者更易发生乳腺癌细胞增殖与淋巴转移,也促使肿瘤细胞向更恶性的病理学类型分化[22,23]。研究结果再次提示了肥胖女性非常有必要进行每年的乳腺癌筛查,即使罹患乳腺癌,也能因早诊早治达到较好的预后效果。
本研究仍存在一定的局限性。首先,本研究选取的病例主要来源于浙江地区单中心三甲医院,由于地域经济发展与卫生医疗水平差异,本研究样本或不能代表全国乳腺癌流行现状。其次,本研究的样本未进行由绝经前/绝经后分层的亚组分析,这在某种程度上会对结论产生影响。同时需指出,本研究未纳入预后分析,体质指数与乳腺癌患者OS/DFS等预后指标的相关性仍有待进一步随访研究。
综上所述,在早期乳腺癌患者中,肥胖与更高的临床分期、病理分级相关,且肥胖患者有更高的ER、Her2指标阳性表达率,控制体重在乳腺癌预防中具有重要意义。
[参考文献]
[1] Ferlay J,Colombet M,Soerjomataram I,et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. Int J Cancer,2019, 144(8):1941-1953.
[2] Garcia-Estevez L,Moreno-Bueno G. Updating the role of obesity and cholesterol in breast cancer[J]. Breast Cancer Res,2019,21(1):35.
[3] Lee K,Kruper L,Dieli-Conwright CM,et al .The Impact of Obesity on Breast Cancer Diagnosis and Treatment[J]. Curr Oncol Rep,2019,21(5):41.
[4] Ecker BL,Lee JY,Sterner CJ,et al. Impact of obesity on breast cancer recurrence and minimal residual disease[J]. Breast Cancer Res,2019,21(1):41.
[5] Burkheimer E,Starks L,Khan M,et al. The impact of obesity on treatment choices and outcomes in operable breast cancer[J]. Am J Surg,2019,217(3):474-477.
[6] Kang C,LeRoith D,Gallagher EJ. Diabetes,Obesity,and Breast Cancer[J]. Endocrinology,2018,159(11):3801-3812.
[7] Moore AH,Trentham-Dietz A,Burns M,et al. Obesity and mortality after locoregional breast cancer diagnosis[J].Breast Cancer Res Treat,2018,172(3):647-657.
[8] Walsh EM,Shalaby A,O'Loughlin M,et al. Outcome for triple negative breast cancer in a retrospective cohort with an emphasis on response to platinum-based neoadjuvant therapy[J]. Breast Cancer Res Treat,2019,174(1):1-13.
[9] Hutchinson L. Prevention: Low-fat diet linked to decline in breast cancer mortality[J]. Nat Rev Clin Oncol,2017, 14(9):526.
[10] Slomski A. Low-Fat Diet Reduces Mortality After Breast Cancer[J]. JAMA,2017,318(12):1099.
[11] Kulkoyluoglu-Cotul E,Arca A,Madak-Erdogan Z. Cross-talk between Estrogen Signaling and Breast Cancer Metabolism[J]. Trends Endocrinol Metab,2019,30(1):25-38.
[12] Chlebowski RT,Pan K. Adjuvant Endocrine Therapy for Premenopausal Breast Cancer[J]. N Engl J Med,2018,379(17):1684.
[13] Anderson GM. Breast-Cancer Recurrence after Stopping Endocrine Therapy[J]. N Engl J Med,2018,378(9):870.
[14] Ando S,Gelsomino L,Panza S,et al. Obesity,Leptin and Breast Cancer: Epidemiological Evidence and Proposed Mechanisms[J]. Cancers(Basel),2019,11(1):33-37.
[15] Francisco V,Pino J,Campos-Cabaleiro V,et al. Obesity,Fat Mass and Immune System:Role for Leptin[J]. Front Physiol,2018,9(2):640.
[16] Giannone G,Milani A,Geuna E,et al. What is the best pharmacotherapeutic strategy for HER-2 positive breast cancer?[J]. Expert Opin Pharmacother,2019,20(1):5-9.
[17] Kim HG,Jin SW,Kim YA,et al. Leptin induces CREB-dependent aromatase activation through COX-2 expression in breast cancer cells[J]. Food Chem Toxicol,2017, 106(4):232-241.
[18] Crean-Tate KK,Reizes O. Leptin Regulation of Cancer Stem Cells in Breast and Gynecologic Cancer[J]. Endocrinology,2018,159(8):3069-3080.
[19] Zahid H,Subbaramaiah K,Iyengar NM,et al. Leptin regulation of the p53-HIF1alpha/PKM2-aromatase axis in breast adipose stromal cells: a novel mechanism for the obesity-breast cancer link[J]. Int J Obes (Lond),2018,42(4):711-720.
[20] Kaviani A,Neishaboury M,Mohammadzadeh N,et al. Effects of obesity on presentation of breast cancer, lymph node metastasis and patient survival: a retrospective review[J]. Asian Pac J Cancer Prev,2013,14(4):2225-2229.
[21] Boivin L,Diguisto C,Chas M,et al. Outcomes of patients with breast cancer in function of their body mass index[J].Gynecol Obstet Fertil Senol,2017,45(4):215-223.
[22] Kolb R,Kluz P,Tan ZW,et al. Obesity-associated inflammation promotes angiogenesis and breast cancer via angiopoietin-like 4[J]. Oncogene,2019,38(13):2351-2363.
[23] Adamczyk A,Grela-Wojewoda A,Domagala-Haduch M,et al. Proteins Involved in HER2 Signalling Pathway,Their Relations and Influence on Metastasis-Free Survival in HER2-Positive Breast Cancer Patients Treated with Trastuzumab in Adjuvant Setting[J]. J Cancer,2017, 8(1):131-139.
(收稿日期:2019-04-28)

