镁对槟榔幼苗光合特性和叶绿体超微结构的影响
李 佳,曹先梅,刘立云,牛启祥
(中国热带农业科学院椰子研究所,海南文昌 571339)
槟榔 (Areca catechu L.) 为棕榈科槟榔属多年生植物,是重要的热带经济作物,具有抗氧化、抗菌和助消化等重要的药用价值[1]。近年来,随着生产上氮、磷、钾化肥用量的增加和有机肥用量的减少,槟榔叶片缺镁现象在海南槟榔主产区普遍存在[2],且呈逐年加重的趋势,已成为阻碍槟榔产量和品质提高的重要因素之一。镁是植物叶绿体的重要组成成分,对维持叶绿体的结构有着举足轻重的作用[3]。同时,镁还是植物体内多种酶的活化剂,在植物进行光合作用[4]、呼吸作用[5]、糖酵解、三羧酸循环[6]等过程中发挥着关键作用。目前有关镁对植物光合特性的研究主要集中在龙眼[7]、菜豆[8]、菜薹[9]、葡萄[10]、水稻[11]和脐橙[12]等方面,研究表明,在缺镁状态下,植物的光合色素含量下降,同时叶绿体结构会受到破坏,从而导致净光合速率和叶绿素荧光动力学参数[Fv/Fm和Y(Ⅱ)]的降低。目前有关镁对槟榔光合特性以及叶绿体结构的影响尚未见报道。因此,本试验以槟榔幼苗为材料,研究不同供镁水平对槟榔叶绿素荧光特性、叶绿体超微结构、非结构性碳水化合物含量以及相关酶活性的影响,以期探明缺镁加重槟榔叶片光抑制现象的生理机制,为槟榔的平衡施肥技术和高产优质栽培提供理论依据。
1 材料与方法
1.1 试验材料
试验于中国热带农业科学院椰子研究所温室大棚内进行。供试品种为三叶龄‘热研1 号’槟榔幼苗,选用形态一致且生长良好的幼苗定植于直径为16 cm,高度为22 cm 的塑料苗盆中,每盆定植1 株。盆中基质由石英砂、珍珠岩和蛭石按体积1∶1∶1 混合而成,每盆基质干重为1 kg,盆底放托盘,自然光照条件下培养。
1.2 试验设计
MS 完全营养液配方为:NH4NO320 mmol/L、KH2PO41.25 mmol/L、KNO318 mmol/L、CaCl2·2H2O 3 mmol/L、ZnSO4·7H2O 0.03 mmol/L、MgSO4·7H2O 1.5 mmol/L、H3BO30.1 mmol/L、KI 5 μmol/L、MnSO4·H2O 0.1 mmol/L、Fe-EDTA 0.1 mmol/L、CuSO4·5H2O 0.1 μmol/L、Na2MoO4·2H2O 1.03 μmol/L、CoCl2·6H2O 1.05 μmol/L、pH 值5.8~6.0。试验用营养液为完全营养液配方的1/2 浓度。试验设3 个镁水平,即缺镁 (-Mg,0 mmol/L)、正常供镁(CK,0.75 mmol/L) 和高镁 (+Mg,2.25 mmol/L),每个水平处理20 盆。其中缺镁处理组为了维持离子浓度的平衡和避免硫元素的缺乏以添加Na2SO4替代MgSO4·7H2O。试验处理期间,每3~4 天给试验盆补浇400 mL 营养液,每2 周用去离子水洗盐1 次,防止盐分积累。试验处理5 个月后进行各项指标的测定。
1.3 测定指标及方法
1.3.1 地上部与地下部镁含量的测定 将槟榔植株分为地上与地下两部分,样品先用自来水冲洗干净,再用超纯水冲洗。于105℃烘箱中杀青30 min,然后在75℃下烘干至恒重。将样品进行粉碎后过0.149 mm 筛,经硫酸-高氯酸消煮后,用原子吸收分光光度法测定[13]。
1.3.2 相对叶绿素含量测定 采用日本Konica 公司生产的SPAD-502 叶绿素测定仪测定槟榔相对叶绿素含量,选取各植株顶端完全展开、成熟的第二片叶,在叶片主脉两侧从叶尖到叶基部均等测6 个点,取其平均值,测定前用标准色板校正仪器基准数值。
1.3.3 非结构性碳水化合物含量以及酶活性的测定 选取槟榔植株顶端往下数第二片叶,进行非结构性碳水化合物含量及酶活性的测定。可溶性总糖、蔗糖以及淀粉的提取采用80%乙醇在80℃水浴条件下浸提2 次,根据Garcia-Luis 等[14]的方法进行含量测定,以蒽酮-硫酸溶液为空白对照,分别在620 nm、480 nm、620 nm 进行比色,并计算含量。按北京索莱宝生物科技有限公司生产的试剂盒说明书测试能够蔗糖合成酶 (SS)、蔗糖磷酸合成酶 (SPS) 活性,以生成1 μg/min 蔗糖为1 个酶活力单位 (U)。
1.3.4 叶绿素荧光参数测定 挑选正常光照的实验日,选取槟榔植株顶端往下数第2 片叶,利用德国WALZ 公司生产的PAM-2500 便携式荧光仪于上午9:00—11:00 测定初始荧光 (Fo)、最大荧光 (Fm) 和PSⅡ最大光能转化效率 (Fv/Fm)、PSⅡ实际光化学量子产量[Y(Ⅱ)]、光化学淬灭系数 (qP) 和非光化学淬灭系数 (NPQ),测定前叶片暗适应20 min。每个处理重复3 株,每株重复测2~3 次。
1.3.5 叶绿体超微结构 取槟榔幼苗顶端第2 片叶叶尖到叶基的中间部位 (避开叶脉),切成1 mm × 2 mm 大小的样块,放入0.1 mol/L 磷酸缓冲液 (pH 7.4)配制成的5%戊二醛溶液的固定液中,后将样品在1%锇酸和0.1 mol/L 磷酸缓冲液 (pH 7.4) 室温 (20℃)固定5 h,用0.1 mol/L 磷酸缓冲液洗3 次,经不同浓度酒精脱水,丙酮过渡,最后用环氧树脂Epon812包埋。包埋后的材料用Leica UC7 型超薄切片机切片,经醋酸双氧铀和枸橼酸铅染色后,于HT7700 型电镜下观察、拍照。
1.4 数据处理
采用Excel 2010 软件进行数据统计分析,用SPSS 软件对数据进行单因素方差(one-way ANOVA)分析,利用Duncan 检验法进行差异显著性检查(P <0.05)。
2 结果与分析
2.1 不同供镁水平对槟榔幼苗叶片镁含量的影响
从表1 看出,槟榔幼苗地上部、地下部镁含量在不同供镁水平下具有差异显著,其地下部镁含量高于地上部,随着供镁浓度的提高,植株镁含量呈上升的趋势。与对照相比,缺镁处理组槟榔地上部、地下部分别降低了32.4%、38.7%,而高镁组槟榔地上部、地下部分别提高了34.2%、18.7%。
2.2 不同供镁水平对槟榔幼苗叶片相对叶绿素及非结构性糖含量的影响
由图1 可知,随着供镁浓度的升高,槟榔叶片相对叶绿素含量呈增加趋势。与对照相比,缺镁处理组SPAD 值显著降低了30.8%,而高镁处理组SPAD 值与对照组差异不显著。
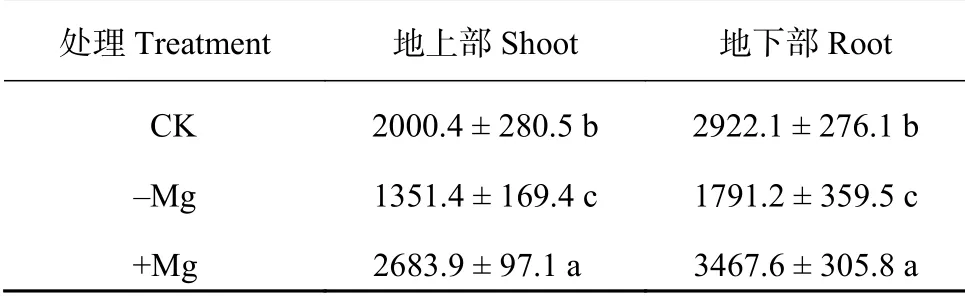
表 1 不同供镁水平槟榔幼苗各部位镁含量 (mg/kg)Table 1 Mg contents in shoot and root of areca palm under different Mg concentrations
非结构性碳水化合物在植物代谢中占据着重要的地位,它们是光合作用的主要产物,其组分的含量反映了植物碳水化合物的供应情况[15]。由图1 可看出,在缺镁条件下,槟榔叶片的可溶性糖、蔗糖含量均显著升高,分别较对照组提高了22.7%、30.9%;而淀粉含量较对照组降低了31.3%;在高镁条件下,淀粉含量显著高于对照组,较对照组提高了17.5%,但可溶性糖和蔗糖含量与对照差异不显著。
2.3 不同供镁水平对槟榔幼苗叶片蔗糖合成酶(SS) 和蔗糖磷酸合成酶 (SPS) 的影响
SS 和SPS 是蔗糖代谢过程中两种关键酶,SPS是控制叶片中蔗糖合成的关键酶,其活性的高低直接影响可溶性糖含量及对库端的供应能力[16]。SS 分解蔗糖生成腺苷二磷酸葡萄糖和果糖,用来合成淀粉等碳水化合物[16]。由图2 可看出,缺镁组槟榔叶片SS 活性较对照组降低了39.1%,而高镁组较对照升高了16.9%,但三个处理组SPS 活性差异不显著。
2.4 不同供镁水平对槟榔幼苗叶片叶绿素荧光参数的影响
由表2 可知,缺镁处理导致槟榔叶片光系统Ⅱ(PSⅡ) 的最大光化学效率Fv/Fm、实际光化学效率Y(Ⅱ)和光化学淬灭系数qP 显著降低,分别较对照降低了20.3%、43.9%和13.5%,而非光化学淬灭系数NPQ 与对照差异不显著。高镁处理组槟榔叶片qP 较对照升高了6.7%,但Fv/Fm、Y(Ⅱ)和NPQ 与对照差异不显著。以上结果说明缺镁胁迫对槟榔幼苗光合作用的影响显著,且大于镁过量胁迫,缺镁处理槟榔幼苗叶片易发生光抑制,从而产生光伤害。
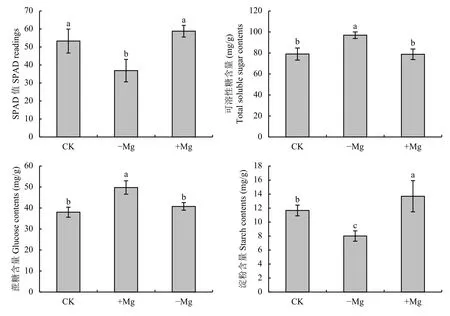
图 1 不同供镁水平下槟榔幼苗叶片相对叶绿素与糖类物质含量Fig. 1 Relative chlorophyll and carbohydrates contents in areca palm leaves under different Mg treatments
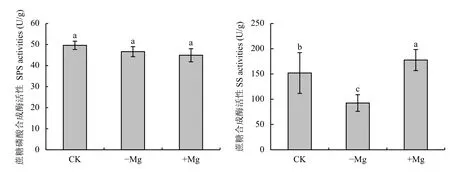
图 2 不同供镁水平下槟榔幼苗叶片蔗糖合成酶和蔗糖磷酸合成酶活性Fig. 2 Activities of sucrose and sucrose phosphate synthase in areca palm leaves under different Mg treatments
2.5 不同供镁水平对槟榔幼苗叶片叶片叶绿体超微结构的影响
由图3 可知,不同供镁水平处理对槟榔叶绿体超微结构具有明显的影响。正常镁对照处理组槟榔叶片叶绿体发育良好,结构完整,呈规则的梭形,紧贴着细胞壁,基粒、基质片层清晰,基粒类囊体垛叠多且排列致密整齐,叶绿体内富含大的淀粉颗粒(图3-A、B);在缺镁条件下,叶绿体膜解体,基粒片层大部分消失,类囊体片层结构断裂,噬锇颗粒数目增多,且大部分叶绿体中不含有淀粉颗粒 (图3-C、D);在高镁条件下,叶绿体形状发生变形,形状不规则,有的呈圆球形,基粒片层部分消失,噬锇颗粒和淀粉粒较对照增多,散乱地分布在胞质中 (图3-E、F)。以上结果说明,适宜的Mg2+浓度对维持叶绿体结构具有重要的作用,Mg2+过少时叶绿体结构会遭到破坏,淀粉颗粒明显减少,说明其光合作用受到了严重的影响;Mg2+过多时叶绿体结构虽然会发生变化,但淀粉颗粒明显增多,说明仍可以进行正常的光合作用。

表 2 不同供镁水平下槟榔幼苗叶片叶绿素荧光参数Table 2 Chlorophyll fluorescence parameters in areca palm leaves affected by different Mg treatments
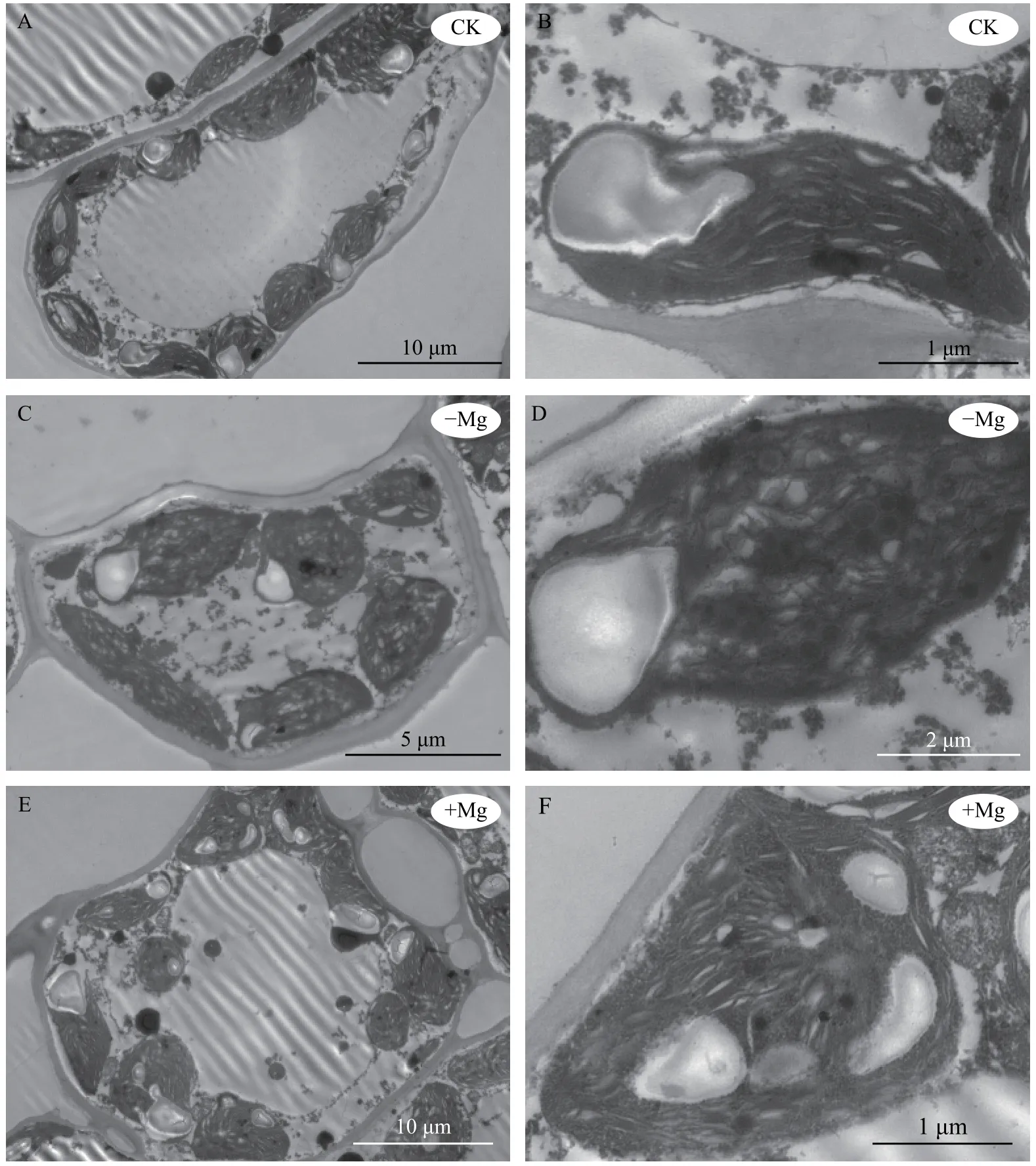
图 3 不同镁水平处理对槟榔叶片叶绿体超微结构的影响Fig. 3 Effects of different magnesium concentrations on chloroplast ultrastructure of areca palm leaves
3 讨论
镁是植物生长发育所必需的营养元素,在植物体内主要通过韧皮部进行运输[17]。本试验结果表明,槟榔植株镁含量与供镁浓度呈正相关关系,这与在葡萄[11]和黄瓜[18]上的研究结果一致。镁是构成叶绿素的中心元素,其含量与相对叶绿素呈极显著相关[19]。植物叶片叶绿素荧光动力学参数与光合色素的含量及光合作用中的各个反应过程有着紧密联系,目前已被广泛应用到植物逆境生理研究的领域中[20-22]。对菜心[10]、葡萄[11]和黄瓜[18]的研究表明,叶片叶绿素a、叶绿素b、类胡萝卜素含量会随着供Mg 的减少而逐渐降低。Fv/Fm和Y(Ⅱ)反映了光系统Ⅱ (PSⅡ)反应中心利用所捕获激发能的情况。本研究表明,缺镁导致了槟榔叶片SPAD 值、Fv/Fm、Y(Ⅱ)显著下降 (图1、表1),表明槟榔叶片受到了严重的光抑制,造成叶片量子产量降低,阻碍光合电子传递,进而降低光合效率;而在高镁条件下,槟榔SPAD值、Fv/Fm和Y(Ⅱ)与对照相比差异不显著 (图1、表1),苏仲等[23]研究指出高镁也会造成叶片量子产量降低,但在本研究中并没有体现,这可能跟植株内镁的含量有关,虽然高镁组槟榔镁含量显著高于正常镁处理组,但其镁含量仍处于一个中等水平,说明了试验设置的高镁 (为对照Mg 浓度的3 倍) 未达到抑制槟榔光合作用的水平。植物在捕获的光能超过光合作用所需要的能量时,过多的激发能会以热能的形式耗散掉,从而保护光合系统免受破坏。缺镁组槟榔叶片光化学淬灭系数qP 显著低于高镁组和对照组,而非光化学淬灭系数NPQ 则无显著差异,表明在强光下缺镁叶片有较多的激发能没有用于光化学反应。Goss 等[24]研究表明,非光化学淬灭系数反映了依赖叶黄素循环的非辐射能量耗散途径的强弱,叶黄素循环主要依赖跨类囊体膜的pH 梯度,在强光下由H2O 光解产生大量的H+以降低类囊体腔的pH 值,从而启动叶黄素循环。本研究结果显示,缺镁组qP 下降的同时,NPQ 并没有显著上升 (表1),说明过剩的激发能未能通过非光化学淬灭途径有效的耗散。Mg2+对维持类囊体膜两侧的pH 值至关重要[25],因此缺镁叶片可能是由于叶黄素循环受阻以致过剩激发能不能及时地耗散,从而导致光合系统受到损伤。
叶绿体是植物进行光合作用的场所,其基粒片层和基质片层结构的完整有序是光能进行正常有效转换的保证[26]。植物叶片的叶绿体基粒和基粒片层越多、排列越整齐致密,叶片光合能力越强。镁不仅参与叶绿素的合成,还参与类囊体膜的组装和基粒垛叠,适当镁浓度能强化基粒和基质片层的有序化垛叠[27]。申燕等[28]研究表明,缺镁导致橘橙叶绿体类囊体片层模糊,片层数量减少;镁过量会导致叶绿体片层消失,淀粉粒和质体小球增多增大。本试验中,缺镁导致槟榔叶绿体类囊体片层结构断裂,产生了许多噬锇颗粒,且大部分叶绿体不含有淀粉粒;高镁会使叶绿体形状发生变化,叶绿体膜模糊,基粒片层部分消失,但形成了较多淀粉粒。类囊体结构是保证植物光能吸收与转换的前提,淀粉粒是叶绿体基质中所储存的光合产物。而镁在维持天线色素、反应中心和膜的构象,以及维持光能的高效吸收、传递和转化方面发挥着重要作用[26]。由此反映出缺镁时叶绿体膜解体、叶绿体类囊体结构的断裂直接影响到光合作用的有效进行,而高镁处理虽然对叶绿体形状和基粒片层结构造成了一定的影响,但并未达到严重的毒害程度,所以仍能进行正常的光合作用。
植物叶片光合作用固定的碳主要以碳水化合物(淀粉、蔗糖) 的形式贮藏在叶绿体和细胞质中。对雪柑和酸柚[5]、咖啡[29]和小麦[30]的研究表明,缺镁增加或不影响叶片非结构性碳水化合物的含量,但是降低了它们在根中的含量。与前人研究结果一致的是,缺镁槟榔叶片可溶性糖 (蔗糖+葡萄糖+果糖)、蔗糖含量显著高于正常镁和高镁处理组,但淀粉含量则显著降低。蔗糖从质外体进入筛管-伴胞细胞中,是与质子逆向运输,由ATPase 产生的跨膜电化学梯度是物质跨膜运输的原动力,而Mg2+可以激活ATPase 的活性,从而保证了物质跨膜运输的能量需求[9,31]。尽管缺镁叶片可溶性糖含量积累增加,但光合能力降低并不能由糖积累反馈抑制光合的机制来解释,这与Li 等[32]研究结果是一致的;缺镁可能影响了槟榔叶片中物质的运输,从而导致了缺镁情况下叶片中可溶性糖的积累。缺镁槟榔叶片淀粉含量的降低,可能是由于SS 活性的降低,影响了淀粉合成底物ADPG (腺苷二磷酸葡萄糖) 的产生,进而影响了淀粉合成[33]。
4 结论
缺镁胁迫下,槟榔幼苗叶绿体超微结构受到破坏,从而导致光合系统受到损伤,光合能力降低。高浓度镁处理 (对照Mg 浓度的3 倍,即2.25 mmol/L)虽对叶绿体形状和基粒片层结构造成了一定的影响,但并未达到严重毒害程度,叶片仍能进行正常的光合作用。虽然缺镁叶片中积累更多的可溶性糖和蔗糖,但这些叶片较低的光合能力并不能由糖积累反馈抑制光合的机制来解释。因此,在槟榔生产中应重视镁肥的施用,且生产上一定程度的镁肥过量不会对树体产生明显的不利影响。

