磁热治疗的最新研究进展
朱顺涛 贺美娥 杨广令 林焦敏


摘 要: 磁热治疗是一种新兴的治疗癌症的方法,其利用磁性材料在高频交变磁场(AMF)下将磁能转换为热能,提高局部病灶部位组织温度(42 ℃以上),诱导癌细胞凋亡.该治疗方法由于具有无创/微创性、高效性和良好的组织穿透性等优点而受到广泛关注.通过介绍和总结常用磁热材料、磁热增强策略和原理,描述目前磁热治疗的最新研究进展,综述了磁热治疗这一前沿技术在癌症治疗中的潜在应用.
关键词: 磁热治疗; 磁性纳米粒子(MNP); 协同治疗; 癌症治疗
中图分类号: O 614.24 文献标志码: A 文章编号: 1000-5137(2019)05-0536-14
Abstract: As an emerging method for treating cancer,magnetic hyperthermia uses magnetic materials to convert magnetic energy into heat energy under high-frequency alternating magnetic field,and thus increases the tissue temperature of local lesions (above 42 ℃) to induce apoptosis of cancer cells.This treatment approach has received extensive attention for its advantages of non-invasion/minimal invasion,high-efficiency and good tissue penetration.In this papaer,we inroduce and summarize common magnetocaloric materials,magnetocaloric enhancement strategies and principles to describe the latest research progress of magnetothermal therapy,so that readers can deeply understand the potential application of magnetic hyperthermia as a frontier technology in cancer therapy.
Key words: magnetic hyperthermia; magnetic nanoparticles(MNP); synergistic treatment; cancer therapy
0 引 言
腫瘤是一种非遗传的基因疾病,它是指细胞在致瘤因素作用下,基因发生了改变,失去对其生长的正常调控,导致异常增生.肿瘤可分为良性和恶性两大类.前者生长缓慢,与周围组织界限清楚,不发生转移,对人体健康危害较小;后者生长迅速,可转移到身体其他部位,还会产生有害物质,破坏正常器官结构,使机体功能失调,威胁生命.癌细胞除了分裂失控外,还会侵入周遭正常组织,甚至经由体内循环系统或淋巴系统转移到身体其他部分[1-2].2018美国癌症年报数据显示,从癌症整体趋势上来看,和往年差别不大.预计2018年美国将有174万新发癌症病例,死亡人数在61万左右.相比于2014—2015年间,其癌症死亡率下降了1.7%,而相对1991年的死亡率峰值下降了26%,相当于死亡人数减少了240万[3].癌症是全球致死率最高的病症之一,是人类健康的最大杀手.寻找有效治愈癌症的方法仍然迫在眉睫.
目前临床广泛使用的癌症治疗方法主要有:手术疗法、药物化疗和放射性疗法,但这些疗法存在许多缺陷,如毒副作用大、复发性高、专一性差等缺点.随着科学技术的进步,人们一直在探索新的治疗方法,希望能够摆脱传统治疗方法的缺陷,在彻底治愈癌症的同时,尽可能地减少毒副作用,降低治疗过程中给病人带来的痛苦,降低治疗费用.目前研究较多的新型疗法主要有:光热疗法、磁热疗法、光动力疗法、化学动力学疗法和基因疗法等,其中热疗法由于安全性高、治疗效果好、目标性强等特点而受到广泛关注.
1 磁热治疗的作用机制
磁热治疗是热疗法中的一种,其利用磁性纳米粒子(MNP)在高频交变磁场(AMF)下通过Néel-Brownian弛豫转换为热能,提高局部病灶部位组织温度(42℃以上)诱导细胞死亡(图1).相比其他的热疗法如光热、微波等,磁热治疗法具有一些独特的优势,如没有穿透深度限制,生物组织对磁场强度影响小,能够以远程控制的方式精准地控制局部温度,具有良好的靶向性等.基于上述优点,磁热治疗法在过去10多年里得到了广泛的研究.
对于超顺磁性MNP,其在AMF下的将磁能转换为热量的磁损耗能力归因于Néel-Brownian弛豫.当MNP的尺寸减小到某个临界畴壁厚度以下时,单畴旋转在能量上是有利的,此时所有磁自旋都在相同的方向上排列,像一个巨大的磁矩.在这种情况下,MNP的磁矩倾向于向能量上有利的自发磁化方向(磁易轴)对齐,而沿轴线的2个相反方向(即向上和向下)由磁晶各向异性能的能垒分开.当施加的外部磁场提供足以克服能垒的能量时,磁自旋方向发生翻转,并且将所提供的磁能转换为热量释放出来,这种现象称为Néel弛豫(图2).磁自旋翻转所需的平均时间称为Néel弛豫时间(τN),由下列Néel-Arrhenius方程表示:τN=τ0·expKVkBT,其中,τ0为特征翻转频率10-9 s;K为磁各向异性常数;V为颗粒体积;kB为玻尔兹曼常数;T为温度[4].
随着颗粒尺寸增加,磁各向异性能垒将逐渐增大到足够阻碍Néel弛豫过程.因此,施加的磁场反而导致颗粒本身在液体中旋转,其磁旋转方向逐渐朝易轴方向固定.当颗粒旋转时,颗粒与周围流体之间的旋转摩擦产生热量,该过程被称为Brownian弛豫,Brownian弛豫时间τB=3ηVHkBT,其中,η为流体的黏度;VH为颗粒的流体动力学体积;kB为玻尔兹曼常数;T为温度[4].
对于超顺磁性MNP,Néel和Brownian弛豫同时发生,因此,有效弛豫时间(每个机制的谐波平均值)应被视为与MNP的散热相关的参数[4]:τeff=τNτBτN+τB. 从上述公式可以看出,有效弛豫时间主要受τN和τB中较快的影响,Néel弛豫倾向于主导小纳米粒子,而Brownian弛豫对于较大粒子效果明显.
2 磁热的影响因素
使用MNP作为热疗介质最早在20世纪50年代被提出[5],然而第一阶段临床试验直到21世纪初才在德国进行.目前,将磁热疗法应用于癌症治疗的研究主要集中在日本、德国和中国等几个国家.尽管对磁热疗法的应用研究已经很多,但是仍然存在一些限制,影响其广泛的临床使用,其中纳米粒子的加热效率(也称为比吸收率SAR或特定损耗参数SLP)最为人们所关注.传统上,小尺寸的超顺磁氧化铁(Fe3O4)纳米粒子(SPIONs)因其良好的生物相容性、较长的血液循环寿命和良好的分散性而受到磁热疗法的青睐,然而随着研究的深入,人们发现SPIONs有其一系列局限性,例如较低的饱和磁化强度和矫顽力限制了其加热效率或SAR.所以人们一直希望尽可能多地增加SAR,以便用更少量的MNP和更小的磁场实现有效的高温治疗.
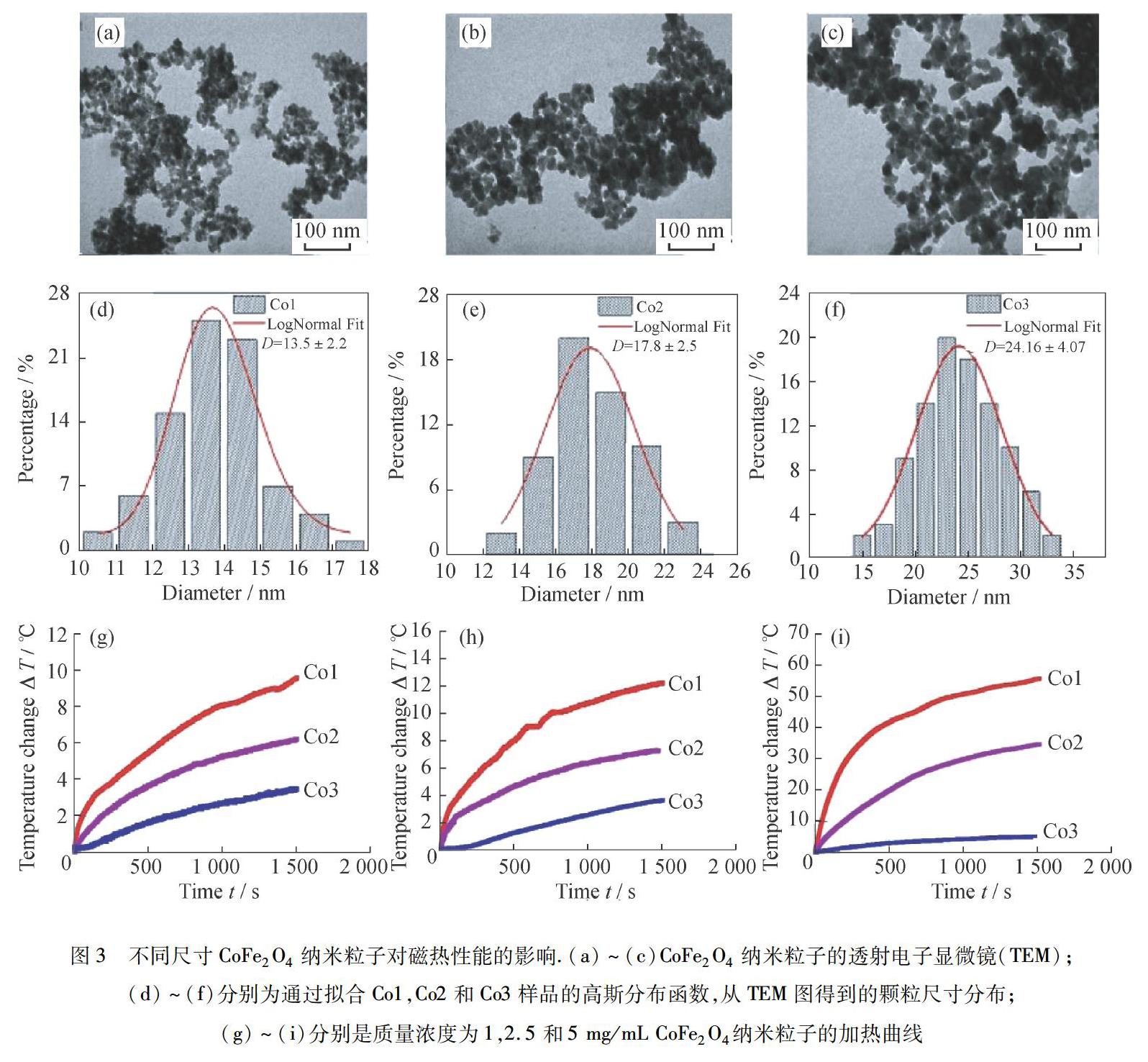
目前,材料参数有粒径、矫顽力、磁各向异性和偶极相互作用等,这些参数对磁热性能的影响机制尚不完全清楚.因此,想要提升磁热效率,首先应明确散热的关键机制.最容易调控的参数就是粒径,然而目前还没有研究明确提出优化粒径以获得最大特定损耗功率的方法.但可以确定的是,粒径的控制可显著改变Néel-Brownian弛豫时间以及滞后損失,从而控制加热效率.随着粒径尺寸分布的增加,发热量减少,加热效率(通常表现为SAR)与暴露于AMF时MNP的热损失直接相关.为了探究纳米粒子粒度对磁性能和磁热效果的影响,PHONG等[6]通过微波辅助共沉淀法合成了3种具有不同尺寸(12.8,16.1和22.3 nm)的CoFe2O4纳米粒子(图3),其在室温下呈现铁磁态,在高温下呈超顺磁性.他们通过一系列实验发现,随着粒径的增大,阻挡温度(TB)从365 K增加到506 K.施加的磁场克服了矫顽力,并且弛豫损失有助于提高铁磁性纳米粒子的磁感应加热效率和热疗效果.同时他们也发现磁性CoFe2O4纳米粒子在AMF磁性流体的散热偶极相互作用也强烈影响了加热能力.总的来说,纳米粒子的SAR很大程度上取决于它们的磁性和粒径,SAR随着粒径的增加而降低,最小的CoFe2O4纳米粒子(13.5 nm)表现出最高的SAR[6].
除了纳米粒子的本身属性,例如大小、形状和磁各向异性等,还有一些其他因素会影响磁热效果,例如纳米粒子的浓度.EBRAHIMISADR等[7]通过制作不同浓度的Fe3O4纳米粒子进行比较,探究浓度对Fe3O4纳米颗粒在交变磁场中的升温效果的影响,并从Box-Lucas方程和ΔT-t曲线的线性拟合得到了SAR[7].结果表明,温度上升值(ΔT)随着纳米粒子质量分数的增加而急剧增加,质量分数为12.5%的样品得到最高的ΔT,为58 ℃,而质量分数为1%时,ΔT为最小值9 ℃(图4).而使用Box-Lucas和ΔT-t曲线的线性拟合2种不同方法获得的SAR值结果证实了质量分数对SAR值的影响可忽略不计.
3 常见磁热材料
3.1 Fe3O4
Fe3O4纳米粒子作为目前生物医学界使用最广泛的磁性纳米材料,有着很多吸引人的特性,比如其生产成本低、生物相容性高、磁响应强,并且可以通过接上合适的修饰来增加其对靶组织的选择性.Fe3O4纳米粒子可以产生不同的对比,还可以应用于磁共振成像(MRI)检测,其磁性也可以通过标记干细胞来用于干细胞追踪,通过施加磁场将纳米粒子引导至所需位置,通过磁场实现升温或释放药物.因此,Fe3O4纳米粒子可以作为癌症的诊疗一体化纳米探针,在提供简单的诊断和治疗的同时,还可以通过表面的功能化来定制更多的功能.
GULDRIS等[8]设计制作了一种多功能、可进行可点击的正交反应的Fe3O4纳米粒子平台.他们用含有异氰酸酯部分的2个配体对纳米粒子进行简单的官能化,用马来酰亚胺和炔基高度覆盖表面.炔基可以与硫醇(硫醇-烯和巯基-炔反应)、共轭二烯(Diels-Alder环加成反应)和叠氮官能团(1,3-偶极叠氮-炔环加成反应)进行正交反应(图5).由于Fe3O4纳米粒子的表征和纯化方面的限制,点击反应成为生物医学应用功能化的理想方案.他们通过Diels-Alder反应将荧光团作为药物模型加载,并通过叠氮化物-炔烃环加成反应与含聚乙二醇(PEG)的生物素配体反应,以证明该平台的适用性.通过Diels-Alder反应的热可逆特性,施加外部AMF能使温度触发的荧光分子释放.此外,Fe3O4纳米粒子增强MRI对比度的能力是验证其肿瘤细胞靶向能力的关键,发现其能够被生物素增强.经过核磁共振成像的验证,该混合平台显示出进一步利用组合成像和磁热治疗应用,从而开发治疗诊断剂的潜力.
目前,在生物医学领域,纳米材料用于癌症治疗的主要困难在于给药系统,临床部位的药物浓度不足、非特异靶向等引起的毒性以及药物浓度过高等问题都制约着纳米粒子在生物医学领域的发展.而磁性药物靶向解决了许多这类问题,超顺磁性纳米粒子是磁热治疗的主要研究对象,Fe3O4纳米粒子响应外部磁场产生能量,并在去除磁场后不保留任何磁性.然而超顺磁性的Fe3O4纳米粒子在血浆中会造成生物污染,导致网状内皮系统的聚集和分离,其与细胞直接接触会造成一系列有害的反应.因此需要改变Fe3O4纳米粒子的表面以减少生物条件下的聚集和生物毒性.羟基磷灰石(HAp)[Ca5(PO4)3(OH)]因其优异的生物相容性、生物活性和骨传导性而被广泛用作生物材料.MONDAL等[9]使用溶剂热和湿化学沉淀技术合成了Fe3O4(IO),使用HAp和HAp涂覆的良好分散的球形 Fe3O4纳米粒子(IO-HAp),用于磁热治疗(图6).用XRD,FTIR,FETEM与能量分散X射线光谱(EDS)证实了材料的成功合成.在室温(300 K)和15000 Oe(1.5 T)磁场下,合成的IO饱和磁化强度为83.2 emu·g-1,IO-HAp为40.6 emu·g-1.在MG-63骨肉瘤细胞的磁热疗研究中,显示IO-HAp的磁热疗效果(SAR值为85 W·g-1)有明显增强,在3 min内达到体外热疗温度(约为45 ℃),在30 min暴露期间内杀死几乎所有实验性MG-63骨肉瘤细胞,显示出了非常高的磁热效率.IO-HAp结合磁热治疗可以成为治疗不同类型癌症的安全有效的治疗工具.
3.2 铁酸盐
铁酸盐属含氧酸盐,一般包括铁(III)、铁(IV)、铁(V)、铁(VI)的4种价态含氧酸盐,其中未特别指出时,一般指铁(III)的含氧酸盐,称铁酸盐,而铁(VI)的盐则称为高铁酸盐,其他2种价态则较为少见.铁酸盐由于其产热率大、饱和磁化率高而被广泛应用于磁热治疗.由于为铁基纳米粒子,也有很好的MRI成像效果.目前已经有很多实验合成了多种不同的铁酸盐,用于磁热治疗和成像,或者和其他治疗方法的协同治疗.
Fe3O4纳米粒子,特别是磁铁矿(Fe3O4),由于其毒性低于其他磁性材料,且磁性可调,制备相对简单,稳定性好,是最常用的热疗磁性纳米粒子.具有反尖晶石结构的磁铁矿纳米粒子是生物医学研究最多的铁酸盐.目前,人们研究的重点在于通过用其他阳离子,如Zn,Ca,Mg,Mn,Co,Cu,Ca和Ni等离子部分取代Fe离子来开发混合铁酸盐.比如CoFe2O4,相比Fe3O4,具有更高的磁晶各向异性,会导致热疗中热能耗散更大[10].此外体外细胞相容性研究也表明,使用Co-铁酸盐的细胞存活率在物质的量浓度为0.1 mg·mL-1时,与Fe3O4相比并无差异;当物质的量浓度为0.2 mg·mL-1时,使用Fe3O4使细胞存活率降低30%,而Co-铁酸盐的细胞存活率为50%.因此较高浓度下细胞活力受到影响,但几乎不受用于制备纳米粒子的铁酸盐的影响[11].
DEMIRCI等[12]研究了如何通过用La3+粒子代替Fe3+粒子来调节Co-铁酸盐纳米粒子的K值来进行有效的磁热疗.他们研究了CoFe2-xLaxO4(x=0.0,0.2,0.5)纳米粒子的结构、组成、磁性以及磁热反应.相比未取代的Co-铁酸盐,饱和磁化强度(Ms)和K随着La3+的取代浓度的增加而增加.当颗粒分散在去离子H2O中时,在195 kHz的50 kA·m-1的磁场下没有观察到SLP的变化.但与预期相反,SLP随着黏度的增加而增强.根据跟踪得到的K和Ms数值探索La3+粒子的最佳替代浓度以获得最佳加热效率.与未取代的和25%La3+取代的Co-铁酸盐相比,10%La3+离子取代的Co-铁酸盐纳米粒子有较高的SLP值,原因可能是来自Néel弛豫占主导地位(图7).通过将不同类型的稀土离子取代成Co-铁酸盐纳米粒子,探索出最佳的La离子浓度和调节K的效果是非常重要的研究工作.
3.3 合金类
温度控制一直是磁热治疗发展的一个重要难题,温度控制可以通过选择居里温度(接近处理温度)的磁性纳米材料来解决,并在肿瘤组织中提供自控加热.纳米颗粒的居里温度与粒径和合金组成有关.如果可以将居里温度、粒径和合金组成调节到最佳值,使它们具有足够的热疗性能,则可以在自控下完成处理.块状Ni28Pd72合金的居里温度约为45 ℃,是一种具有前景的用于自调节磁流体热疗的材料[13].
虽然目前已经有一些研究评估了NiPd合金,但是他们大多研究了NiPd纳米粒子的催化性质.此外,由于潜在的生物损伤,磁场和频率值受到限制,NiPd合金纳米粒子的发热速率很难达到所需的发热水平,因此还需要探究合适的合金组成.ITO G ˇLU等[14]试图合成出具有自调节磁热治疗所需的NiPd磁性合金,使用多元醇法合成了2种合金,分别为Ni30Pd70和Ni50Pd50,然后使用聚乙烯吡咯烷酮(PVP)涂覆,以防止纳米粒子被氧化,并且PVP涂覆纳米粒子表面提供了空间排斥,可以防止纳米粒子的聚集.2种纳米粒子的尺寸分别为(3.48±0.04) nm和(2.47±0.11) nm.磁滞测量表明:Ni30Pd70樣品表现出顺磁性,而Ni50Pd50合金在室温下表现出超顺磁性和铁磁性.磁化与温度的测量结果表明:Ni30Pd70合金的阻隔温度小于10 K,Ni50Pd50合金的阻隔温度约为155 K.在8.7~23.7 kA·m-1范围的AC磁场下进行磁热实验,计算SAR值为0.2~7.6 W·g-1(图8).这些结果表明:在施加生物应用的标准磁场和频率下,获得的合金纳米粒子的SAR值并不适合用于热疗应用.该合金材料低的加热能力可能是由于其低的磁化强度、小的粒径和颗粒聚集.合成适合于磁热疗的磁性合金,未来的工作应聚焦于研究更为合适的表面活性剂以提高溶解度,还有增加粒径和防止颗粒聚集.
作为最好的磁热材料之一,含Fe的纳米合金也是重要的一类磁热材料.作为其中的代表,FeCo拥有高饱和磁化强度、高居里温度、高渗透性以及良好的物理性能,从而受到广泛关注与应用.ZER等[15]通过表面活性剂辅助的球磨法合成了不同尺寸的FeCo胶体磁性纳米合金,其尺寸可控,范围在11.5~37.2 nm.通过TEM测定了颗粒分布,用XRD测量验证了FeCo合金为BCC(体心立方)结构.之后通过振动样品磁强计(VSM)方法研究纳米合金的磁性能,证实了纳米粒子磁性与尺寸有关.平均尺寸为(11.2±2.1),(13.7±3.3),(17.2±3.6)和(37.4±2.4) nm的FeCo纳米粒子饱和磁化强度分别为145,156,165和172 Am2·kg-1.随着尺寸的减小,球磨纳米粒子相对于整体结构的纳米粒子饱和磁化强度降低,其磁化曲线证明了FeCo纳米颗粒的典型单畴铁磁行为.磁性材料尺寸与临界尺寸相比变小时,磁性颗粒变成单畴以减少其磁性能.而单畴纳米粒子的矫顽力强烈依赖于尺寸,上述不同尺寸的纳米粒子矫顽力分别为17.5,19.4,17.8和16.0 mT,矫顽力与磁各向异性有关.最后他们利用LRT和SW模型模拟了纳米粒子在AMF下的发热机理,对于平均尺寸为(13.3±1.6) nm的FeCo纳米粒子,在171 kHz的磁场频率和14 mT的磁场强度下,SAR值为(15.0±0.3) W·g-1,该值小于理论计算值(图9).从磁热疗结果中发现,其热量产生机制类似于Stoner-Wohlfarth方式,阶梯状形式的理论预测与SAR损失磁场依赖性符合.
3.4 复合材料
磁性纳米粒子表现出独特的物理化学性质,使它们被医学领域广泛研究,但是由于它们的易聚集倾向性,也造成其一些独特性质和应用潜力的丧失.而有机/无机纳米复合材料结合了纳米粒子的独特性质和聚合物基质的优点(包括重量轻和易成型等),通常的方法是在聚合物中包埋磁性纳米颗粒,制造出可注射的制剂,用于局部递送的磁热疗.分散在聚合物溶液中的纳米颗粒的胶体悬浮液能够防止聚合物溶液或聚合物熔体中的絮凝,也能够通过旋涂和纳米复合材料的沉淀制备纳米复合材料薄膜,材料本身以易于研磨成粉末的形式存在.GYERGYEK等[16]提出了一种制备高均匀分散的磁性Fe3O4/聚甲基丙烯酸(PMMA)纳米复合材料的简单方法,甲基丙烯酸酯-单体-官能化的磁性Fe3O4纳米颗粒在胶体悬浮液中与甲基丙烯酸甲酯(MMA)单体共聚合.所开发的共聚方法有2个优点:首先,磁性纳米粒子用PMMA链饰,其在聚合物溶液中提供胶体稳定性,并且再制备过程中防止纳米粒子的聚集;其次,PMMA基质在一锅合成中同时形成,简单方便.从悬浮液中沉淀出的纳米复合材料,PMMA链牢固地附着在纳米颗粒的表面上.用TEM分析表明,磁性纳米粒子均匀地分散在PMMA基质中,质量分数达到了53%.复合材料具有超顺磁性,在饱和磁化强度高达36 emu·g-1时表现出较大的值.掺入大量纳米颗粒的纳米复合材料在相对低幅度的AMF下产生大量热量,因此它也具有基于磁感应热疗的癌症治疗应用的潜力.
RASHID等[17]通过柠檬酸盐凝胶技术制备含有不同ZrO2质量分数(0~80%)的MgFe2O4 / ZrO2复合材料作为磁热疗的潜在候选材料(图10).MgFe2O4由于其热效率的频率依赖性,升温效率在铁氧体中最高,因此与其他铁氧体相比,它更适合实现局部热疗.而引入生物相容性陶瓷ZrO2,可以防止MgFe2O4纳米颗粒聚集并减少它们的偶极相互作用以提高SAR.他们采用的合成方法是CHOY等[18]开发改良的柠檬酸盐凝胶法,该方法产生尺寸分布较窄的细颗粒,所得的产物具有高纯度并且化学均匀.在使用XRD,TEM和VSM研究样品的结构和磁性后,在所有不同ZrO2质量分数的样品中都观察到射频磁场中有磁感应加热效果.最重要的是,发现仅含20%质量分数的MgFe2O4样品的SAR大于纯的MgFe2O4.因为ZrO2与混合金属铁氧体相比具有低毒性和高生物相容性,所以从生物医学应用的角度看,这是一个重要的发现.
3.5 其 他
除了常用的含Fe材料外,人们也在寻找其他拥有比Fe更优秀的磁热效果的物质来制备纳米材料.比如最近就有一类钙钛矿结构材料受到热疗界的高度关注,即La1-xSrx MnO3(LSMO)纳米颗粒.La1-xSrx MnO3是一种铁磁材料,在磁热疗过程中会产生热量.相比于铁化合物,La1-xSrx MnO3有较低的居里温度、较好的生物相容性、高磁化强度、高稳定性和低矫顽力,这些特点使得这种材料被人们广泛关注.研究人员已经探索出了La1-xSrx MnO3纳米粒子的很多合成方法,包括溶胶-凝胶、水热合成和熔盐法等.LOTFI等[19]通过溶胶-凝胶技术提出了一种La1-xSrx MnO3纳米粒子的简单合成方法,并成功制备了x =0.2,0.3,0.4和0.5 的4种La1-xSrx MnO3纳米粒子,并且对它们的磁性能进行了一系列探究.使用FTIR,XRD,SEM,TEM和VSM等表征手段研究了纳米粒子的结构、形态和磁性,证明了La1-xSrx MnO3晶体结构符合预期,纳米粒子大多处于聚集状态,并且当x=0.2时,La1-xSrx MnO3纳米粒子的磁化强度高于其他样品,证明了Sr的浓度会影响纳米颗粒的磁化.另外纳米粒子的磁响应实验中没有观察到磁滞现象,表明了粒子的超顺磁性(图11).毒性试验也证明了它们不会显著地对正常细胞造成细胞毒性.当暴露于射频磁场RF时,La1-xSrx MnO3纳米粒子表现出优异的加热性能.这些实验结果表明具有低毒性的超顺磁性钙钛矿La1-xSrx MnO3纳米粒子在生物医学应用,特别是磁热疗应用上具有很高的潜力,是磁热材料的有力竞争者.
此外,磁性纳米粒子在局部递送过程中很难完全被递送至肿瘤部位,主要原因包括肾脏的快速过滤、网状内皮系统的清理、血流到组织内靶细胞的转运以及过度依赖增强的渗透和保留(EPR)效应等.所以人们在制备用于癌症治疗的纳米材料时也在考虑如何提高纳米载体的递送效率.YANG等[20]通过一种新兴的电液动力射流(E-jet)印刷技术,实现了抗癌磁热聚己内酯/Fe3O4(PCL/Fe3O4)垫的快速制备.这种新技术克服了电纺垫的机械稳定性和3D形状构造能力低的缺点,制造出的磁热垫形状可控且制作速度快,可以设计出适合各种肿瘤环境的材料,而且受益于三维性,3D打印可以显著改善膜的比表面积,从而增加垫与癌细胞之间的接触面积,改善磁热疗的效果.制作出的磁热垫不仅保持了传统磁热疗技术的加热效率,而且延长了体内的有效治疗.采用PCL作为基础材料是因为其优异的生物相容性和生物稳定性,能够让Fe3O4纳米粒子稳定地固定在肿瘤部位周围,对癌细胞进行持续热疗.在研究中发现,当Fe3O4纳米颗粒用于物质的量浓度为6 mmol·L-1的垫子时,0.07 g的PCL/Fe3O4垫能够在45 min内在AMF中将外围温度增加到45 ℃(图12).此外重复性试验表明,在重复的加热和冷却循环后磁热垫依旧能达到最高温度,因为纳米粒子泄漏,加热能力没有损失.细胞毒性实验也表明材料毒性不高,体内实验也表明肿瘤生长抑制的效果非常明显,处理4周后肿瘤小鼠的存活时间也延长.最关键的是,磁热垫可以通过手术放置在肿瘤的邻近区域,而不是频繁的静脉注射,这提高了Fe3O4纳米粒子的局部递送的精确性和稳定性,非常适合容易接近肿瘤的磁热疗.
4 总结和展望
本文作者总结了一些有关磁热的原理和应用,并介绍了一系列有望在磁热治疗中用于临床应用的磁热材料.毫无疑问,基于磁性纳米粒子的磁热疗技术在癌症治疗上有着非常广的应用前景,其中的一些产品已经走出实验室,在市场上应用或临床试验中.然而,这并不意味着这磁热疗技术已经完全成熟,将有效的纳米制剂转化为临床药物具有非常大的挑战,有几个迫切需要解决的问题:1) 优化和扩大磁热纳米粒子的生产,只有拥有大批量、稳定的生产流程与方法,磁热材料的市场化应用才能成为可能;2) 纳米材料的标准化,并能对其功效进行定量的系统评估,只有材料的生产能够标准化,流水线出来的成品拥有等量的标准功效,才能保证产品的稳定性和有效性;3) 建立清晰详细的毒性、免疫原性、清除率和安全性等评价标准,用于人体治疗的药物一定要保证其安全性,才能让人用得放心.此外系统地考虑工程化MNP与生物环境在各种生理化学条件、解剖位置和不同组织环境之间的变化与影响也非常重要.到目前为止,市面上还是极少有能完全发挥出磁热治疗优势的合适药物出现,在癌症治疗中磁热疗也没有非常普及.作為一种已经被研究很久、日趋成熟的技术,如何让其走出实验室,开发出能真正用于实际应用的、完全发挥磁热优越性的体系是需要解决的问题,这也是生物医学界、商界以及全世界癌症患者的共同期望.
參考文献:
[1] MATSUDAIRA P,PAUL T,LODISH,et al.Molecular Cell Biology [M].6th.New York:W.H.Freeman & Co.Ltd.,2008.
[2] BRUCE A,ALEXANDER J.Molecular Biology of the Cell [M].New York:Garland Science,2002.
[3] JOHN H,LADA K,ANTHONY A,et al.Clinical cancer advances 2018:annual report on progress against cancer from the american society of clinical oncology [J].Journal of Clinical Oncology,2018,36(10):1020-1044.
[4] ROSENSWEIG R E.Magnetorheological particle clouds [J].Journal of Magnetism and Magnetic Materials,2002,252(479):370-374.
[5] GILCHRIST R,MEDAL R,SHOREY W D,et al.Selective inductive heating of lymph nodes [J].Annals of Surgery,1957,146(4):596-606.
[6] PHONG P T,NAM P H,CHIEN N V,et al.Size-controlled heating ability of CoFe2O4 nanoparticles for hyperthermia applications [J].Physica B:Condensed Matter,2018,531(1):30-34.
[7] EBRAHIMISADR S,BAGHER A,REZA A.Magnetic hyperthermia properties of iron oxide nanoparticles:the effect of concentration [J].Physica C:Superconductivity and Its Applications,2018,549(1):119-121.
[8] GULDRIS N,GALLO J,RIVAS M,et al.Orthogonal clickable iron oxide nanoparticle platform for targeting,imaging,and on-demand release [J].Chemistry:A European Journal,2018,24(34):8624-8631.
[9] MONDAL S,MANIVASAGAN P,BHARATHIRAJA S,et al.Hydroxyapatite coated iron oxide nanoparticles:a promising nanomaterial for magnetic hyperthermia cancer treatment [J].Nanomaterials(Basel),2017,7(12):426.
[10] ROSENSWEIG R E.Heating magnetic fluid with alternating magnetic field [J].Journal of Magnetism and Magnetic Materials,2002,252(1):370-374.
[11] PRADHAN P,GIRI J,SAMANTA G,et al.Comparative evaluation of heating ability and biocompatibility of different ferrite-based magnetic fluids for hyperthermia application [J].Journal of Biomedical Materials Research Part B:Applied Biomaterials,2007,81B(1):12-22.
[12] DEMIRCIE,MANNA P K,WROCZYNSKYJ Y,et al.Lanthanum ion substituted cobalt ferrite nanoparticles and their hyperthermia efficiency [J].Journal of Magnetism and Magnetic Materials,2018,458(1):253-260.
[13] KUMAR S,MOHAMMED F.Magnetic nanomaterials for hyperthermiabased therapy and controlled drug delivery [J].Advanced Drug Delivery Reviews,2011,63(9):789-808.
[14] ITO G ˇLU S,MUSTAFA C,FIRAT T,et al.Synthesis and magneto-thermal properties of nipd nanoparticles [J].Materials Chemistry and Physics,2018,211(1):489-500.
[15] ZER ,TEZER F.Synthesis of FeCo magnetic nanoalloys and investigation of heating properties for magnetic fluid hyperthermia [J].Journal of Magnetism and Magnetic Materials,2018,456(1):11-16.
[16] GYERGYEK S,PAHOVNIK D,ZAGAR E,et al.Nanocomposites comprised of homogeneously dispersed magnetic iron-oxide nanoparticles and poly(methyl methacrylate) [J].Beilstein Journal of Nanotechnology,2018,9(1):1613-1622.
[17] RASHID A,HUMAYUN A,MANZOOR S,et al.MgFe2O4/ZrO2 composite nanoparticles for hyperthermia applications [J].Journal of Magnetism and Magnetic Materials,2017,428(1):333-339.
[18] CHOY J H,HAN Y S.Citrate route to the piezoelectric Pb(Zr,Ti)O3 oxide [J].Journal of Materials Chemistry,1997,7(7):1815-1820.
[19] LOTFI S,BAHARI S,BAHARI A,et al.Magnetic performance and evaluation of radiofrequency hyperthermia of perovskite La1-xSrx MnO3 [J].Journal of Superconductivity and Novel Magnetism,2018,31(7):2187-2193.
[20] YANG Y,TONG C,ZHONG J,et al.An effective thermal therapy against cancer using an E-jet 3D-printing method to prepare implantable magnetocaloric mats [J].Journal of Biomed Materials Research Part B:Applied Biomaterials,2018,106(5):1827-1841.
(責任编辑:郁 慧)

