模拟氮沉降对樟树人工林土壤酶活性的影响
魏枫 王慧娟 邱秀文 周桂香 杨丽丽 郭晓敏

摘要:为探究氮沉降对亚热带森林土壤酶活性的影响,在樟树人工林中开展了野外模拟氮沉降试验。试验设置对照[CK,0 kg/(hm2·年)]、低氮[N1,30 kg/(hm2·年)]和高氮[N2,60 kg/(hm2·年)]3种氮处理,分别在施氮前期(3个月)、中期(6个月)、后期(12个月)采集土壤样品,测定土壤酶活性。结果表明,与对照组相比,在0~10 cm土层,过氧化氢酶活性在3个月和12个月后受高氮沉降的显著促进作用;淀粉酶活性在施氮6个月和12个月后受氮沉降的显著促进作用;受氮沉降影响,蔗糖酶活性在施氮12个月后显著提升。在10~20 cm土层,过氧化氢酶、淀粉酶、蔗糖酶活性受氮沉降的影响不显著。从施氮时间来看,氮沉降对酸性磷酸酶活性的影响表现为先促进后抑制,在施氮后3个月时,0~10 cm土层酸性磷酸酶活性受低氮沉降的显著促进作用;在施氮后6个月时,10~20 cm土层酸性磷酸酶活性被氮沉降抑制。氮沉降对脲酶活性的影响则相反,在施氮后3个月时,10~20 cm土層脲酶活性受到显著抑制;在施氮后12个月时,0~10 cm土层脲酶活性受氮沉降的显著促进作用,10~20 cm土层脲酶活性仅受高氮沉降的显著促进作用。土壤蔗糖酶活性与淀粉酶活性呈极显著正相关关系,与脲酶活性呈显著正相关关系,土壤酸性磷酸酶活性与脲酶活性呈显著负相关关系,表明不同土壤酶活性之间的相关性存在差异。
关键词:氮沉降;樟树人工林;土壤酶活性
中图分类号:S718.51+6 文献标志码: A
文章编号:1002-1302(2019)19-0129-04
收稿日期:2018-06-19
基金项目:国家自然科学基金(编号:41661068);江西省自然科学基金(编号:20161BAB214150);江西省重点研发计划(编号:20171BBF60057);土壤与农业可持续发展国家重点实验室开放课题(编号:Y20160010)。
作者简介:魏 枫(1992—),男,陕西西安人,硕士,主要从事农林土壤营养恢复研究。E-mail:wfjxau@163.com。
通信作者:郭晓敏,博士,教授,主要从事经济林栽培、林木营养研究。E-mail:gxmjxau@163.com。
近几十年来,我国工农业的迅速发展、化石能源燃烧量的增加以及含氮化肥的大量生产和使用导致活性氮的排放量明显增加[1]。众多研究表明,氮沉降的显著增加不仅影响着植物物种的多样性、生态系统的生产力、植物群落的组成和植物的生长状况[2],而且改变了土壤的理化性质、微生物群落的功能结构以及土壤酶活性[3]。因而,大气氮沉降的增加已成为科学家和公众关注的热点内容之一[4]。
土壤酶是土壤微生物和植物的分泌物,在土壤生物化学过程中扮演着重要的角色,对于土壤质量和生态环境效应的评价具有十分重要的作用。土壤酶对有机质的降解速率受氮沉降的干扰,这在很大程度上直接影响到林木的生长状况[5]。因此,研究氮沉降对我国森林生态系统的调节机制及发展潜力的探究具有重要的意义。
近年来,各地关于氮沉降增加对土壤酶活性影响的研究较多,但没有得到统一的结论。闫钟清等研究发现,氮增加抑制了脲酶活性[6],而宋学贵等分别对川南天然常绿阔叶林和华西雨屏区苦竹林中土壤进行了模拟氮沉降试验,结果发现,氮沉降增加了脲酶的活性[3,7]。由此可见,不同生态系统中土壤酶活性对氮沉降的响应存在差异。本研究选择樟树人工林为研究对象,通过野外模拟氮沉降试验,研究土壤酶活性对大气氮沉降的响应,以期为深入开展森林生态系统对氮沉降增加的响应机制研究提供数据支撑和理论参考。
1 材料与方法
1.1 研究区概况
研究区位于我国江西省的九江市(29°68′N,115°98′E),试验站点的年平均温度为17 ℃,年平均降水量为1 407 mm,该地区属于季风性亚热带气候,四季分明,每年平均有240个无霜日,土壤类型为红壤。樟树树龄为6年,平均胸径为 14.4 cm,平均株高为6.5 m。试验样地平均pH值为6.0,有机质含量为11.4 g/kg,土壤全氮含量为1.3 g/kg。
1.2 模拟氮沉降试验样地设置及取样方法
2014年11月,在试验区选择立地条件基本相似的区域,设定了9个样地,每个样地为2 m×3 m,样地之间留有5 m宽的缓冲区域,以防样地间相互干扰。每个样地区域中的地表植株和凋落物有所保留。将所有样地分成3个不同浓度的施氮处理,按施氮量由低到高分别标记为N0[0 kg/(hm2·年)]、N1[30 kg/(hm2·年)]、N2[60 kg/(hm2·年)],每个施氮处理设3个重复。模拟氮沉降时间为2014年11月至2015年11月,将施氮量换算成每月施氮量,每月末将各处理所需的NH4NO3溶解于1 L水中,用喷雾器在样地均匀喷洒,同时向对照样地喷施同样剂量的清水,以减少外加水分因子对试验造成的影响。
分别于2015年的2、5、11月在施氮区域按照随机、等量、多点混合的原则进行土壤取样。土壤取样时将中心区上层土壤结皮去除,分0~10 cm、10~20 cm 2层取样。去除大的石块及根系等杂物后,将土壤样品装入取样箱中带回实验室,置于4 ℃冰箱保存,迅速完成土壤酶活性的测定。
1.3 土壤酶活性的测定方法
土壤淀粉酶、蔗糖酶活性采用3,5-二硝基水杨酸比色法测定;过氧化氢酶活性采用高锰酸钾滴定法测定;脲酶活性采用苯酚钠-次氯酸钠比色法测定;酸性磷酸酶活性采用对硝基苯磷酸二钠比色法测定[8]。
1.4 数据处理
所有数据采用SPSS 13.0软件进行分析。利用单因素方差分析和Tukey多重比较法比较不同处理数据的组间差异,不同土壤酶活性之间的相关关系采用Pearson相关分析法进行分析,用Origin 8.0软件作图。
2 结果与分析
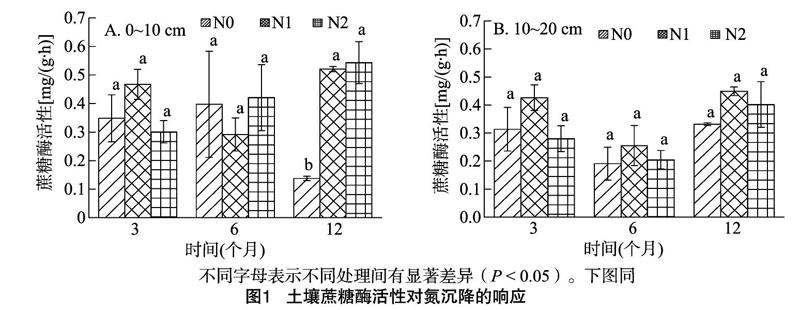
2.1 模拟氮沉降对土壤蔗糖酶活性的影响
从图1可以看出,0~10 cm土层蔗糖酶活性对施氮响应较大,尤其在试验后期(12个月)表现更加明显,N1、N2 2理均可显著提高土层蔗糖酶活性,分别比对照高279%、295%,但2处理间蔗糖酶活性差异不显著;10~20 cm 土层,施氮处理对蔗糖酶活性影响不显著。各处理酶活性大小会随施氮时间发生变化,且变化规律受施氮程度及土层深度的影响。随着施氮时间的延长,0~10 cm土层,N1处理的酶活性先减小后增大,N2处理的酶活性持续增大;10~20 cm土层,不同处理蔗糖酶活性的变化规律一致,表现先减小后增大,最大值出现在施氮后期(12个月)。
2.2 模拟氮沉降对酸性磷酸酶活性的影响
从图2可以看出,氮沉降对土壤酸性磷酸酶活性的影响因施氮时间和施氮量的不同而产生变化。随施氮时间的延长,氮添加对酸性磷酸酶活性的作用由促进逐渐转为抑制,不同土层出现抑制的时间不同。0~10 cm土层,N1处理对酸性磷酸酶活性的显著促进作用体现在施氮前期(3个月),施氮中期(6个月)影响不显著,施氮后期酶活性低于对照处理;N2处理对酸性磷酸酶活性无显著影响。10~20 cm土层,氮添加对酸性磷酸酶活性的较大抑制作用体现在施氮中期(6个月),N2处理对酸性磷酸酶活性的抑制作用高于N1处理,其他阶段氮添加对酸性磷酸酶活性无显著影响。
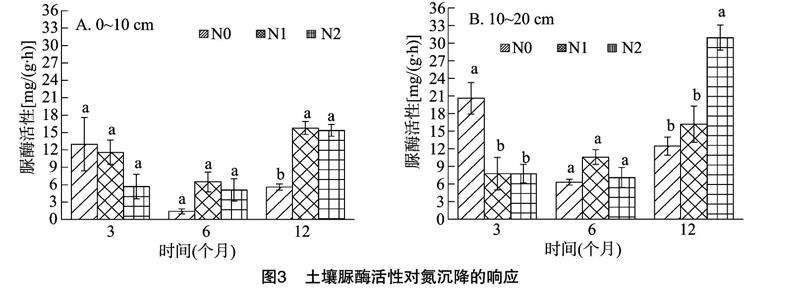
2.3 模拟氮沉降对脲酶活性的影响
施氮对脲酶活性的影响与酸性磷酸酶相反(图3),施氮前期(3个月)表现为抑制作用,尤其在10~20 cm土层,抑制作用明显,N0处理与N1、N2处理的酸性磷酸酶活性差异显著,而N1、N2处理差别不大。施氮后期(12个月)表现为促进作用,0~10 cm土层,施氮处理对脲酶活性的影响显著,N1处理与N2处理差别不大;10~20 cm土层,N1处理的促进作用不明显,而N2处理能显著提高脲酶活性。N0处理下,脲酶活性在施氮前期出现最大值,而N1、N2处理的脲酶活性均在施氮后期達到最大值。
2.4 模拟氮沉降对过氧化氢酶活性的影响
从图4可以看出,施氮可以提高土壤过氧化氢酶活性,其促进作用在0~10 cm土层表现更为明显,施氮3个月后,N2处理的过氧化氢酶活性显著高于N1、N0处理,随着施氮时间的延长,N2处理酶活性逐渐下降,且在施氮12个月后,N2处理与N0处理酶活性差异显著,N2处理的过氧化氢酶活性最大;10~20 cm土层,不同处理的过氧化氢酶活性虽无明显差异,但N1、N2处理随施氨时间的延长降幅更大,施氮12个月后,N1、N2处理的过氧化氢酶活性低于N0处理。同时,过氧化氢酶活性变化也与施氮时间有关,在施氮3个月后,0~
10 cm 土层的过氧化氢酶活性比10~20 cm低,而在施氮6个月后,0~10 cm土层的酶活性高于10~20 cm。
2.5 模拟氮沉降对淀粉酶活性的影响
从图5可以得出,施氮对土壤淀粉酶活性有促进作用,然而其作用的大小与土层深度及施氮时间有关。相比之下,0~10 cm土层受施氮的影响更为明显,试验初期(3个月),氮添加对淀粉酶活性的促进作用不明显,而试验中期(6个月),氮添加能显著提高土壤淀粉酶活性,3种处理之间有显著差异;随施氮时间的延长,这种促进作用表现得更为明显,且N2处理>N1处理。10~20 cm土层受施氮影响不显著(图5-B)。
2.6 土壤不同酶活性之间的相关性分析
本试验对氮添加下表层土壤(0~10 cm)酶活性进行了相关性分析。结果(表1)表明,土壤蔗糖酶活性与淀粉酶、脲酶活性均呈显著正相关关系,相关系数分别为0.57、0.41;土壤酸性磷酸酶活性与脲酶活性呈显著负相关关系,相关系数为-0.46,说明不同的土壤酶活性之间相关性不一致。
3 讨论与结论
一般认为,土壤酶活性受土层深度的影响[9]。在本研究中也发现了类似现象,蔗糖酶、酸性磷酸酶、淀粉酶活性总体随土层加深而降低,这可能是因为表层土壤中自然凋落物较多,为微生物提供了充足的能源。本研究还表明,脲酶活性总体随土层深度的增加而增加,过氧化氢酶在不同土层的活性受施氮量影响差异较明显,而淀粉酶活性主要受施氮时间的影响,由此可推断土层的深度、施氮量、施氮时间等因素对土壤酶活性均有影响。
相对于不施氮处理的对照样地,施氮12个月后蔗糖酶活性在不同施氮水平下均得到提高,该结果与宋学贵等得出的氮沉降增加了川南天然常绿阔叶林土壤蔗糖酶活性的结论[3]相似,但却不同于沈芳芳等的中-低程度的氮沉降对蔗糖酶无影响的结论[10]。这可能是因为不同研究区域的植株对碳的吸收和利用能力不同[11]。白春华等研究表明,土壤中充足的养分供应有助于提高微生物活性,增加动植物分泌物,进而提高蔗糖酶活性[12]。此外,长期施氮会改变表层土壤微生物的功能多样性[13]。
本研究发现,施氮对土壤淀粉酶活性有促进作用,且该促进作用和土层深度及施氮时间等因素有关,0~10 cm土层淀粉酶活性更易受施氮的影响,施氮时间越长,对酶活性的促进作用越显著。在试验前期(3个月),低氮处理下,0~10 cm土层酸性磷酸酶活性受到显著促进作用,而高氮处理对酸性磷酸酶活性无显著影响,在试验中期(6个月),高氮处理下0~10 cm土层中酸性磷酸酶活性低于对照处理,而低氮处理下的酸性磷酸酶活性高于对照处理,说明低氮对土壤酸性磷酸酶具有一定的促进作用,高氮沉降则会抑制酶的活性,该结果与周晓兵等的研究结论[11]一致。
氮添加可以增加土壤中氮的含量,从而使脲酶活性增加,这可能与脲酶参与土壤中尿素的分解和氮素的循环有关[14]。在试验后期(12个月),氮沉降显著促进了0~10 cm土层脲酶活性,高氮处理显著促进了10~20 cm土层的脲酶活性,这与长期施氮能增加土壤和凋落物层脲酶活性的结论[15-16]一致。苏洁琼等的研究结果表明,施氮降低了土壤脲酶的活性[17]。氮添加对脲酶活性影响不一致的结果可能是由于不同研究区域的土壤理化性质、微生物群落结构和植被类型差异较大。
刘建国等认为,过氧化氢酶参与腐殖质的合成,其活性的提高有利于腐殖质的合成,其活性变化反映了土壤腐殖化和有机质的积累程度[18]。本研究结果显示,试验后期(12个月),在0~10 cm土层,不同施氮水平处理均促进了过氧化氢酶活性,其中高氮处理的促进作用更显著,这与众多前人研究结果[7,19]一致。氮沉降对10~20 cm土层过氧化氢酶活性无显著影响,杜锟等同样发现,氮添加对土壤过氧化氢酶活性无显著影响[20]。还有研究表明,氮添加对过氧化氢酶活性有抑制作用[21]。以上研究结果表明,不同水平氮沉降对不同土层的过氧化氢酶活性的影响存在差异,这可能与地域、植被、微生物群落结构等环境因素有关。
综上所述,氮沉降对樟树人工林土壤酶活性有重要影响。随着时间延长,氮沉降促进了0~10 cm土层过氧化氢酶、淀粉酶、蔗糖酶的活性,对酸性磷酸酶活性表现为先促进后抑制,对脲酶活性则表现为先抑制后促进。高氮沉降对过氧化氢酶、淀粉酶、脲酶活性的促进作用更为明显,而在低氮沉降下,酸性磷酸酶能总體保持更高的酶活性。另外,施氮水平对蔗糖酶活性的影响不大。不同氮沉降水平下,淀粉酶、酸性磷酸酶、蔗糖酶活性随土层深度的增加而降低,脲酶活性随土层深度的增加而增加,不同土层的过氧化氢酶活性受施氮时间的影响。
参考文献:
[1]Vitousek P M,Aber J D,Howarth R W,et al. Human alteration of the global nitrogen cycle:sources and consequences[J]. Ecological Applications,1997,7(3):737-750.
[2]樊后保,刘文飞,李燕燕,等. 亚热带杉木(Cunninghamia lanceolata)人工林生长与土壤养分对氮沉降的响应[J]. 生态学报,2007,27(11):4630-4642.
[3]宋学贵,胡庭兴,鲜骏仁,等. 川南天然常绿阔叶林土壤酶活性特征及其对模拟N沉降的响应[J]. 生态学报,2009,29(3):1234-1240.
[4]Galloway J N,Dentener F J,Capone D G,et al. Nitrogen cycles:past,present,and future[J]. Biogeochemistry,2004,70(2):153-226.
[5]de Vries W,Solberg S,Dobbertin M,et al. The impact of nitrogen deposition on carbon sequestration by European forests and healthlands[J]. Forest Ecology and Management,2009,258(8):1814-1823.
[6]闫钟清,齐玉春,彭 琴,等. 降水和氮沉降增加对草地土壤酶活性的影响[J]. 生态学报,2017,37(9):3019-3027.
[7]涂利华,胡庭兴,张 健,等. 华西雨屏区苦竹林土壤酶活性对模拟氮沉降的响应[J]. 应用生态学报,2009,20(12):2943-2948.
[8]关松荫. 土壤酶及其研究方法[M]. 北京:农业出版社,1986.
[9]杨万勤,王开运. 土壤酶研究动态与展望[J]. 应用与环境生物学报,2002,8(5):564-570.
[10]沈芳芳,袁颖红,樊后保,等. 氮沉降对杉木人工林土壤有机碳矿化和土壤酶活性的影响[J]. 生态学报,2012,32(2):517-527.
[11]周晓兵,张元明,陶 冶,等. 古尔班通古特沙漠土壤酶活性和微生物量氮对模拟氮沉降的响应[J]. 生态学报,2011,31(12):3340-3349.
[12]白春华,红 梅,韩国栋,等. 土壤3种酶活性对温度升高和氮肥添加的响应[J]. 内蒙古大学学报(自然科学版),2012,43(5):509-513.
[13]Zhang N L,Wan S Q,Li L H,et al. Impacts of urea N addition on soil microbial community in a semi-arid temperate steppe in northern China[J]. Plant and Soil,2008,311(1/2):19-28.
[14]Jin K,Sleutel S,Buchan D,et al. Changes of soil enzyme activities under different tillage practices in the Chinese Loess Plateau[J]. Soil & Tillage Research,2009,104(1):115-120.
[15]Saiya-Cork K R. Sinsabaugh R L,Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry,2002,34(9):1309-1315.
[16]Wang Q K,Wang S L,Liu Y X. Responses to N and P fertilization in a young Eucalyptus dunnii plantation:microbial properties,enzyme activities[KG*2]and[KG*2]dissolved[KG*2]organic[KG*2]matter[J]. Applied Soil Ecology,
2008,40(3):484-490.
[17]苏洁琼,李新荣,鲍婧婷. 施氮对荒漠化草原土壤理化性质及酶活性的影响[J]. 应用生态学报,2014,25(3):664-670.
[18]刘建国,张 伟,李彦斌,等. 新疆绿洲棉花长期连作对土壤理化性状与土壤酶活性的影响[J]. 中国农业科学,2009,42(2):725-733.
[19]樊后保,刘文飞,徐 雷,等. 杉木人工林土壤酶活性对氮沉降的响应[J]. 林业科学,2012,48(7):8-13.
[20]杜 锟,张江勇,林勇明,等. 邓恩桉(Eucalyptus dunnii)人工幼龄林土壤酶活性对模拟硫、氮复合沉降的响应[J]. 热带作物学报,2015,36(3):504-509.
[21]Waldrop M P,Zak D R,Sinsabaugh R L. Microbial community response to nitrogen deposition in northern forest ecosystems[J]. Soil Biology and Biochemistry,2004,36(9):1443-1451.

