吉林梅花鹿肌肉发育关联基因MyoG的鉴定及生物信息学分析
宋兴超,徐超,刘琳玲,丛波,杨福合,彭英华
(中国农业科学院特产研究所特种经济动物分子生物学重点实验室,长春 130112)
肌细胞生成素(Myogenin,MyoG)基因是成肌调节因子(Myogenic regulatory factors,MRFs)基因家族中唯一在畜禽骨骼肌细胞系中均可表达的基因。从胚胎肌纤维的形成、前体肌细胞的增殖及定型,到个体出生之后功能的完善及成熟,MyoG 基因均参与表达调控,它可以激活肌肉基因转录,提高细胞分化,是调控骨骼肌生长发育的关键因子[1]。MyoG 基因编码的碱性螺旋-环-螺旋蛋白(Basic helix-loop-helix protein,bHLH)参与肌细胞的形成与分化[2]。克隆MyoG 基因,解析该基因的结构特性,对提高畜禽的生产性能具有重要的理论意义与实践价值。
梅花鹿(Cervus nipon)属偶蹄目(Artiodactyla)、鹿科(Cervidae)、鹿属(Cervus),是一种珍贵的药用经济动物[3]。吉林梅花鹿(Jilin sika deer)属于茸用为主的地方梅花鹿品种,具有遗传性能稳定、高产、优质、抗病力强及耐粗饲的优良特性,其副产品鹿肉因高蛋白、低脂肪、低胆固醇的优异特性,对人体的血液循环与神经系统具有良好的调节作用[4]。随着人们生活水平的改善及对鹿肉营养价值认识的提高,鹿肉的消费需求日益增加,梅花鹿育种亦向肉用型或肉、茸兼用型方向发展,肉质性状将成为肉鹿育种工作中的研究热点。从分子水平解析梅花鹿肌肉发育及肉质性状关联候选基因和相关分子标记的调控机理,并以此为基础进行标记辅助选择,将成为提高梅花鹿产肉性能及改善肉品质的有效手段之一,同时,也将成为改良我国梅花鹿品种或者培育新型肉用品种的良好途径。研究表明,MyoG基因的遗传变异与畜禽肌纤维数量及其生长速度相关,是影响肌纤维特性、胴体品质及生长性状的关键候选基因[5-7],最终可能会导致畜禽产肉量与肉质的变异。近年来,人们对MyoG 基因的研究主要集中于猪[8-9]、牛[10-12]、山羊[13-14]和鸡[15-17]等物种,有关鹿科动物 MyoG 基因完整编码区序列结构特征及其在鹿骨骼肌发育过程中调控作用的研究相对薄弱,仅见甘肃马鹿该基因启动子区序列克隆分析、部分编码区SNPs 检测及全序列结构特性预测的相关报道[18-20]。本研究选取MyoG 基因作为肌肉发育性状关联基因,以吉林梅花鹿为研究对象,克隆MyoG 基因,并对其序列结构进行生物信息学预测及分析,为进一步充分利用 MyoG 基因选育优良肉用梅花鹿新品种以及开展梅花鹿分子标记辅助选择的研究奠定理论基础;同时,也为我国地方梅花鹿品种和培育品种MyoG 基因遗传多样性和群体遗传结构研究以及吉林梅花鹿品种遗传资源的合理保护与利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 血样 随机选择中国农业农村部长白山野生生物资源重点野外科学观测试验站茸鹿试验基地的健康成年雄性吉林梅花鹿5 头,麻醉后颈静脉采血5.0 mL,置于-20 ℃冰箱保存。
1.1.2 主要试剂 血液基因组DNA 提取试剂盒(溶液型)(北京百泰克生物技术有限公司);DL 2 000、DL 1 000 DNA 分子量标准、Ex Taq DNA 聚合酶、PCR 产物纯化试剂盒(TaKaRa 公司);琼脂糖(Promega 公司)。
1.2 方法
1.2.1 DNA 提取 利用试剂盒提取梅花鹿血液基因组DNA,通过紫外分光光度计及0.7%琼脂糖凝胶电泳检测其浓度及纯度,稀释为80 ngL,20 ℃保存。
1.2.2 引物设计 参照NCBI 中马鹿(FJ746497)、山羊(FJ607135)、牛(HM452338)与猪(U14331)MyoG基因序列,利用Primer Premier 5.0 软件在基因保守区设计6 对特异性引物(表1),由上海生工生物工程有限公司合成。6 对引物的扩增产物之间均有200 bp 左右的重叠区域,利于序列拼接。
1.2.3 PCR扩增及克隆测序 反应体系25µL:Ex Taq DNA 聚合酶(5 UL)0.25L,10 PCR Buffe(rMg2+Plus)2.5L,dNTPs 2.0L,模板 DNA 1.0L(80 ng/L),上、下游引物(10pmol/L)各1.0L,灭菌超纯水17.25L。反应循环参数:94 ℃预变性5min;94℃变性30 s,各引物退火温度见表1,退火30 s,72 ℃延伸43~60 s,35 个循环;72 ℃延伸 10 min;4 ℃保存。6 个 PCR 产物经1.2%琼脂糖凝胶电泳检测,将目的片段经过切胶、回收纯化后送上海生工生物工程有限公司进行克隆测序。
1.2.4 序列编辑、拼接及生物信息学分析 通过Chromas 2.6 软件对测序峰图进行校对;采用序列在线软件CAP3(http://doua.prabi.fr/software/cap3)拼接为一条完整序列,利用NCBI 数据库的BLAST 工具进行比对,GENSCAN(http://genes.mit.edu/GENSCAN.html)在线软件预测获得序列结构,参考NCBI 中登载的马鹿、山羊、牛和猪MyoG 基因序列注释信息明确梅花鹿该基因5 UTR、外显子、内含子及3 UTR 的长度。BioEdit 7.0 软件统计MyoG 基因编码序列碱基含量,利用 DNAMAN 5.2.2.0 软件的 Translate 程序翻译出氨基酸序列,分析编码氨基酸序列组成与结构特性。利用在线工具Conserved Domains 预测MyoG 蛋白保守结构功能域(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);在线软件Motif Scan(http://myhits.isbsib.ch/cgi-bin/motif_scan)预测编码蛋白潜在功能基序;NetPhos 2.0 工具(http://www.cbs.dtu.dk/services/)预测广泛磷酸化位点。
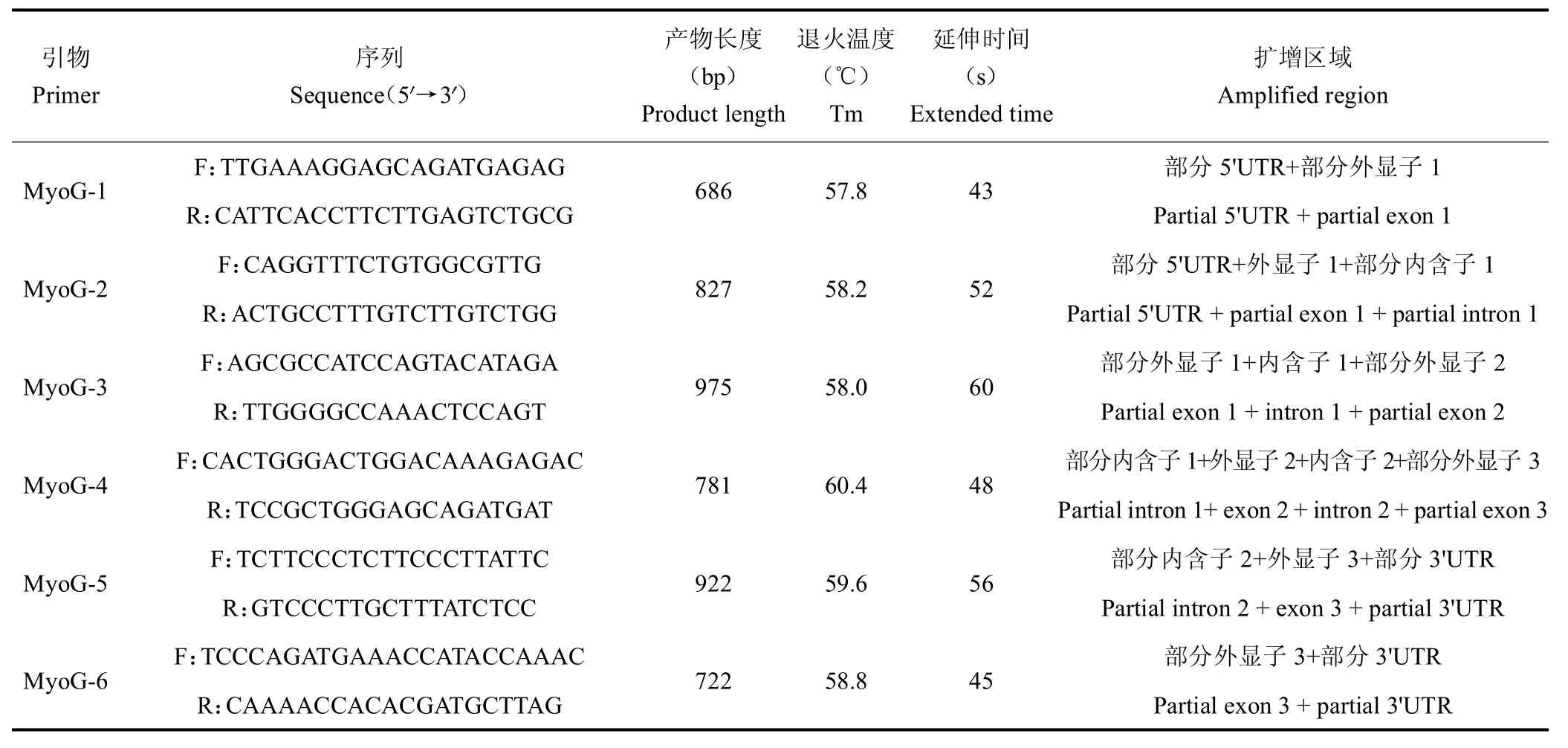
表1 扩增梅花鹿MyoG 基因序列引物信息Table 1 Information of primer sequences for amplifying sika deer MyoG gene
1.2.5 序列相似性比对及基于氨基酸序列聚类分析将获得的吉林梅花鹿MyoG 基因序列在GenBank 数据库中进行BlastN 比对,下载甘肃马鹿(FJ746497)、印度水牛(KC107779)、普通牛(AB257560)、牦牛(KC184120)、山羊(KX056119)、绵羊(NM_001174109)、猪(NM_001012406)、家马(NM_001317250)、人(NM_002479)、家 兔(NM_001177749)、小 家 鼠(NM_031189)、褐 家 鼠(NM_017115)、原 鸡(FJ882411)、火鸡(NM_001303170)和鹅(KP893286)的 MyoG 基因编码核苷酸及氨基酸序列,利用DNAMAN 5.2.2.0 软件的多重序列比对程序分别进行MyoG 基因编码区核苷酸及氨基酸序列相似性分析,并基于该基因编码氨基酸序列的比对结果选择MEGA软件的Phylogenetic Tree 构建分子系统进化树,分析物种间的亲缘进化关系。
2 结果与分析
2.1 PCR扩增
以吉林梅花鹿血液基因组DNA为模板,利用表1中引物,采用PCR技术扩增出6 对特异性产物(图1)。6 对片段大小与预期设计扩增长度一致、条带单一、清晰,无拖尾,表明扩增效果较好,可用于后续克隆测序。
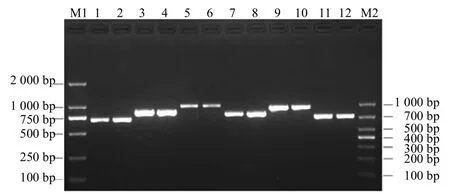
图1 梅花鹿MyoG 基因6 对引物PCR 产物电泳结果Fig.1 Electrophoresis result of the products of MyoG gene in sika deer from 6 pairs primers
2.2 克隆测序及氨基酸序列分析
将目的基因纯化后送上海生工生物工程有限公司进行克隆测序,对测序结果进行人工校对、拼接,所得序列长度为3 162 bp,与NCBI 中甘肃马鹿、印度水牛和山羊MyoG 基因序列的相似性分别达99%、94%和92%(图2)。结果初步表明,本研究获得的序列即为吉林梅花鹿MyoG 基因序列。通过GENSCAN 在线软件分析可知,梅花鹿MyoG基因包括3 个外显子、2 个内含子及部分 5 UTR(381 bp)、3 UTR(690 bp),3 个外显子核苷酸长度分别为480、82 和122 bp,2 个内含子为799、608 bp,该序列已提交GenBank,登载号为HZ56689。
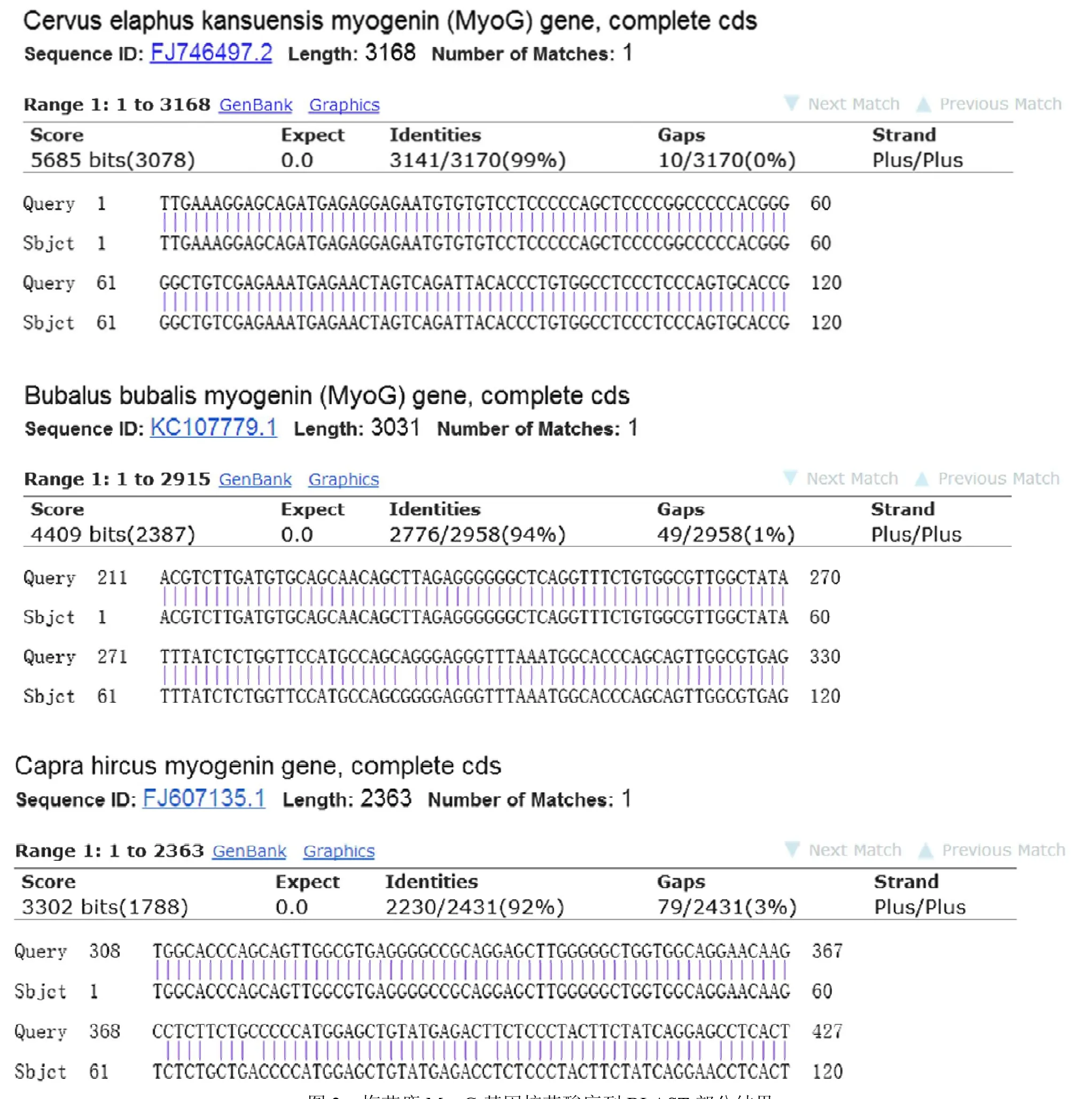
图2 梅花鹿MyoG 基因核苷酸序列BLAST 部分结果Fig.2 Partial results of BLAST for nucleotide sequence of sika deer MyoG gene
梅花鹿MyoG 基因的CDS 序列和推导的氨基酸序列如图3 所示,应用NCBI 的ORF Finder 程序分析梅花鹿MyoG 基因序列,并参照Kozak 法则[21],获得ORF,起始密码子ATG 位于382 bp 处,终止密码子为TGA,由此得出,梅花鹿MyoG 基因CDS 区核苷酸序列全长684 bp,共编码227 个氨基酸,其中酸性氨基酸31 个(D 和E,13.66%)、碱性氨基酸 33 个(K、R 和 H,14.54%)、极性氨基酸58 个(N、C、Q、S、T、Y,25.55%)、疏水性氨基酸 105 个(M、A、I、L、F、W、V、P和G,46.26%)。进一步分析发现,编码序列中碱基A、C、G、T的平均含量分别为20.61%、32.46%、30.12%和16.81%,G+C 含量较高(62.58%),A+T 含量为37.42%。

图3 梅花鹿MyoG 基因编码氨基酸序列分析Fig.3 Analysis of amino acid sequence coded by sika deer MyoG gene
2.3 编码蛋白保守结构域及功能基序预测
将推导的吉林梅花鹿MyoG蛋白通过NCBI网站的保守结构功能域进行预测(图4)可知,1~89 位氨基酸为MYOD 家族特有的碱性结构域(Basic domain),85~136 位氨基酸为螺旋-环-螺旋 DNA 结合结构域(Helix-loop-helix DNA binding domain)。通过在线软件NetPhos 3.1 Server 中对MyoG 基因编码氨基酸序列进行磷酸化位点预测(图3),吉林梅花鹿MyoG 基因编码氨基酸序列含有21 个激酶磷酸化位点,其中3个 Tyr 位点、2 个 Thr 位点和 16 个 Ser 位点,主要能够被unsp、PKA、CKI、PKC、PKG、cdc2、cdk5 等蛋白激酶磷酸化;而Motif Scan 软件分别预测到1 个核定位信号蛋白(85~99:RRRAATLREKRRLKK)、4 个酪蛋白激酶磷酸化位点(90~93:TLRE,178~181:SALE,206~209:SIVD,212~215:TVED)、1 个蛋白激酶 C 磷酸化位点(90~92:TLR)和2 个单环磷酸腺苷磷酸化位点(77~80:KRKS,108~111:KRST)。
2.4 梅花鹿与马鹿MyoG基因序列比对
编码核苷酸序列比对表明,梅花鹿与NCBI 中公布的马鹿MyoG基因CDS区存在6 个变异位点:219、243、646、647、648 和 653 bp,其中,243 bp 处为同义突变,其他为错义突变,分别引起第73 位半胱氨酸(Cys,C)变为精氨酸(Arg,R),第 216 位丝氨酸(Ser,S)变为缬氨酸(Val,V),第 218 位丙氨酸(Ala,A)变为缬氨酸(Val,V)(图5)。
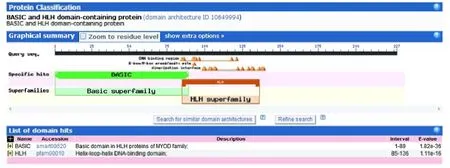
图4 梅花鹿MyoG 基因编码氨基酸序列保守结构功能域Fig.4 Conserved domain of the protein encoded by sika deer MyoG gene

图5 梅花鹿与马鹿MyoG 基因氨基酸序列比对结果Fig.5 Sequence comparison result of MyoG gene amino acid between sika deer and wapiti
2.5 不同物种MyoG基因序列相似性比对及系统进化树构建
利用DNAMAN 5.2.2.0 软件的多重序列比对程序将梅花鹿与其他物种 MyoG 基因编码区核苷酸及推导氨基酸序列进行同源性比对,结果表明,吉林梅花鹿与甘肃马鹿、印度水牛、牦牛、普通牛、山羊、绵羊、家马、猪、家兔、小家鼠、褐家鼠、人、原鸡、火鸡、鹅的MyoG基因编码区核苷酸序列相似性分别为99.12%、96.64%、95.91%、95.32%、96.64%、96.49%、89.77%、90.79%、87.48%、87.43%、87.13%、89.47%、70.27%、68.11%和 71.43%,推导氨基酸序列相似性分别为98.68%、97.36%、96.92、96.48%、96.92%、96.92%、92.07%、95.15%、91.67%、92.51%、91.63%、92.51%、68.83%、67.97%和69.70%。系统进化树表明(图6),梅花鹿MyoG 氨基酸序列与马鹿、印度水牛、牦牛、普通牛、山羊及绵羊相似性较高,在系统进化树中距离较近,聚为一支。MyoG 的系统进化树与其生物进化的物种树保持基本一致,符合物种的进化规律,表明MyoG 基因的编码区在物种间相对保守。
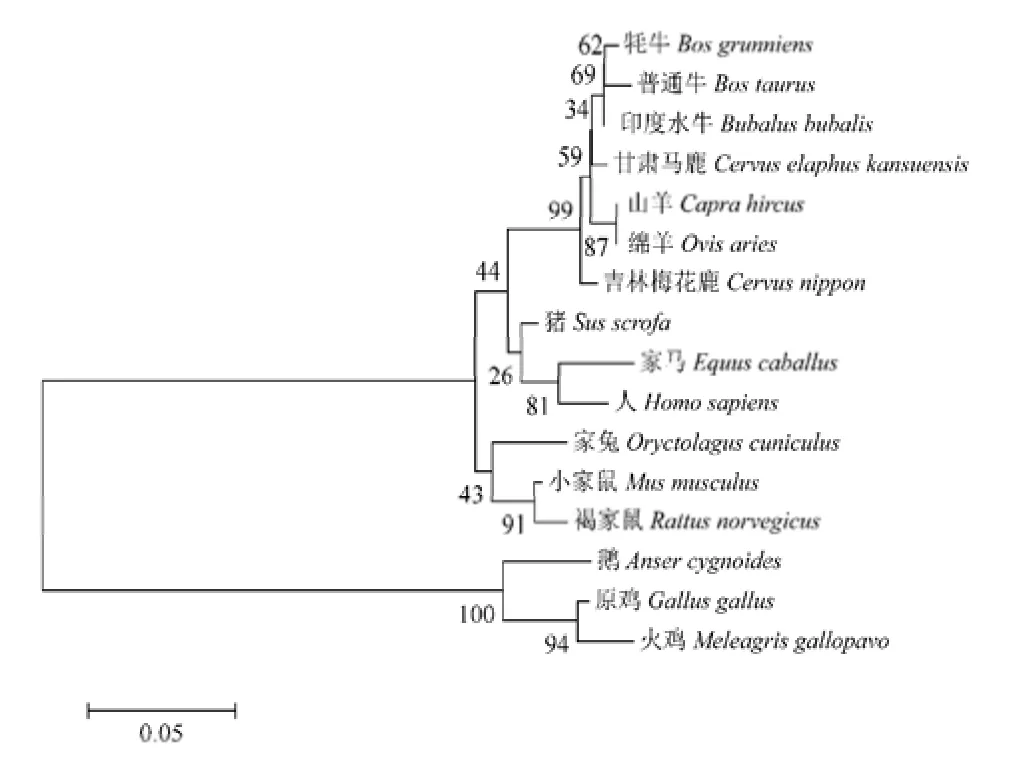
图6 16 个物种MyoG 氨基酸序列系统进化树Fig.6 Aminoacidsequence phylogenetic tree of 16species MyoG
3 讨论
目前,国内、外对肌细胞生成素基因功能的研究相对较少,在特种经济动物梅花鹿MyoG 基因中的研究尚属空白。本试验根据已知哺乳动物基因序列信息,利用与梅花鹿亲缘关系最近的马鹿 MyoG 基因序列设计引物,采用PCR、基因分段克隆及Sanger 测序技术,成功获取了吉林梅花鹿MyoG 基因全长核苷酸序列,进一步利用生物信息学方法对MyoG 基因编码蛋白的结构特性进行了预测与分析,为深入解析梅花鹿MyoG基因调控肌肉生长发育机理提供了分子生物学基础信息和理论依据。
MyoG 是生肌调节因子家族的重要成员之一,属于碱性-螺旋-环-螺旋转录因子,并且MyoG 是成肌调节因子MRFs家族中唯一可在所有骨骼肌细胞系中均可表达的基因,属于肌肉特异性启动子,其在调控成肌细胞分化为成熟肌肉细胞的过程中具有十分重要的作用[22]。另外,bHLH 结构是MRFs 家族的保守区,与DNA结合以及激活转录有关,也是和其他基因相互作用的位点[23],因此bHLH 结构是鉴定该家族基因的重要依据之一。本研究获得的梅花鹿 MyoG 基因编码的氨基酸序列经NCBI网站的保守结构功能域在线软件分析表明,含有该类基因典型的bHLH 结构域位于梅花鹿MyoG 推导氨基酸肽链的1~136 位,在该基因外显子 1 内。Soumillion 等[24]研究发现,猪 MyoG 基因外显子1 也编码bHLH结构域,且猪、小鼠与人该基因bHLH 结构域氨基酸序列完全一致。刘铮铸等[25]和赵子贵等[26]在山羊MyoG 基因中也获得了类似的结果,本研究结果与之一致。因此,从推导氨基酸序列保守结构域角度也证明了本研究获得的梅花鹿核苷酸序列即为其MyoG 基因。
本研究通过分段克隆吉林梅花鹿 MyoG 基因完整外显子及内含子区,将拼接获得的编码区核苷酸序列与GenBank 中甘肃马鹿MyoG 基因的同源序列进行比对,发现共有6 处发生碱基变异。对比梅花鹿与马鹿MyoG氨基酸序列,相似性为98.68%,仅第73 位由半胱氨酸(Cys)变为精氨酸(Arg),第 216 位由丝氨酸(Ser)变为缬氨酸(Val),第 218 位由丙氨酸(Ala)变为缬氨酸(Val)。梅花鹿与水牛、牦牛、普通牛、山羊、绵羊、家马、猪、家兔、小家鼠、褐家鼠、人等物种MyoG基因氨基酸相似性均大于91%,但与原鸡、火鸡、鹅的相似性较低。从本研究比较的16 个物种中核苷酸和氨基酸水平的变异来看,各物种间核苷酸水平的变异程度要明显高于氨基酸水平的变异,这可能是由于梅花鹿与各物种在核苷酸水平上的多数碱基替代或转换并没有引起编码氨基酸的改变,属于同义突变,也初步表明 MyoG 基因的编码区在长期的生物进化过程中保守性较强。同时,基于该基因编码的氨基酸序列构建的系统进化树也显示,梅花鹿与同为反刍亚目的马鹿、牛及羊的亲缘关系较近,聚为一支,该结果与梁春年等[27]、占思远等[28]及王强辉等[29]分别利用牦牛胰岛素样生长因子1 受体(IGF1-R)基因、南江黄羊胰岛素样生长因子结合蛋白2(IGFBP-2)基因及驯鹿表皮生长因子受体(EGFR)基因构建反刍亚目分子系统进化树得到的结果趋于一致。

