鹿茸干细胞p21基因表达水平及其对细胞周期的影响
郭倩倩,王大涛,孙红梅,李春义
(中国农业科学院特产研究所,长春 130112)
鹿茸是哺乳动物中可以完全再生的附属器官[1]。Li 等[2-3]研究发现,鹿茸再生是基于干细胞的过程。鹿茸干细胞包括生茸区骨膜细胞(Antlerogenic periosteal cells,APCs)与角柄骨膜细胞(Pedicle periosteal cells,PPCs),它们分别是鹿茸发生与再生的关键[4]。有限的鹿茸干细胞通过井然有序地快速分裂增殖与分化,生成完整的鹿茸组织[2]。然而,参与这一过程的分子机制还不是很清楚。
组织再生最基本的生物学特征之一是细胞的快速分裂增殖,这一过程离不开严格的细胞周期调控。研究发现,再生模型(如蝾螈、两栖动物、哺乳动物肝脏、MRL 品系小鼠等)中,再生细胞表现出一种独特的细胞周期表型,即细胞大多数阻滞于G2/M 期[5-7]。在MRL 品系小鼠的再生模型中,Bedelbaeva 等[8]证实,组织再生与p21 基因的不表达有关,敲除p21 基因的非再生小鼠获得了再生表型,同时,也表现出G2/M阻滞的细胞周期分布,由此,揭示了p21 基因与再生有着密不可分的联系。
p21蛋白是一种细胞周期蛋白依赖性激酶抑制剂,参与细胞周期调控机制,是细胞周期监测点的重要组成部分[9-10]。当细胞检测到染色体DNA 在G1/S 期受到损伤时,p53 基因转录活性增强,p21 基因被激活,阻止细胞进一步增殖,直到DNA 损伤修复完成,以此确保遗传物质精确传递给下一代[11-13]。缺乏p21 基因则可能会导致细胞G1/S监测点的功能缺陷,造成对G2/M监测点的依赖,表现出G2/M 阻滞的特殊细胞周期表型,同时,也会带来细胞失控性增殖的潜在威胁[8,14-17]。
鹿茸再生是一种重要的哺乳动物组织器官再生模型,推测p21 蛋白在鹿茸干细胞周期调控与鹿茸再生中扮演着重要角色。本试验以鹿脸部骨膜细胞(Facial periosteal cells,FPCs)为对照细胞,研究鹿茸干细胞(APCs 与PPCs)中p21 基因的表达水平,初步探讨该基因在鹿茸干细胞中的功能性作用,以期为从细胞周期角度阐明鹿茸再生的分子机制奠定基础。
1 材料
1.1 质粒、菌株和细胞
包膜质粒pMD2.G、包装质粒pCMV-dr8.91(北京全式金生物技术有限公司);鹿茸干细胞(APCs、PPCs、)、FPCs、人胚肾细胞 293t、感受态细胞 DH5甘油菌、p21RNA 干扰慢病毒载体―重组质粒pLVTHM(靶向p21shRNA 序列为:shRNA 正义链5-cgcgtcccc GCGGTGGAACTTCGACTTT ttcaagaga AAAGTCGAAGTTCCACCGC tttttggaaat-3;shRNA 反义链5-cgatttcca aaaa GCGGTGGAACTTCGACTTT tctcttgaa AAAGTCGAAGTTCCACCGC gggga-3)(中国农业科学院特产研究所吉林省省部共建特种经济动物分子生物学国家重点实验室分离、构建并保存)。
1.2 试剂
大量质粒DNA 提取试剂盒(Qiagen 公司);酵母提取物、胰蛋白胨、氨苄青霉素、RNaseA、二甲基亚酚(Sigma公司);NaCl、无水乙醇、氯仿(北京化工厂);改良型杜氏培养基(DMEM)、胰蛋白酶、Lipofectamine 2 000(Invitrogen 公司);干细胞专用胎牛血清 FBS(Clark 公司,);碘化丙啶(PI)、UNlQ-10 柱式 Trizol 总RNA抽提试剂盒(生工生物工程有限公司);反转录试剂盒(大连TaKaRa 公司);荧光定量试剂盒(Roche 公司);其他常规试剂均为进口或国产分析纯。
1.3 仪器
BD FACSCalibur 流式细胞仪(美国Becton,Dickinson and Company公司)、ABI7500 荧光定量PCR仪(Applied Biosystems 公司)。
2 方法
2.1 qRT-PCR鉴定p21mRNA的表达水平
RNA 抽提试剂盒提取 APCs、PPCs、FPCs 细胞总RNA,并检测260、280 nm处的OD值,确定所提RNA的浓度和纯度。反转录试剂盒将总 RNA 反转录为cDNA,并以其为模板,使用Roche 试剂盒进行荧光定量PCR 反应,以Actin 基因用于校正结果的内参基因,每个样品设3 个重复。反应条件:95℃预变性15min,94 ℃变性 15 s,56 ℃退火 30 s,72 ℃延伸 32 s,共 40个循环。
针对p21 基因,设计荧光定量PCR 上、下游引物:上游引物5-GACCACTTGGACCTGTCGCT-3;下游引物5-GGGTTAGGGCTTCCTCTTGG-3。
针对Actin 内参基因,设计荧光定量PCR 上、下游引物:上游引物5-GCGTGACATCAAGGAGAAGC-3;下游引物5-GGAAGGACGGCTGGAAGA-3。
2.2 流式细胞术检测细胞周期
取指数增长期的APCs、PPCs、FPCs 细胞进行胰酶消化,1 000 r/min 5 min 离心收集细胞;4℃预冷的PBS 缓冲液清洗细胞2 次,加入2 mL 预冷75%乙醇,混匀后-20 ℃过夜,固定细胞。1 000 r/min 5 min 离心,弃固定液,加入RNAase(50µg/mL),37 ℃孵育 30 min。300目筛网过滤置干净流式管中,加入PI染液(50µg/mL),避光染色30 min。上流式细胞仪,Multi SET 软件收集细胞,ModFit LT软件分析细胞周期,每组设3 个重复。
2.3 慢病毒三质粒系统的无内毒素大量提取
将重组质粒pLVTHM、包装质粒pCMV-dr8.91 与包膜质粒pMD2. G 分别转化大肠杆菌Stbl3 并涂布,过夜培养。挑取单菌落进行小量扩增,按照1∶500 的比例将菌液稀释至100mLLB液体培养基(Amp 100g/mL)中,37 ℃、220 r/min 过夜振荡培养。OD 值约 0.8 时,使用Qiagen 无内毒素大量质粒提取试剂盒提取质粒。
2.4 慢病毒颗粒的制备
在10 cm 细胞培养皿中接种2 106个293t 细胞,37 ℃、5%CO2 的细胞培养箱中过夜培养,当细胞融合度为80%~90%时,即可进行转染。对于每皿细胞,将24DNA(pLVTHM∶pCMV-dr8.91∶pMD2.G 质量比为2.00∶1.50∶0.75)与 60L Lipofectamine 2 000,加入到1.5 mL 无血清DMEM 培养基中并轻轻混匀,室温孵育15 min。更换细胞培养皿中的DMEM 完全培养基,分别逐滴加入上述混合液,轻轻混匀,37 ℃、5%CO2 培养24 h。倒置显微镜下检测表达GFP 的阳性细胞数,以确定转染效率,若转染效果较好,则进行第1 次收毒。0.45m 滤膜过滤上清液,将滤液置于MilliporeAmicon Ultra-15离心超滤管中,12 000 r/min、4 ℃离心30 min。弃废液,将滤后浓缩病毒液分装于干净无菌的1.5 mL 冻存管,-80 ℃或液氮保存。转染48 h后进行第2 次收毒。
2.5 APCs的慢病毒感染
胰酶消化APCs,并进行细胞计数,接种细胞于6孔板中,每孔加完全培养基2 mL。待细胞贴壁且细胞密度在 50%~70%时,更换新的细胞培养基,接种“1.2.4”项下0.22m 滤膜过滤后的浓缩病毒液200L,37 ℃、5%CO2 培养箱孵育。24 h 后,每隔 12 h 观察GFP荧光的表达情况,以确定感染效率;72 h后进行传代,扩增被感染的APCs。试验共设3 组,即稳定转染重组质粒的p21 干扰组(p21-shRNA)、稳定转染空白载体的空白对照组(Blank control)以及未转染的对照组(Control)。
3 结果与分析
3.1 APCs、PPCs与FPCs中p21基因mRNA的表达水平
以FPCs 作为对照细胞进行qRT-PCR,利用7 500 System software 对鹿茸干细胞(APCs 和 PPCs)与对照细胞中p21 基因mRNA 表达水平进行测定、分析。结果如图1 所示,FPCs 中p21 基因mRNA 的相对表达量为 0.299±0.103,明显低于 APCs(1.000±0.286)和PPCs(0.832±0.103),即鹿茸干细胞中 p21 基因mRNA 的表达高于对照细胞,差异具有统计学意义(P < 0.05);APCs 与 PPCs 中 p21mRNA 的相对表达量差异不显著(P > 0.05)。
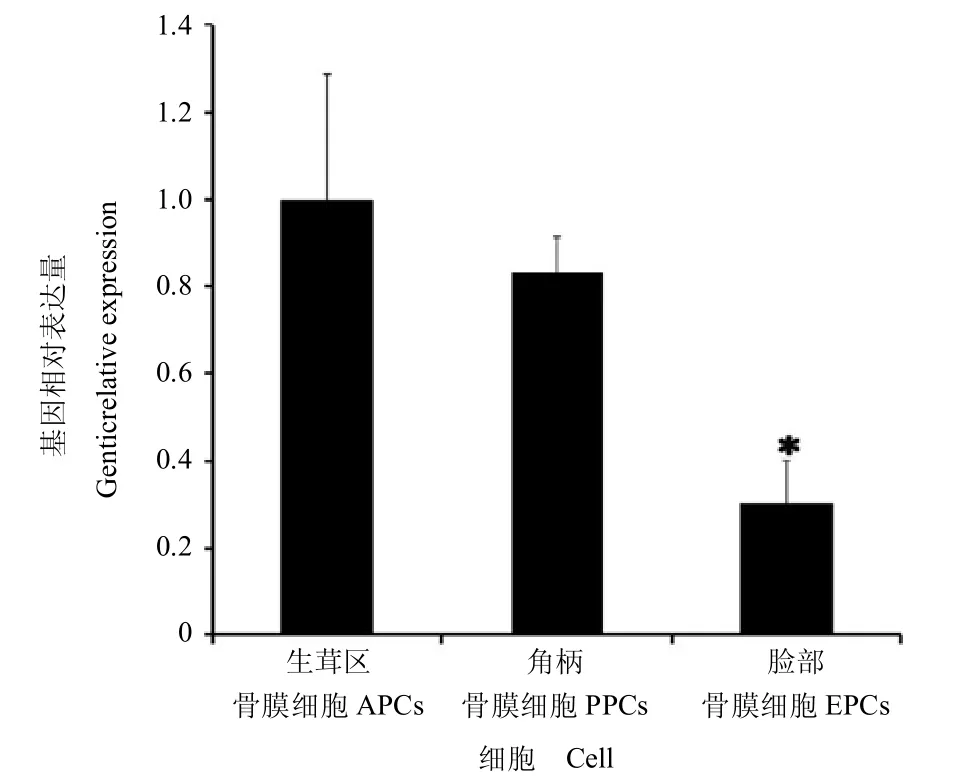
图1 qRT-PCR 鉴定 APCs、PPCs 与 FPCs 中 p21 基因 mRNA的表达水平Fig.1 Quantitative identification of p21mRNA expression in APCs,PPCs and FPCs by qRT-PCR
3.2 APCs、PPCs与FPCs的细胞周期分布
以FPCs 作为对照细胞,利用ModFit LT 软件对鹿茸干细胞(APCs和PPCs)与对照细胞的细胞周期分布情况进行检测、分析。结果如图2 所示,APCs、PPCs和FPCs的细胞周期分布相似,无明显差异;表1 显示,APCs、PPCs 和FPCs各时段的细胞周期比例差异无显著性,即鹿茸干细胞(APCs 和PPCs)与对照细胞的细胞周期分布无明显差异。
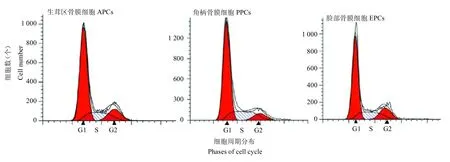
图2 APCs、PPCs 与 FPCs 细胞周期分布Fig.2 Cell cycle of APCs,PPCs and FPCs

表1 APCs、PPCs、FPCs 细胞周期分布比例Table 1 Cell cycle distribution ratio of APCs,PPCs and FPCs (n=3)(%)
3.3 重组慢病毒感染APCs
由重组慢病毒感染的 APCs 经过传代扩增培养后,获得了大量且纯度较高的阳性细胞。图3 为倒置显微镜下的观察结果,如图所示,在荧光显微镜下,p21基因干扰组与空白对照组细胞均表达较强的荧光(图3-A、C),且分布均匀;在光学显微镜下可观察到APCs生长状况良好,基本无细胞碎片及死细胞(图3-B、D)。通过细胞计数,得出干扰效率约为90%,利于后续试验的要求,即利于对p21 基因干扰效果的检测。
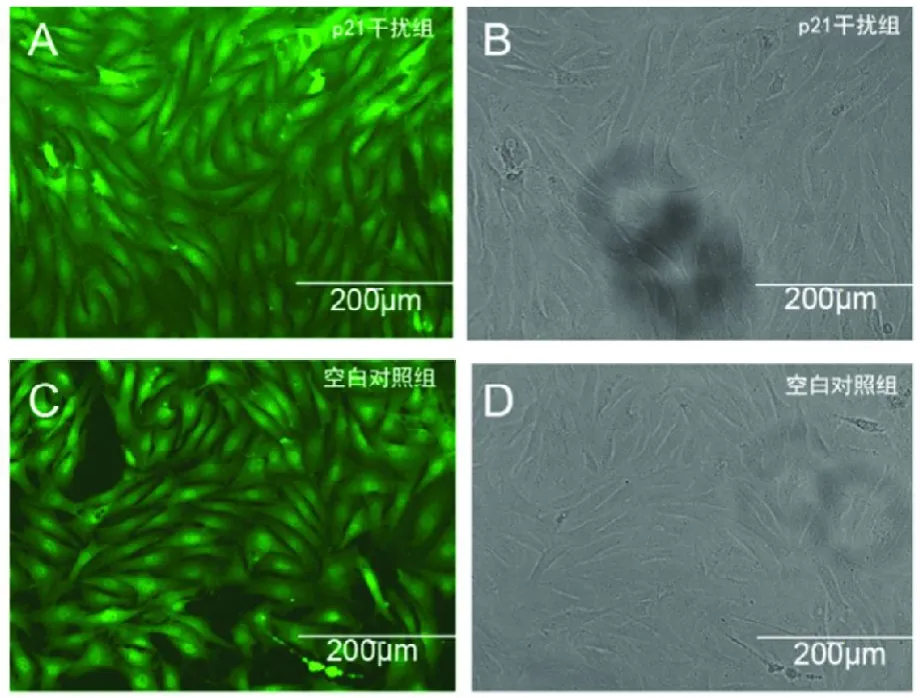
图3 APCs 感染效果检测Fig.3 Effects of infection on APCs
3.4 APCs中p21基因干扰效果的确认
利用 qRT-PCR 对 APCs 中 p21 基因的干扰效率进行检测。p21 基因干扰组细胞的 mRNA 表达量(0.327±0.062)明显低于对照组(1.000±0.125)以及空白对照组(0.901±0.232),差异有统计学意义(P<0.05);空白对照组与对照组之间差异不显著(P >0.05),说明载体本身对APCs 中p21 基因的表达影响较小,可以忽略。由此可确定,携带p21-shRNA 的表达载体可有效沉默 APCs 中 p21 基因的表达,沉默效率为67.3%。结果见图4。
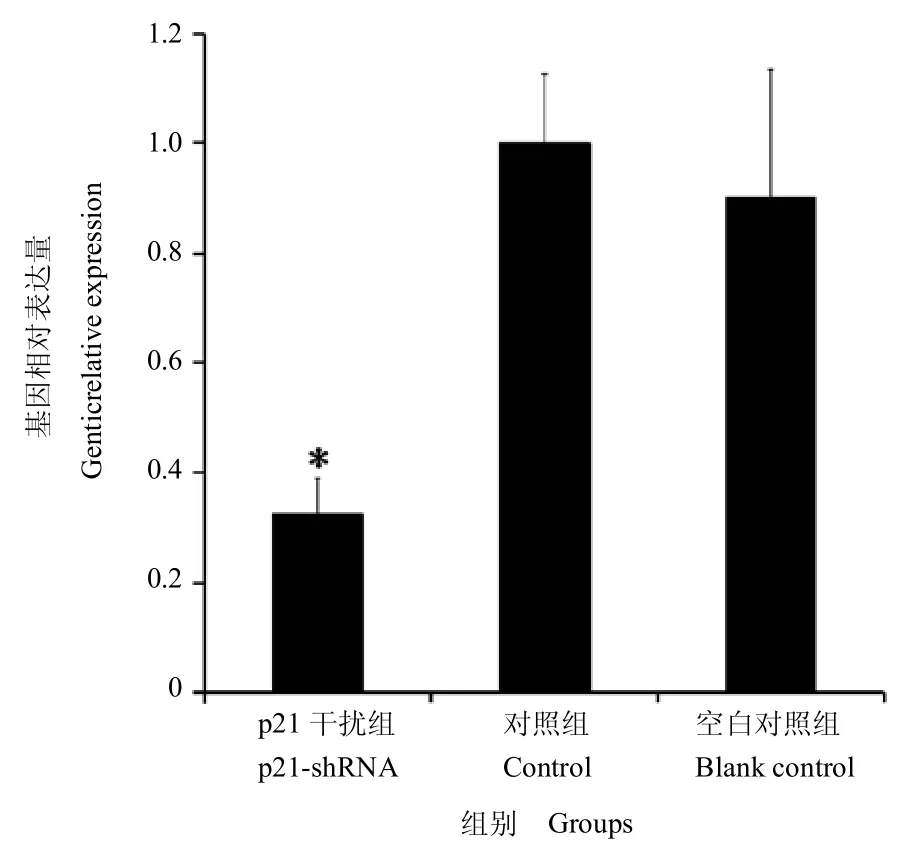
图4 qRT-PCR 鉴定APCs 中p21 基因的干扰效果确认Fig.4 Identification of p21 gene interference in APCs by qRTPCR
3.5 干扰p21基因对APCs周期的影响
利用流式细胞术分析干扰p21 基因对APCs 周期的影响。3 组细胞的细胞周期分布相似,无明显差异。p21 干扰组与空白对照组以及未转染的对照组相比,APCs 细胞各时段的细胞周期比例差异无显著性,即干扰p21 基因对APCs 周期无明显影响。结果见图5、表2。
4 讨论
鹿茸再生作为一种哺乳动物组织器官再生模型,是一种基于干细胞的割处再生[2,18],这一点不同于传统再生模型,因此,鹿茸再生机制成为研究热点。对传统再生模型的研究发现,细胞周期分布与再生有着紧密的联系[18],并且,近年来对MRL品系小鼠的研究已经证实,p21 基因与小鼠再生有着密不可分的关系[7],在鹿茸再生中这些都尚未有相关研究报道。本研究利用qRT-PCR、流式细胞术以及RNAi技术,对鹿茸再生与细胞周期分布、p21 基因表达之间的关系做了初步探索,为后续更深入的研究奠定了基础。
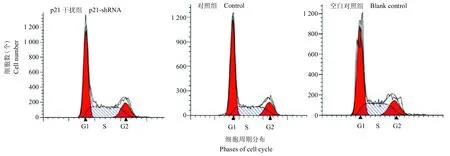
图5 干扰p21 基因后APCs 周期分布Fig.5 Cell cycle of APCs after downregulation of p21 gene

表2 干扰p21 基因后APCs 周期分布比例Table 2 Cell cycle of APCs after downregulation of p21 gene (n=3)(%)
Bedelbaeva 等[8]报道,MRL 品系小鼠的再生与p21 基因的低表达有关。与这一报道相反的是,本研究经过qRT-PCR 鉴定发现,p21 基因在鹿茸干细胞中高表达。p21 基因的主要作用是细胞周期的调控[19],而本研究利用RNAi 技术,干扰p21 基因的表达并没有影响鹿茸干细胞的细胞周期分布。p21 基因除细胞周期调控外,还参与多种细胞代谢反应,如细胞衰老、细胞凋亡等[10,20]。基于p21 基因在鹿茸干细胞中的高表达,推测虽然p21 基因在细胞周期调控中没有发挥不可或缺的作用,但可能以某种其他的功能在鹿茸再生中发挥着作用,这需要进一步研究。
组织再生离不开细胞增殖,处于快速增殖中的细胞在受到内部与外部压力时受到严格的细胞周期调控,一旦调控系统紊乱,则易遭受癌变的危险[17,21-22]。完整的细胞周期必须严格按照G1-S-G2-M顺序进行,在长期进化过程中,为了精确调控细胞周期的有序进行,防止由于细胞失控性增殖引发肿瘤,细胞建立了一类内在监测点机制。细胞检测到异常事件,如DNA 损伤时,G1 监测点启动,细胞周期停滞,直到异常事件消除,重新进入细胞周期[10-12]。因此,若G1 监测点功能缺失,则有可能导致对G2/M监测点的依赖,从而表现G2/M 阻滞的特殊细胞周期表型。有趣的是,水螅、蝾螈、哺乳动物肝脏以及MRL 品系小鼠等再生模型都表现出这样一个特殊的细胞周期表型。敲除p21 基因的非再生小鼠不仅表现出同MRL 品系小鼠相同的再生表型,而且相关的再生细胞也出现G2/M阻滞现象,由此确定,G2/M 期细胞的积累与再生有关,细胞周期的变化可能是具有再生能力动物的一种共性。
G2/M 阻滞的特殊细胞周期有利于细胞的快速增殖,从而促进再生,但同时由于G1/S 监测点机制功能的缺陷,增加了细胞周期调控紊乱以及细胞失控性增殖的可能性,从而导致肿瘤的发生。本研究发现,与以上再生模型不同的是,鹿茸干细胞并没有表现G2/M阻滞这一特殊的细胞周期,并且这一表型不会由于p21基因的缺失而改变,由此说明,与其他再生模型相比,鹿茸干细胞可能拥有一套更完善更严格的细胞周期调控系统。因此,鹿茸再生不仅为我们提供了一个哺乳动物组织器官再生模型,而且为研究如何保证组织器官再生的同时防止肿瘤的发生提供了一个较佳的机会。
——一道江苏高考题的奥秘解读和拓展

