电针对痛觉敏化诱发大鼠脊髓背角p38丝裂原活化蛋白激酶/肿瘤坏死因子-α的影响
项璇儿 许颖龄 杜俊英 方剑乔 房军帆
1.浙江中医药大学第三临床医学院 杭州 310053 2.浙江省针灸神经病学重点实验室3.浙江中医药大学附属第三医院
长期以来,慢性疼痛困扰着临床医生,是临床治疗的一大难题。而慢性疼痛发病机制复杂,已有的药物治疗手段疗效并不理想[1]。目前,除了直接针对慢性疼痛进行治疗外,阻止急性疼痛向慢性疼痛转化是慢性疼痛治疗的另一思路[2]。在急性疼痛向慢性疼痛转化时,疼痛的发病机制会发生明显变化,现有研究表明痛觉敏化诱发现象即标志着急慢性疼痛转化的发生[3]。最新研究证实,脊髓背角与疼痛转化密切相关[4],脊髓背角丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路与多种疼痛的产生与维持相关[5-6],其中p38是MAPK家族中的重要成员,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是p38 MAPK的重要下游物质。研究证明,脊髓背角小胶质细胞中p38 MAPK/TNF-α信号通路是造成慢性疼痛的关键环节[7]。电针(electroacupuncture,EA)作为常用的临床治疗手段,可有效治疗急性炎性疼痛和慢性炎性疼痛[8-12]。最新研究显示,EA能有效抑制急性痛向慢性痛的转化,而且可能是通过外周背根神经节发挥效应[13],但EA阻止疼痛转化是否通过脊髓背角小胶质细胞中p38 MAPK/TNF-α信号通路则尚未见于报道。
本研究通过痛觉敏化诱发建立急慢性疼痛转化模型,观察EA对疼痛转化大鼠热痛阈(thermal pawwithdrawal latency,TPWL)、机械性痛阈(mechanical paw-withdrawal threshold,MPWT)变化的影响,以及对脊髓背角p38 MAPK/TNF-α信号通路的蛋白表达调控,为EA干预疼痛转化的脊髓机制研究提供初步依据。
1 材料和方法
1.1 实验动物及分组 清洁级健康雄性SD大鼠82只,体质量(180±20)g,购于上海西普尔-必凯实验动物有限公司[实验动物生产许可证号:SCXK(沪)2018-0006],饲养于浙江中医药大学实验动物中心[实验动物使用许可证号:SYXK(浙)2018-0012],饲养环境湿度恒定,室温(23±2)℃,灯光12h循环。实验开始前,所有大鼠适应性饲养5d,均予充足的啮齿类动物标准颗粒饲料喂饲,自由饮水。实验共分两部分进行,第一部分选择34只大鼠,采用完全随机法分为3组,即空白组11只,其中5只用于MPWT检测,6只用于TPWL检测;假敏化组11只,其中5只用于MPWT检测,6只用于TPWL检测;敏化组12只,其中6只用于MPWT检测,6只用于TPWL检测。第二部分将余下48只大鼠随机分为4组,即假敏化组、敏化组、假电针(sham electroacupuncture,sham EA) 组和 EA组,每组12只,其中6只用于MPWT检测,6只用于TPWL检测。
1.2 试剂和仪器 TNF-α抗体购于美国Abcam公司(批号:ab6671);p38 MAPK抗体购于美国 Cell Signaling公司(批号:D13E18690);角叉菜胶、前列腺素E2(prostaglandin E2,PGE2)均购于美国Sigma公司(批号:101717387、1001077861)。华佗牌针 灸 针(0.18mm×13mm)、LH-200A型韩氏穴位神经刺激仪均为北京华卫公司产品;37370足底热辐射测试仪购于意大利UGOBASILE公司;NC12775型Von-Frey丝触觉测量套件为美国Stoelting公司产品;Sorvall Biofuge Stratos全能台式高速冷冻离心机购于美国Thermo Scientific公司;SpectraMax M4型酶标仪为美国美谷分子有限公司产品;电泳-转印系统购于美国Bio-Rad公司。
1.3 痛觉敏化诱发(急慢性炎性痛转化)模型制备痛觉敏化诱发(急慢性炎性痛转化)模型制备参照Parada等[14]研究进行。各组大鼠均注射2次药物,敏化组大鼠以1%角叉菜胶100μL注射于左后足足底皮下,待痛阈恢复至基础水平后,将浓度为100ng·25μL-1的PGE225μL注射于左足足背中央。空白组大鼠两次均注射等量的0.9%氯化钠溶液;假敏化组大鼠第1次注射0.9%氯化钠溶液,第2次注射等量的PGE2,注射位置与敏化组相同。
1.4 干预方法 EA组和Sham EA组注射角叉菜胶后4h进行MPWT和TPWL检测,检测结束后分别对两组大鼠行EA及sham EA干预。将0.18mm×13mm针灸针刺入大鼠双侧“足三里”和“昆仑”穴,穴位定位参照《实验针灸学》[15]。同侧两穴位针柄分别连接LH-200A韩氏穴位神经刺激仪的输出端。治疗参数:疏密波2Hz/100Hz,电流强度从0.5mA开始,每10min增加 0.5mA,至 1.5mA,每次共干预 30min,1次/d,直至最后一次行为学检测前,共10次。sham EA组穴位选择和假电针干预时间点与电针组相同,进针时仅刺破皮层,不进入肌层,针柄连接LH-200A韩氏穴位神经刺激仪但不通电。敏化组和假敏化组不进行EA或sham EA干预。
1.5 检测指标及方法 分别检测大鼠左侧足跖注射前的基础痛阈,第 1 次注射后 4、24、48、72h 和 7d,以及第2次注射(第1次注射后8d)后1、4、24和48h的MPWT和TPWL。
1.5.1 MPWT检测 将大鼠置于测痛架上,适应环境15min后,观察并调整使大鼠左后足部可通过铁丝网眼,使用Up and Down法测定机械性痛阈[16]。选用力量分别为 0.4、0.6、1.0、2.0、4.0、6.0、8.0、15.0、26.0g 的Von-Frey刺激丝,双手持Von-Frey刺激丝,避开足垫,垂直刺向大鼠左后足底皮肤,至刺激丝出现两道弯曲,并保持5s。若大鼠出现左后足缩足反射,则记录为“X”,下一次刺激用低一档力量的刺激丝;若大鼠不产生缩足反射,则记录为“O”,下次刺激选择高一档力量的刺激丝。每只大鼠测痛从4.0g刺激丝开始,两次测试时间不少于3min。每只大鼠以第1次出现“XO”或“OX”为开始,再进行4次刺激,得到一串“O、X”6 位组合的序列,依据公式 MPWT(g)=(10[Xf+κδ])/10 000计算痛阈。其中κ值由序列组合查表获得,序列中最后一根刺激丝的对数值记为Xf值,选取的各个刺激丝力度取对数后差值的平均值记为δ,本次实验约为0.231。若用26.0g刺激大鼠仍无缩足反射,或0.4g刺激大鼠即发生缩足反射,则将其痛阈记录为26.0g或0.4g。
1.5.2 TPWL检测 将大鼠置于热痛架上适应环境30min后,将热辐射发射器对准左后足跖正中部,启动热辐射发射器,设置温度为40℃,最大刺激时间为20s,仪器自动记录大鼠缩足时间。连续测量5次,每次间隔5min,去掉最大值与最小值,计算平均值,测量时间点同MPWT。
1.5.3 TNF-α和p38 MAPK蛋白表达检测 行为学检测完毕后,大鼠以10%水合氯醛腹腔注射麻醉,剂量为3.5mL/kg,麻醉满意后迅速分离大鼠造模侧脊髓背角,放入-80℃冰箱中保存备用。以Western blot检测脊髓背角中TNF-α和p38 MAPK蛋白表达。取出冻存的脊髓背角标本,置于RIPA裂解液中超声粉碎,再将裂解液置于离心机中14 000r/min离心5min,取上清液,BCA蛋白定量。蛋白电泳后转至PVDF膜,封闭1h,加入兔抗大鼠的TNF-α、p38 MAPK和β-actin抗体(稀释浓度1:1 000)4℃孵育过夜,再加入辣根过氧化物酶标记的山羊抗兔二抗孵育2h(稀释浓度 1:10 000),ECL试剂盒显色,以 Image Quant LAS 4000凝胶图像分析系统拍片,Image Quant TL软件对目的蛋白条带和内参蛋白条带的灰度值进行分析,按相对灰度值=目的蛋白灰度值/内参蛋白灰度值,计算每组目的蛋白相对表达量。
1.6 统计学分析 应用SPSS 19.0统计软件进行统计学分析。计量资料以±s表示,组内注射前和注射后不同时间点的结果比较采用配对t检验。多组间比较采用单因素方差分析,组间两两比较,方差齐时采用LSD检验;方差不齐时采用Dunnett’s T3检验。以P≤0.05为差异有统计学意义。
2 结果
2.1 痛觉敏化诱发(急慢性痛转化)大鼠模型的建立
2.1.1 各组大鼠MPWT比较 第1次注射前,各组大鼠造模侧 MPWT 为:空白组(23.78±0.70)g、假敏化组(23.78±0.47)g和敏化组大鼠(23.23±0.30)g,组间总体比较差异无统计学意义(P>0.05)。与空白组和假敏化组比较,第1次注射后4h,敏化组大鼠MPWT显著降低(P<0.01),至注射后48h开始回升,至注射后7d,与假敏化组和空白组比较,差异无统计学意义(P>0.05),恢复至基础水平。第2次注射后1h,假敏化组和敏化组大鼠造模侧MPWT显著降低,两组间比较差异无统计学意义(P>0.05);此时,空白组大鼠MPWT未受影响,明显高于假敏化组和敏化组(均P<0.01)。第2次注射后4h,假敏化组大鼠造模侧足跖MPWT恢复至基础水平,与空白组比较差异无统计学意义(P>0.05),且明显高于敏化组(P<0.01),而敏化组MPWT仍维持低水平至48h,与空白组和假敏化组比较差异有统计学意义(均P<0.01)。见图1。此MPWT变化趋势与Parada等[14]结果一致,说明造模成功。
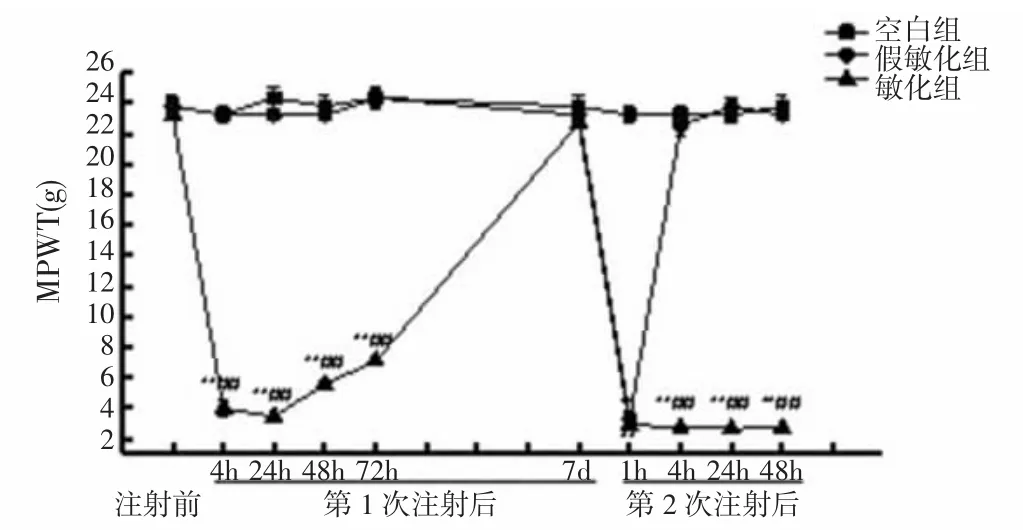
图1 各组大鼠MPWT比较Fig.1 Comparison of MPWTs of rats in each group
2.1.2 各组大鼠TPWL比较 第1次注射前,各组大鼠造模侧 TPWL 分别为:空白组(17.77±0.65)s、假敏化组(18.54±0.34)s和敏化组(18.58±0.37)s,组间比较差异无统计学意义(P>0.05)。第1次注射后,空白组和假敏化组大鼠造模侧TPWL维持基础水平,注射后4h,敏化组大鼠造模侧TPWL明显低于空白组和假敏化组(P<0.01,P<0.01),此后逐渐回升,至注射后7d回升至基础水平,与假敏化组和空白组比较,差异无统计学意义(P>0.05)。假敏化组和敏化组大鼠造模侧TPWL在第2次注射后1h显著降低,均明显低于空白组(P<0.01,P<0.01),但两组间差异无统计学意义(P>0.05)。而空白组大鼠第2次注射后TPWL仍维持基础水平。第2次注射后4h,假敏化组大鼠TPWL开始回升,而敏化组进一步显著降低,且低于假敏化组(P<0.01);第 2 次注射后 24、48h,假敏化组大鼠TPWL恢复且保持基础水平,而敏化组有回升趋势但仍维持低水平,明显低于假敏化组,差异有统计学意义(P<0.01)。见图2。以上结果提示,痛觉敏化诱发大鼠TPWL的变化规律与MPWT的变化规律不同。
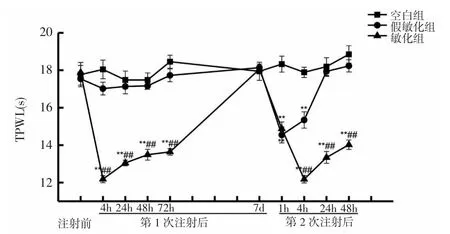
图2 各组大鼠TPWL比较Fig.2 Comparison of TPWLs of rats in each group
2.1.3 各组大鼠脊髓背角p38 MAPK和TNF-α表达比较 与空白组和假敏化组比较,第2次注射后48h,敏化组造模侧脊髓背角p38 MAPK表达增高(P<0.01,P<0.01);与空白组比较,假敏化组造模侧脊髓背角p38 MAPK表达差异无统计学意义(P>0.05)。见图3A。
与空白组和假敏化组比较,第2次注射后48h敏化组造模侧脊髓背角TNF-α表达增高(P<0.01,P<0.01);与空白组比较,假敏化组造模侧脊髓背角TNF-α表达差异无统计学意义(P>0.05)。见图3B。
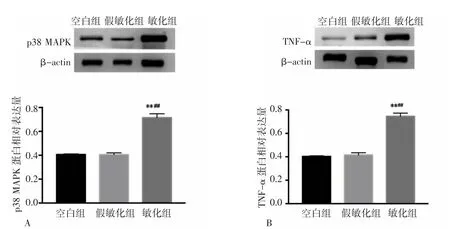
图3 各组大鼠脊髓背角内p38 MAPK和TNF-α蛋白表达比较Fig.3 Comparison of protein expression of p38 MAPK and TNF-α in ipsilateral spinal dorsal horn in each group
2.2 EA对HP大鼠痛阈及TNF-α和p38 MAPK蛋白表达的影响
2.2.1 各组大鼠MPWT比较 第1次注射前,各组大鼠造模侧 MPWT 为:假敏化组(23.23±0.37)g、敏化组(23.23±0.30)g、sham EA 组(23.78±0.33)g 和 EA组(23.34±0.74)g,组间比较差异无统计学意义(P>0.05),具有可比性。第1次注射后4h,敏化组和sham EA组大鼠造模侧MPWT明显低于假敏化组(P<0.01,P<0.01),而后逐渐回升,直至注射后 7d,均回升至基础水平,与假敏化组比较差异无统计学意义(P>0.05)。第2次注射后1h,各组大鼠造模侧MPWT均降低,4组间比较差异无统计学意义(P>0.05)。第2次注射后4h,假敏化组大鼠造模侧MPWT迅速恢复至基础水平,而敏化组和sham EA组MPWT则一直维持在低水平,明显低于假敏化组(P<0.01,P<0.01);EA 组 MPWT水平则低于假敏化组(P<0.01),高于敏化组和 sham EA 组(P<0.01,P<0.05)。第 2次注射后24、48h,EA组大鼠造模侧MPWT快速恢复至基础水平,且显著高于敏化组和sham EA组(P<0.01,P<0.01),至第2次注射后48h,与假敏化组比较差异无统计学意义(P>0.05)。见图4。
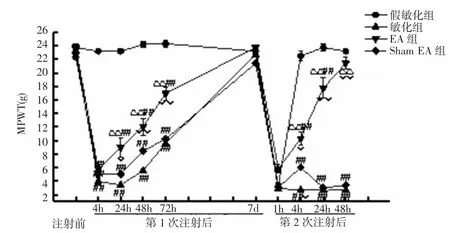
图4 各组大鼠MPWT比较Fig.4 Comparison of MPWTs of rats in each group
2.2.2 各组大鼠TPWL比较 第1次注射前,各组大鼠造模侧 TPWL 为:假敏化组(18.54±0.34)s、敏化组(18.58±0.37)s、sham EA 组(17.76±0.32)s和 EA 组(17.86±0.36)s,组间比较差异无统计学意义(P>0.05),具有可比性。第1次注射后4h,敏化组和sham EA组大鼠造模侧TPWL明显低于假敏化组(P<0.01,P<0.01),而后逐渐回升,至注射后7d,回升至基础水平,与假敏化组比较差异无统计学意义(P>0.05)。
第2次注射后4、24和48h,敏化组和sham EA组大鼠造模侧TPWL显著低于假敏化组(P<0.01,P<0.01)。与敏化组和sham EA组比较,第1次注射后24、48、72h,EA 组大鼠造模侧 TPWL 迅速恢复,显著高于同时点敏化组和 sham EA 组(P<0.01,P<0.01);第2次注射后1、4、24和48h,EA组大鼠也显著高于敏化组和 sham EA 组(P<0.01,P<0.01)。见图 5。
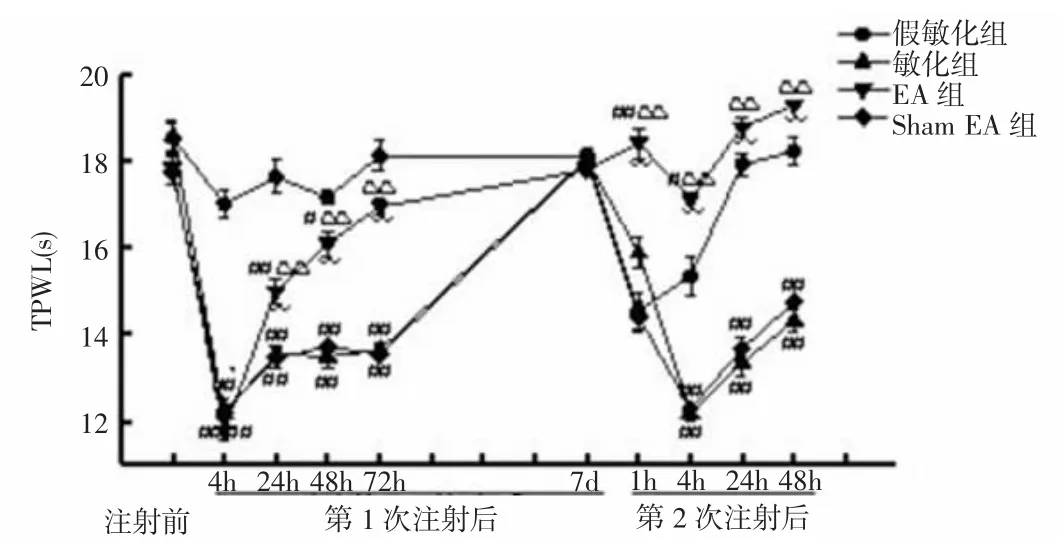
图5 各组大鼠TPWL比较Fig.5Comparison ofTPWLs of rats in each group
2.2.3 各组大鼠脊髓背角p38 MAPK和TNF-α表达比较 第2次注射后48h,敏化组造模侧脊髓背角p38 MAPK表达高于假敏化组(P<0.01)。EA组大鼠造模侧脊髓背角p38 MAPK表达低于敏化组(P<0.05)。Sham EA组大鼠造模侧脊髓背角p38 MAPK表达高于假敏化组和 EA 组(P<0.01,P<0.05),与敏化组比较差异无统计学意义(P>0.05)。见图6A。
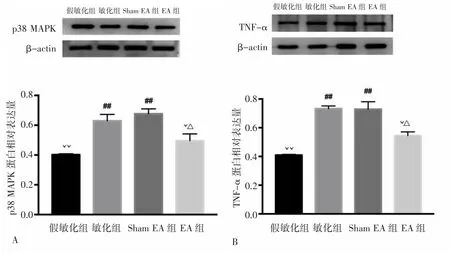
图6 各组大鼠脊髓背角内p38 MAPK和TNF-α蛋白表达比较Fig.6 Comparison of protein expression of p38 MAPK and TNF-α in ipsilateral spinal dorsal horn in each group
第2次注射后48h,敏化组造模侧脊髓背角TNF-α表达高于假敏化组(P<0.01)。EA组大鼠造模侧脊髓背角TNF-α表达低于敏化组(P<0.05),Sham EA组大鼠造模侧脊髓背角TNF-α表达高于假敏化组和 EA 组(P<0.01,P<0.05),与敏化组比较差异无统计学意义(P>0.05)。见图 6B。
3 讨论
疼痛学研究指出,疼痛不仅是一种与组织损伤相关的感觉,还是一种多维度的主观体验,包含了情绪、认知、感觉等内容[17]。由于疼痛在性质、强度、定位、持续时间和发生机制等方面有很大差异性,因此其分类方法也有很多种。在生理状态下,伤害性刺激直接刺激感受器导致的疼痛,被称为伤害性痛,也称为生理性痛,这种疼痛是瞬时的,几乎不引起组织损伤,或仅仅导致轻微损伤,即使有损伤(如手术切口等),疼痛也会随着损伤的恢复而自行消失,持续时间不长,因此也被称为急性痛。病理性痛在内脏组织和躯体均会产生,按照病因可分为“神经病理性痛”“炎性痛”和“功能性痛”[18]。由于这种疼痛和组织损伤分离,病灶修复后疼痛仍会存在,时间可长达数月甚至更久,所以又被称为慢性痛。因此,慢性痛不仅是一种症状,它本身也是一类疾病。当急性痛迁延不愈转化为慢性痛时,患者不仅生理上会感受痛苦,心理同样会受到巨大影响,导致生活质量下降,给患者带来难以忍受的折磨。流行病学研究发现,国内外成年人中均有30%左右正遭受慢性痛的折磨[19-20]。而目前临床治疗慢性痛以阿司匹林等非甾体类抗炎药物为主,虽然可以暂时缓解疼痛,但药物的不良反应会严重影响患者生活质量[21]。因此,探寻急慢性痛转化的机制,并寻找有效干预痛转化的手段,是现在迫切需要解决的问题。
研究表明,痛觉敏化诱发现象标志着急慢性痛转化[2],因此目前多采用二次注射的方式建立痛觉敏化诱发即急慢性痛转化模型[22]。本研究先以1%角叉菜胶给予大鼠炎性刺激,待大鼠痛阈恢复正常后,再给予100ng·25μL-1的PGE2诱发疼痛,该疼痛在持续时间上比单纯PGE2诱发的疼痛更长,且强度更加剧烈,组织损伤与疼痛分离,形成慢性疼痛。针对慢性炎性痛,MPWT是重要指标之一[23]。本次研究结果中的MPWT变化规律和前人研究的趋势基本一致,说明急慢性痛转化造模成功。TPWL同样是慢性炎性痛的重要观测指标[24],但热痛在神经纤维中的传导路径与机械性疼痛不完全相同,热痛主要由C纤维传导,机械性疼痛多由A纤维传导,因此热痛和机械性疼痛在慢性疼痛中的变化规律也不尽相同[25]。本研究结果也表明,痛觉敏化诱发模型不仅能诱发MPWT的改变,也能诱发TPWL的变化,但变化规律并不完全相同。
现代研究表明,“足三里”和“昆仑”穴是EA治疗慢性炎性痛的有效穴位组合[26-28]。因此,本课题组同样选用“足三里”和“昆仑”两穴,观察EA对急慢性痛转化的干预效应。EA在角叉菜胶注射后24h开始介入,每日干预一次,共10d,直到最后一次行为学检测前。PGE2作为一种能在局部组织产生和释放的致炎因子,能激活PGE2受体进而引起炎性痛。在本次实验中,通过预先给予炎性刺激(注射角叉菜胶),可使PGE2导致的疼痛增强和延长。行为学检测结果显示,EA干预可使注射PGE2后大鼠的TPWL和MPWT快速恢复。sham EA组大鼠TPWL和MPWT与敏化组变化趋势一致,说明sham EA对痛觉敏化诱发大鼠痛阈无明显干预作用,排除EA对大鼠造成的应激反应。这提示EA不仅具有缓解疼痛的作用,还可能抑制急性炎性痛向慢性炎性痛的转化。
既往研究表明,脊髓背角的小胶质细胞参与炎症或神经损伤的发生阶段,在痛觉敏化的早期发挥重要作用[29]。近来研究证实,脊髓背角小胶质细胞同样在急性痛向慢性痛转化的过程中起到重要作用[4]。脊髓背角MAPK信号通路是一条参与多种疼痛的重要通路[5-6],p38是其中的重要成员。大量研究证实,在急性疼痛模型上可观察到脊髓背角小胶质细胞内p38发生磷酸化[30-32],同时也证实激活脊髓背角小胶质细胞内的p38 MAPK信号通路可以诱发疼痛[30,33-34],而应用p38抑制剂能逆转疼痛[35],因此脊髓背角小胶质细胞内p38 MAPK信号通路介导了疼痛的发生。TNF-α是神经损伤和神经炎症过程中早期释放的重要炎性细胞因子[36],也是p38 MAPK的下游物质。在福尔马林致痛模型中可观察到脊髓背角内TNF-α高表达[37]。研究证明,脊髓背角小胶质细胞内p38 MAPK/TNF-α信号通路活化是神经病理痛发生的关键机制,也是疼痛加剧的重要原因[7]。事实证明脊髓背角内p38 MAPK/TNF-α是造成慢性疼痛的关键环节。以上研究说明,脊髓背角内p38 MAPK很有可能通过促进分泌TNF-α诱导中枢痛觉敏化,进而介导急性痛向慢性痛转化。本研究结果表明,EA组大鼠造模侧脊髓背角中p38 MAPK和TNF-α的表达明显低于敏化组,与假敏化组大鼠脊髓背角中的表达接近。以上结果提示,EA能有效降低脊髓背角内p38 MAPK/TNF-α的表达,进而阻止急性痛向慢性痛转化。
本研究首次从脊髓层面出发,研究EA干预痛转化的作用与其机制,通过观察EA对脊髓背角内p38 MAPK/TNF-α的调控效应,探索EA干预痛转化的脊髓中枢神经调节机制。因此,在急慢性痛转化过程中,模型大鼠TPWL和MPWT出现持续降低,而EA干预可以使大鼠TPWL和MPWT升高,抑制急性痛向慢性痛转化,该机制可能和EA下调脊髓背角内p38 MAPK/TNF-α的表达水平有关。

