水稻Histone3同源蛋白序列和基因表达特性分析
胡明瑜 白文钦 潘晓雪 吴红 雷开荣
摘 要 组蛋白Histone3是表观遗传调控的重要靶蛋白。同一物种中往往有多个Histone3同源基因,这些同源基因在生物学功能上是否有差异尚不清楚。本研究对水稻的8个Histone3同源蛋白作了比较,发现在N端序列差异相对较大。在“秀水03”和“日本晴”中,8个Histone3同源基因的表达特性相似,其中LOC_Os06g04030和LOC_Os03g27310在大部分组织器官中组成型表达,而其他Histone3同源基因的表达水平较低;部分同源基因在种子、花粉囊和雌蕊等组织器官中特异性高表达。进一步分析这些同源基因的上游调控序列,发现具有大量的生长调节剂和环境信号调控元件,以及组织特异性表达相关元件,并且不同基因中的调控元件有一定差别,如在LOC_Os04g34240和LOC_Os06g04030中含有生长素应答元件,而在LOC_Os05g41080和LOC_Os03g27310中含有赤霉素应答元件。这些结果表明,水稻Histone3同源基因不仅编码的氨基酸序列有差异,而且在表达调控上也有较大差别,暗示这些基因在生物学功能上可能有所差异。
关键词 水稻;组蛋白;OsHistone3;基因表达;表观遗传调控
中图分类号:S511.5;Q78 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2019.31.001
表观遗传调控在植物适应不同生物逆境的过程中发挥着重要作用[1]。近几年,越来越多的证据表明,植物抗病性与DNA/RNA甲基化、非编码RNA表达和组蛋白修饰等表观遗传调控密切相关。例如,在拟南芥中,利用siRNAs (small interference RNAs)介导RNA依赖性的DNA甲基化,对DNA特定位点进行修饰,可增强对病毒的防御能力[1]。在侵染拟南芥的溴病毒(bromovirus)中,腺嘌呤甲基化程度与拟南芥抵抗侵染的能力相关,表明RNA水平的甲基化也与抗病性相关[2]。
组蛋白修饰是表观遗传调控的重要方式,包括组蛋白乙酰化、甲基化和泛素化等。擬南芥突变体Atelp2和Atelp3-10对十字花科黑斑病菌(Pseudomonas syringae pv. maculicola)等病原菌高度敏感,研究发现,受到病原体侵染时,AtELP2和AtELP3蛋白促进防御应答基因表达,而这与AtELP2和AtELP3的组蛋白乙酰转移酶活性有关[3-4]。拟南芥ATX1蛋白具有组蛋白甲基转移酶活性,能够激活拮抗水杨酸和茉莉酸甲酯信号的WRKY70基因表达,并维持该基因核小体的Histone3组蛋白在K4位的三甲基态;同时,水杨酸信号应答基因PR1和茉莉酸甲酯信号应答基因THI2.1的核小体也是ATX1蛋白的作用靶点[5]。拟南芥组蛋白甲基转移酶SDG8(set domain group 8)通过调控茉莉酸甲酯和乙烯信号相关基因,来防御真菌病原侵染;其功能缺失突变体sdg8-1对芸薹生链格孢菌(Alternaria brassicicola)和灰葡萄孢菌石竹变种(Botrytis cinerea)等病原菌的防御能力降低[6]。进一步研究发现,SDG8和SDG25调控损伤相关内源性肽pep1、细菌鞭毛蛋白flg22和效应物诱发的植物免疫反应和系统性抵抗反应[7]。在玉米中,对赤藻茎腐病抗性与ZmCCT基因表达水平相关;在感病株系中发现ZmCCT基因上游调控序列中插入转座子元件,使组蛋白激活标签H3K4me3被删除,并引入大量甲基化的GC序列,导致ZmCCT基因在病原菌侵染时无法诱导表达[8]。黄单胞杆菌水稻致病变种(Xanthomonas oryzae pv. oryzae)侵染水稻时,诱导15个组蛋白赖氨酸去甲基化酶(Jumonji C)基因表达;在jmj704突变株中H3K4me2/3标记水平显著增加,表明JMJ704蛋白可能调控H3K4me2/3的去甲基化[9]。此外,用大丽轮枝菌(Verticillium dahliae)毒素处理拟南芥组蛋白H2B单泛素化相关突变体(hub1-4、hub2-2、ubc1-1、hub1-4/hub2-2、ubc1-1/ubc2-2等),发现组蛋白H2B单泛素化在防御反应中参与调控了微管的动力学特性[10]。这些证据表明在受到病原侵染时,植物的防御反应与组蛋白修饰紧密相关,开展组蛋白及其修饰酶的研究对于揭示植物抗病机理有重要意义。
已有研究表明,组蛋白Histone3具有多种修饰酶(如甲基化酶ATX1、SDG8、SDG25和去甲基化酶家族JMJCs等)及多个修饰位点(如H3K4、H3K9和H3K27等),而且Histone3的不同修饰参与调控植物生长发育和对病原菌的防御反应[11],这说明Histone3是植物进行表观遗传调控的重要靶蛋白和纽带,在植物生长发育调控和抵抗病原菌方面具有重要作用;不过,目前对Histone3基因自身的表达特性还研究较少。为了解Histone3基因是否可能在转录水平参与植物表观遗传调控,我们对水稻Histone3同源基因的编码蛋白进行了比较,并对基因表达特性进行分析,发现水稻中有8个Histone3同源基因,根据编码蛋白质的同源性可分为4组,同源蛋白间N端序列差异相对较大。表达分析显示,8个Histone3同源基因在“秀水03”和“日本晴”中表达特性相似,其中LOC_Os06g04030和LOC_Os03g27310在不同组织器官中组成型表达,而其他Histone3同源基因表达水平较低,LOC_Os12g22680、LOC_Os05g41080和LOC_Os02g25910分别在种子、花粉囊和雌蕊中相对高表达。对Histone3同源基因上游调控序列分析,发现存在多种生长调节剂的信号调控元件和环境响应元件,同时还有胚乳、茎尖、分生组织等部位特异表达元件。水稻Histone3同源基因之间的上游调控序列包含的顺式调控元件也存在差异,如生长素应答元件主要在LOC_Os04g34240和LOC_Os06g04030中,而赤霉素应答元件主要在LOC_Os05g41080和LOC_Os03g27310中,这表明水稻Histone3同源基因在生物学功能上可能有所差异。综合而言,编码Histone3蛋白同源性高的基因表达特性相似,部分水稻Histone3基因具有组织表达特异性。这为进一步探索Histone3同源蛋白在调控植物生长发育和防御反应中的不同作用提供了参考。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
“秀水03”(Oryza sativa L. “Xiushui 03”),是逆境农业研究重庆市重点实验室保存的特早熟晚粳稻品种;“日本晴”(Oryza sativa L. “Nipponbare”),是国际水稻基因组计划中的典型粳稻基因组供体,完成了全基因组测序,是常用的水稻研究材料。
1.1.2 试剂
Trizol法总RNA提取试剂盒,购自赛默飞世尔科技有限公司。
1.2 试验方法
1.2.1 水稻Histone3同源蛋白序列分析
利用Lasergene的MegAlign程序分析水稻Histone3同源蛋白序列。采用Clustal W方法进行计算,参数为软件默认。
1.2.2 “秀水03”转录组测序
“秀水03”种子萌发2周后,取15棵幼苗幼根,液氮研磨,用Trizol法提取总RNA备用;随机抽取15棵田间正常生长的“秀水03”植株,分别用解剖刀取第二、三片完全展开叶,取第二、三节茎,取开花前和开花后果穗,液氮研磨,用Trizol法提取总RNA备用;从根、茎、叶和穗提取的总RNA样品检测合格后,由上海美吉生物医药科技有限公司做转录组测序。
2 结果与分析
2.1 水稻Histone3同源蛋白序列比较
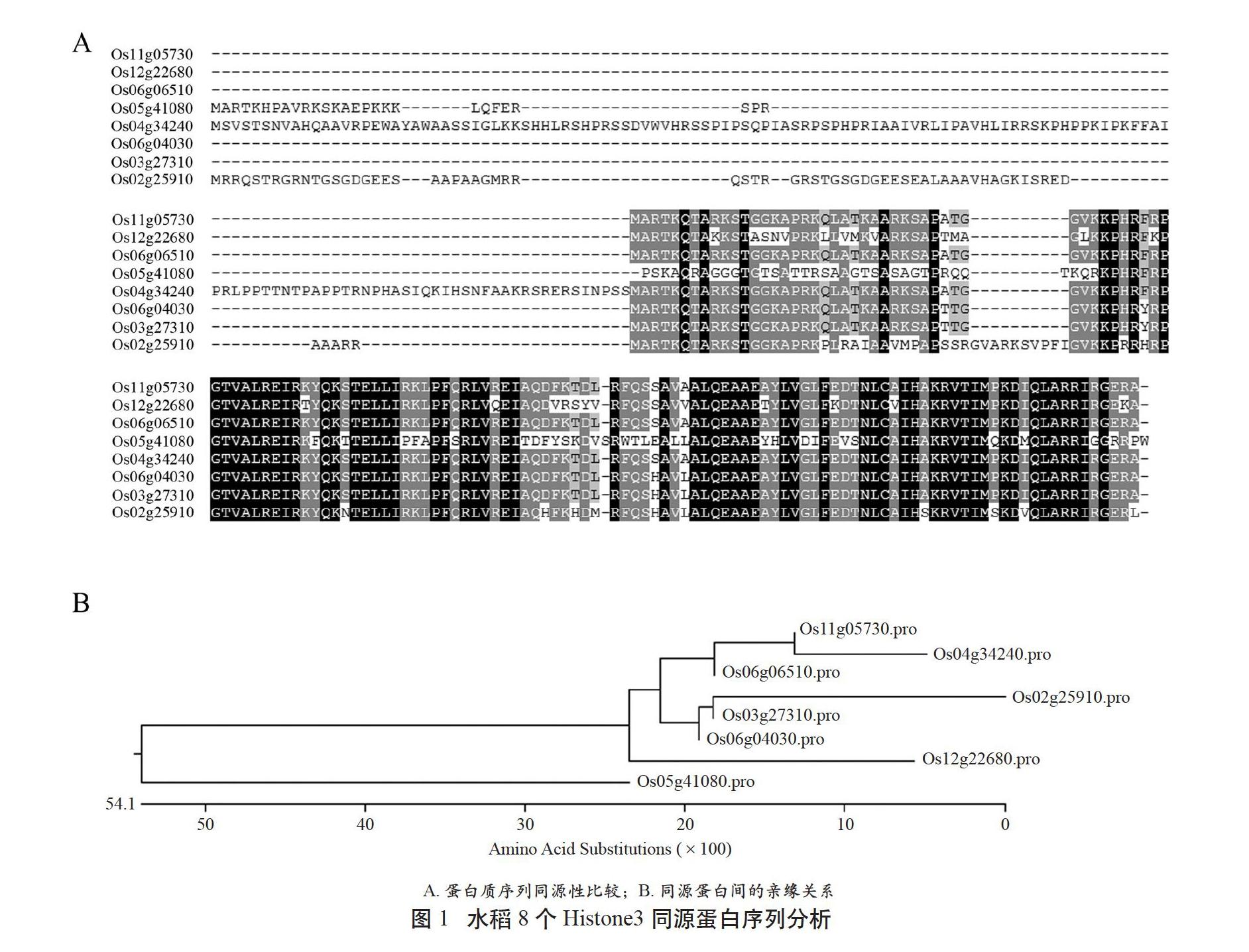
表观遗传学研究认为,Histone3蛋白的序列变异和修饰与基因表达调控关系密切。为了解水稻中Histone3同源蛋白序列差异,在国家水稻数据中心(http://www.ricedata.cn/index.htm)查找到8个水稻Histone3同源基因,基因编号分别为LOC_Os11g05730、LOC_Os12g22680、LOC_Os06g06510、LOC_Os05g41080、LOC_Os04g34240、LOC_Os06g04030、LOC_Os03g27310和LOC_Os02g25910,对應蛋白质分别标记为Os11g05730、Os12g22680、Os06g06510、Os05g41080、Os04g34240、Os06g04030、Os03g27310和Os02g25910。
用Clustal W软件对蛋白质序列同源性做了分析(见图1A)。结果显示,Os06g04030、Os03g27310和Os02g25910的蛋白质同源性较高,其中Os06g04030和Os03g27310蛋白质序列相同,Os02g25910与前两者的序列一致性达到85.3%。Os11g05730、Os06g06510和Os04g34240编码的蛋白质同源性较高,其中Os11g05730和Os06g06510蛋白质序列相同,Os04g34240蛋白在N端多出138个氨基酸残基,其余部分序列与Os11g05730和Os06g06510蛋白质序列相同。Os12g22680和Os05g41080编码的蛋白质与其他Histone3同源蛋白序列差异相对较大,序列一致性在57%~82%。根据水稻Histone3蛋白同源性分析结果构建进化树(图1B),可将8个水稻Histone3蛋白分成4组(组1:Os11g05730、Os06g06510和Os04g34240;组2:Os06g04030、Os03g27310和Os02g25910;组3:Os12g22680;组4:Os05g41080)。这说明水稻中Histone3同源蛋白在序列上存在一定差异,N端序列差异相对较大。
2.2 水稻“秀水03”中Histone3同源基因表达特性
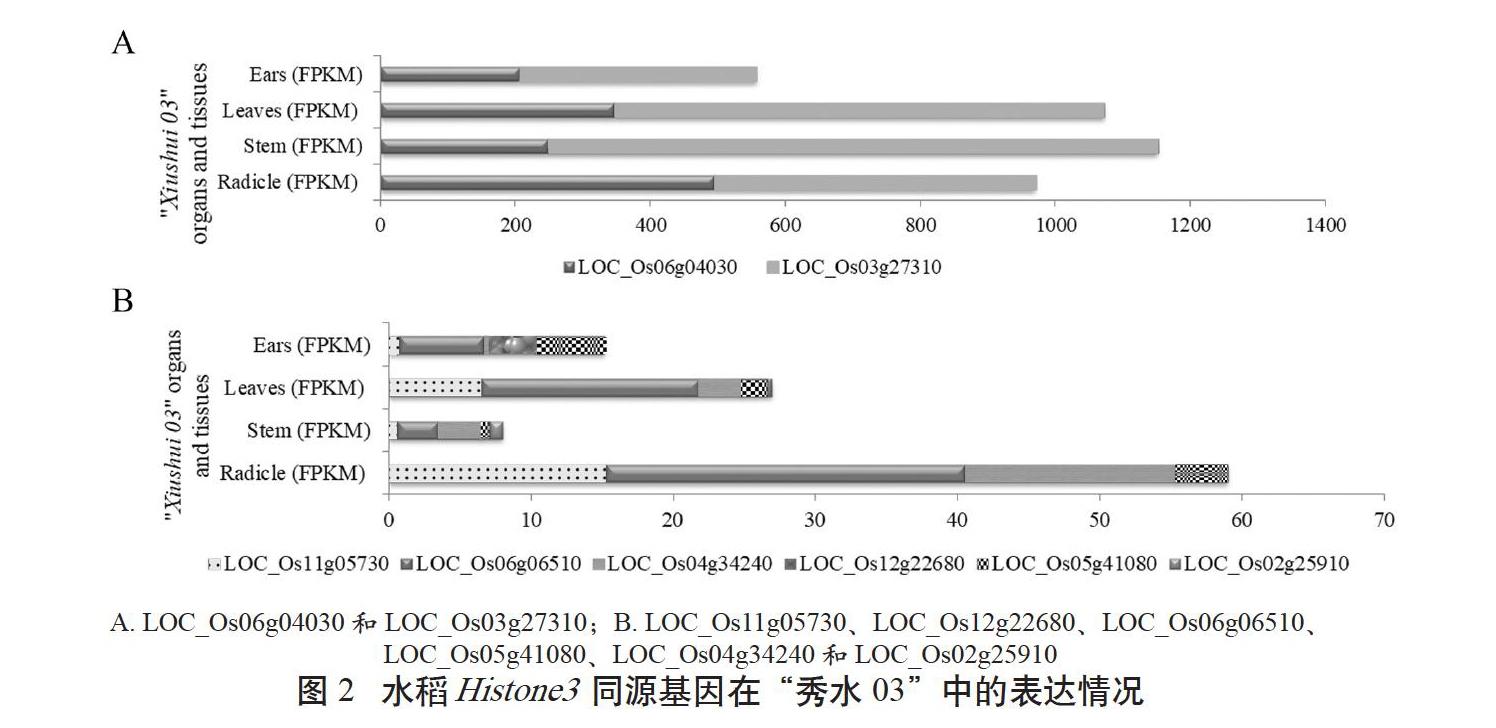
为了解水稻Histone3同源基因的表达特性,利用特早熟粳稻品种“秀水03”的根、茎、叶和穗的转录组数据,分析Histone3同源基因表达情况。结果表明,8个Histone3同源基因均检测到转录本(见图2)。其中组2的LOC_Os06g04030和LOC_Os03g27310在根、茎、叶和穗中组成型表达,FPKM(Fragments Per Kilobase per Million)值均在200以上;而LOC_Os02g25910在根、叶和穗中表达量极低,在茎中相对高表达。在组1中LOC_ Os11g05730、LOC_ Os06g06510和LOC_ Os04g34240表达特征相似,LOC_Os11g05730和LOC_Os06g06510在幼根和叶中表达相对较高,LOC_Os04g34240在幼根中表达相对较高。组3的LOC_Os12g22680在果穗中高表达,在其他部位表达量极低。组4的LOC_ Os05g41080在幼根和茎中相对高表达。这些数据初步表明“秀水03”中Histone3同源基因表达水平差异较大,部分Histone3同源基因存在组织表达特异性。
2.3 “日本晴”中Histone3同源基因表达特性
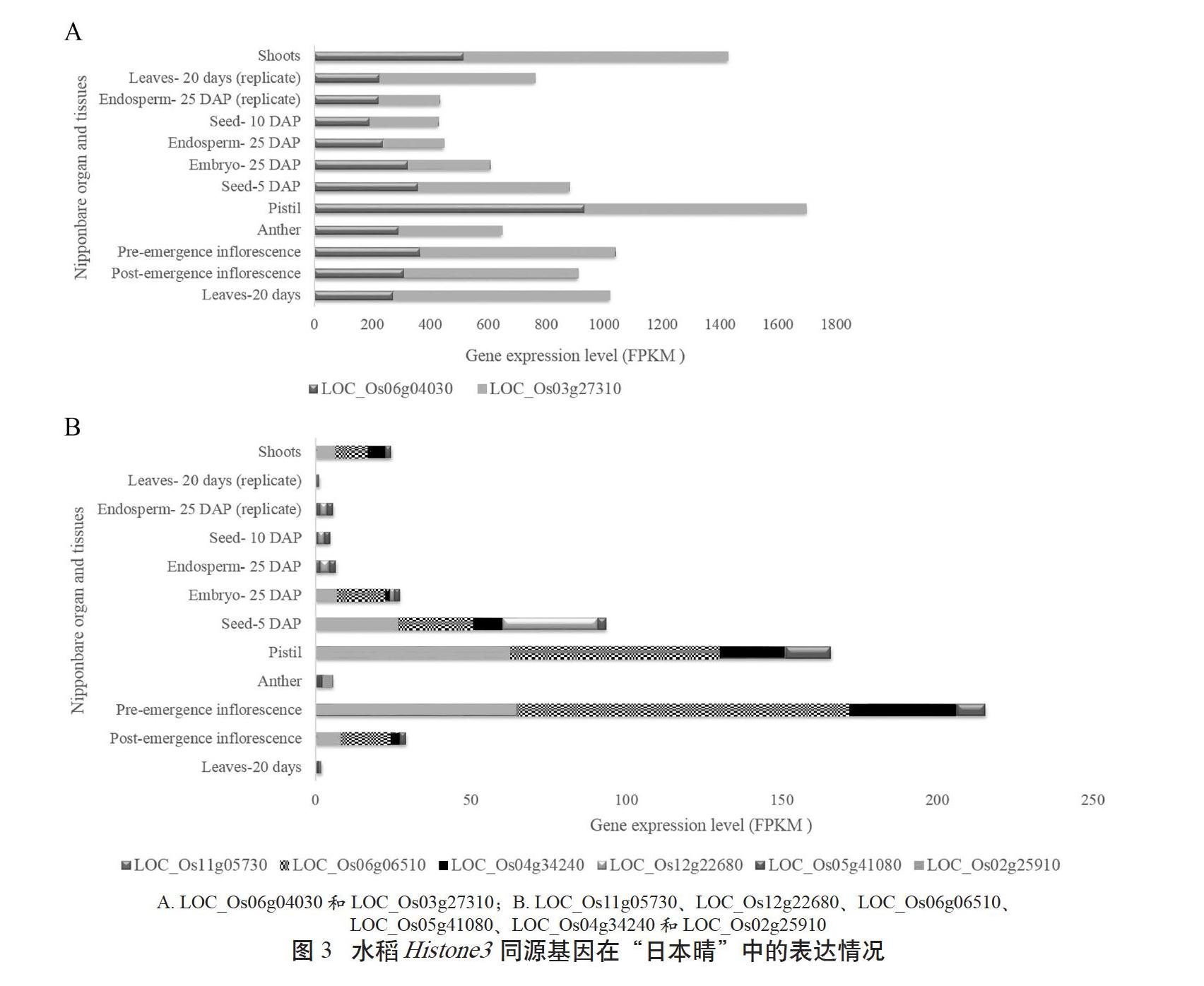
利用RGAP数据库[12](The MSU Rice Genome Annotation Project Database and Resource, http://rice.plantbiology.msu.edu/index.shtml)分析水稻Histone3同源基因的表达模式。结果表明,在“日本晴”中,组2的LOC_Os06g04030和LOC_Os03g27310在不同发育时期的芽、叶、胚、种子、果穗、花粉囊、雌蕊等部位组成型高表达(见图3A),其中LOC_Os06g04030在雌蕊中的FPKM值高达934;而LOC_Os02g25910在各组织器官表达量较低,在花粉囊中相对高表达(图3B);组1的LOC_Os11g05730、LOC_Os06g06510和LOC_Os04g34240表达特征相似,在不同发育时期的果穗、雌蕊、芽、种子(5DPA)和胚(25DPA)等部位高表达;组3的LOC_Os12g22680在种子(5DPA)中表达量相对较高;组4的LOC_Os05g41080在雌蕊和果穗中表达量相对较高(图3B)。这些数据进一步说明,水稻Histone3同源基因的表达水平差异较大,部分Histone3同源基因在雌蕊、花粉囊和种子(5DPA)等部位特异表达。
[4] Wang C, Ding Y, Yao J, et al. Arabidopsis Elongator subunit 2 positively contributes to resistance to the necrotrophic fungal pathogens Botrytis cinerea and Alternaria brassicicola[J]. Plant Journal, 2015, 83(6):1019-1033.
[5] Alvarez-Venegas R, Avramova Z. Methylation patterns of histone H3 Lys 4, Lys 9 and Lys 27 in transcriptionally active and inactive Arabidopsis genes and in atx1 mutants[J]. Nucleic Acids Research, 2005, 33(16): 5199-5207.
[6] Alexandre B, Emily J M, Abdelmalek A, et al. Arabidopsis histone methyltransferase SET DOMAIN GROUP8 mediates induction of the jasmonate/ethylene pathway genes in plant defense response to necrotrophic fungi[J]. Plant physiology, 2010, 154(3): 1403-1414.
[7] Sanghun L, Fuyou F, Siming X, et al. Global regulation of plant immunity by histone lysine methyl transferases[J]. Plant Cell, 2016, 28: 1640-1661.
[8] Wang C, Yang Q, Wang W, et al. A transposon-directed epigenetic change in ZmCCT underlies quantitative resistance to Gibberella stalk rot in maize[J]. New Phytologist, 2017, 215(4): 1503-1515.
[9] Hou Y X, Wang L Y, Wang L, et al. JMJ704 positively regulates rice defense response against Xanthomonas oryzae pv. oryzae infection via reducing H3K4me2/3 associated with negative disease resistance regulators[J]. BMC Plant Biology, 2015, 15:286.
[10] Hu M, Pei L B, Zhang L F, et al. Histone H2B monoubiquitination is involved in regulating the dynamics of microtubules during the defense response to Verticillium dahliae toxins in Arabidopsis[J]. Plant physiology, 2014, 164(4): 1857-1865
[11] Zhou C, Zhao Y, Zhou S L, et al. Progresses and perspectives of crop epigenome research (in Chinese)[J]. Chinese Bulletin of Life Sciences (生命科学) , 2016, 28(10): 1138-1145.
[12] Kawahara Y, de la Bastide M, Hamilton J P, et al. Improvement of the Oryza sativa Nipponbare reference genome using next generation sequence and optical map data[J]. Rice, 2013, 6:4.
[13] Magali L, Patrice D, Gert T, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327.
(責任编辑:丁志祥)

