朝鲜当归提取物对小鼠脑缺血-再灌注损伤神经的保护作用及其机制*
程永杰,赵子瑞,李晓妮,吉海杰
(1.山西药科职业学院药学系,太原 030031;2.山西医科大学药学院,太原 030001;3.山西省中医药研究院,太原 030012)
脑卒中是世界范围内威胁公众健康的疾病之一。缺血性脑卒中病灶由缺血核心区及周围缺血半影区组成;缺血核心区神经元损伤不可逆,而半影区损伤能够通过及时治疗得到挽救[1]。新生血管生成可使阻塞微血管再通,促进半影区损伤神经元恢复[2]。血管生成是由血管内皮生长因子(vascular endothelial growth factor,VEGF)和血管生成素1(angiopoietin-1,Ang-1)等调节[3]。研究表明,小鼠脑卒中后全身炎症加剧,可降低血-脑屏障紧密连接[4]。VEGF可促进血管生成,抑制缺血神经元损伤,还具有抗炎作用[5]。Ang-1是内皮细胞特异性酪氨酸激酶受体Tie-2配体[6]。Ang-1和VEGF联合具有协同作用,促进血管生成和新生血管成熟。朝鲜当归(AngelicagigasNakai)为伞形科植物朝鲜当归的根。朝鲜当归主要含紫花前胡素、紫花前胡醇当归酯、7-去甲基软木花椒素、异紫花前胡内酯和紫花前胡醇[7]。朝鲜当归具有一些生物活性,如神经保护、抗炎和抗氧化等[8-9]。然而,朝鲜当归对血-脑屏障通透性和血管生成影响笔者未见相关报道。因此,本研究旨在评价朝鲜当归提取物是否通过调节血-脑屏障通透性和血管生成在小鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)诱导缺血-再灌注(ischemia/reperfusion,I/R) 损伤中发挥神经保护作用。
1 材料与方法
1.1实验动物及分组 雄性清洁级C57BL/6小鼠,体质量25~30 g,自由饮食和饮水,室温(23±1) ℃。所有动物均由山西医科大学动物中心提供,动物生产许可证号:SCXK(晋) 2015 -0001。将小鼠通过随机数字表法分为6组,分别为假手术组、模型对照组和朝鲜当归(10,25,50,100 mg·kg-1)组,每组各9只。
1.2试剂 朝鲜当归(亳州市保华药业有限公司);2,3,5-氯化三苯基四氮唑(2,3,5-triphenylterazolium chloride,TTC)染料(美国Sigma公司,批号:00281342);Ang-1(美国Santa公司,批号:SC-319824);VEGF(美国Santa公司,批号:SC-7269);CAM-1(美国Santa公司,批号:SC-7974);ZO-1(美国Santa公司,批号:I0214);Occludin(美国Santa公司,批号:SC-8144)。
1.3方法
1.3.1朝鲜当归提取物的制备 将朝鲜当归根部用纯化水煮3 h,通过双层滤网过滤到Whatman滤纸(杭州雷琪实验仪器有限公司,型号:2105-862)上,在真空下浓缩。最终产生的浓缩提取物是29.1%干燥粉末,干燥粉末在4 ℃冰箱中保存,使用前溶解于0.9%氯化钠溶液中。
1.3.2I/R模型制备 小鼠I/R模型制备方法:1%戊巴比妥钠腹腔注射麻醉,然后颈部行正中纵切口,显微镜下暴露左侧颈总动脉、颈外动脉和颈内动脉,用丝线结扎颈总动脉近心端和颈外动脉远心端,将线栓从小孔插入颈总动脉,上升至颈内动脉,最后到达大脑中动脉,固定线栓,90 min后拔出线栓,最后缝合切开皮肤[10]。I/R手术成功率约为70%。假手术组和模型对照组大鼠手术步骤一样,只是不插线栓。小鼠MCAO手术90 min后分别灌服不同剂量(10,25,50和100 mg·kg-1)朝鲜当归提取物(0.9%氯化钠溶液溶解),再灌注24 h后麻醉处死,进行相关检测。
1.3.3脑梗死体积测定 再灌注24 h后,迅速将动物断头取脑,将脑组织置于冰箱-20 ℃冷冻10~15 min,自前脑额极起用锋利刀片切成冠状切片,每片厚约1.5 mm,将脑片置于0.5%TTC染色液中,于37 ℃下孵育30 min。脑片用扫描仪扫描,用image pro plus 软件对脑片梗死体积进行分析[11]。
1.3.4Western blotting分析 再灌注24 h后,通过试剂盒提取小鼠半影区总蛋白,取20 μg蛋白行十二烷基硫酸钠-聚丙烯酰胺电泳分析,电泳后转至聚偏二氟乙烯膜上。然后分别加入兔抗Ang-1、VEGF、ZO-1和Occludin多克隆抗体(1:1000)和鼠抗……-actin多克隆抗体(1:5000)孵育。再加入山羊抗兔和山羊抗鼠的二抗(1:5000),室温孵育。最后用化学发光系统检测,应用Quantity one软件对吸光度进行评估。

2 结果
2.1朝鲜当归提取物对I/R小鼠脑梗死体积影响 采用TTC染色观察I/R小鼠脑梗死体积变化。模型对照组相对脑梗死体积为(29.7±5.2)%。10,25,50和100 mg·kg-1朝鲜当归组小鼠相对脑梗死体积分别为(31.1±5.6)%,(24.0±3.9)%,(18.5±5.8)% 和(15.8±3.7)%(图1)。与模型对照组比较,50和100 mg·kg-1朝鲜当归提取物可以显著减小脑梗死体积(F=13.84,P<0.01)。
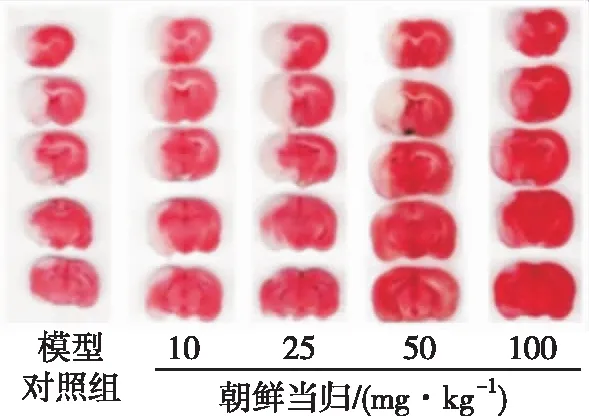
图1 5组小鼠脑梗死情况(典型TTC 染色图)
Fig.1Cerebralinfarctioninfivegroupsofmice(representativeimagesofTTCstaining)
2.2朝鲜当归提取物对I/R小鼠血管生成调节蛋白影响 如图2所示,与假手术组比较,模型对照组Ang-1表达显著降低(F=19.21,P<0.01)。与模型对照组比较,25,50 和 100 mg·kg-1朝鲜当归提取物处理后Ang-1(F=19.21,P<0.01)和VEGF(F=22.63,P<0.01)表达明显增加。此外,与模型对照组比较,100 mg·kg-1朝鲜当归处理后p-Akt(F=15.07,P<0.01)和PI3K(F=17.52,P<0.01)表达明显增高(图3)。如图4所示,与假手术组比较,模型对照组ZO-1(F=12.74,P<0.01)和Occludin(F=16.16,P<0.01)表达显著降低;朝鲜当归治疗后ZO-1表达明显增高,呈剂量依赖性(F=17.89,P<0.01)。
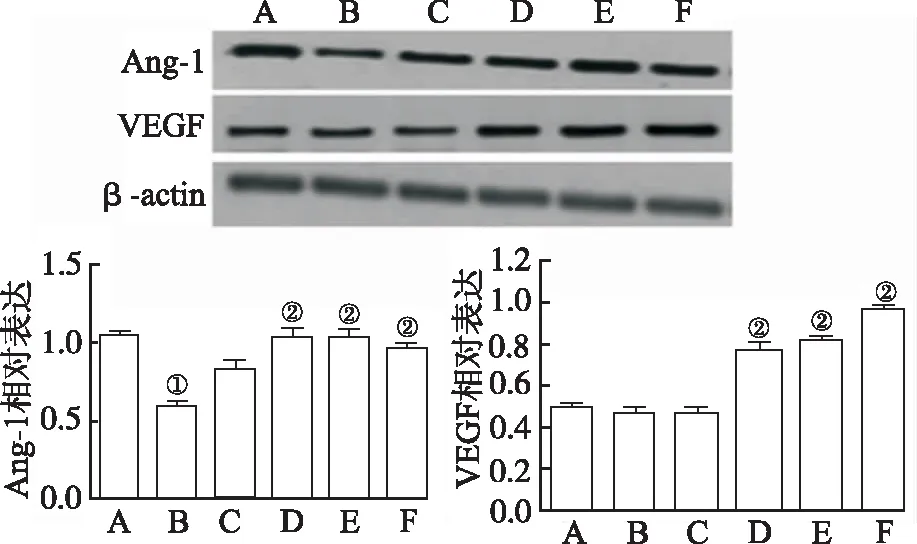
A.假手术组;B.模型对照组;C.朝鲜当归10 mg·kg-1组;D.朝鲜当归25 mg·kg-1组;E.朝鲜当归50 mg·kg-1组;F.朝鲜当归100 mg·kg-1组;①与假手术组比较,P<0.01;②与模型对照组比较,P<0.01。
图2 6组小鼠Ang-1和VEGF表达比较
A.sham operation group;B.model control group;C.Angelica gigas Nakai 10 mg·kg-1group;D.Angelica gigas Nakai 25 mg·kg-1group;E.Angelica gigas Nakai 50 mg·kg-1group;F.Angelica gigas Nakai 100 mg·kg-1group;①Compared with sham operation group,P<0.01;②Compared with model control group,P<0.01.
Fig.2 Comparison of the expression of Ang-1 and VEGF among six groups of mice
2.3朝鲜当归提取物对I/R小鼠血-脑屏障通透性影响 如图5所示,伊文思兰染色显示,与假手术组比较,模型对照组血-脑屏障通透性增大(F=48.62,P<0.01);25,50 和 100 mg·kg-1组血-脑屏障通透性显著降低(F=48.62,P<0.01)。
3 讨论
本研究显示,朝鲜当归对I/R小鼠神经具有保护作用。VEGF是血管生成的关键调节因子。在中枢神经系统,VEGF促进血管内皮细胞增殖和存活,使伤口愈合,并在脑损伤修复中促进星形胶质细胞增殖[12]。局灶性脑缺血中检测到Ang-1和 Ang-2表达,Ang-1具有保护血管通透性作用,还可以激活Tie-2受体,发挥抗炎作用[13]。PI3K/Akt通路激活Tie-2信号转导通路,使血管血管通透性保持稳定;血管生成调节因子VEGF和Ang-1不能直接调节内皮细胞生长,但是通过PI3K/Akt通路调节内皮细胞生长[14]。与VEGF不同,Ang-1主要在血管发育阶段发挥作用,例如血管重塑和成熟。本研究中,朝鲜当归提取物可增加I/R小鼠缺血半影区VEGF和 Ang1表达。刺激小鼠脑VEGF和Ang-1 表达可增加微血管密度,大剂量VEGF和Ang-1联合使用促进缺血状态下血管形成[15]。本研究表明,朝鲜当归促进缺血性脑损伤后血管生成,主要是通过增加VEGF和Ang1的表达。
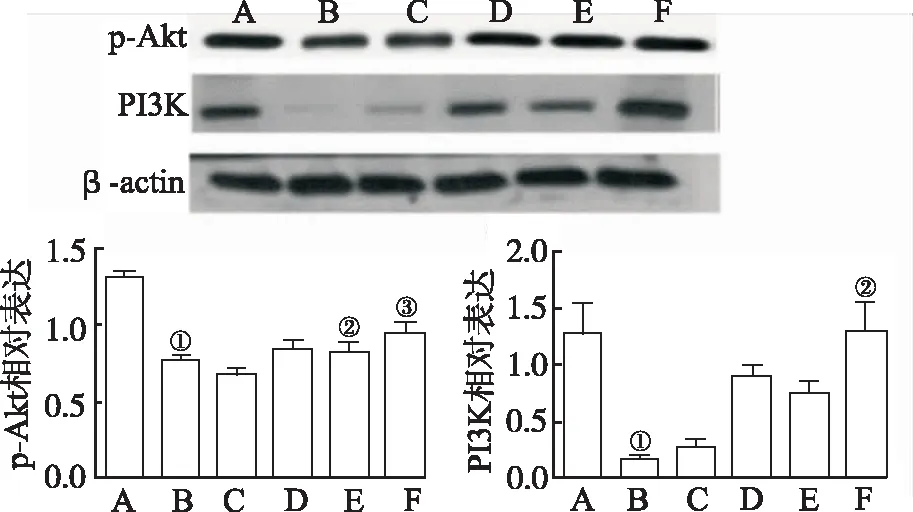
A.假手术组;B.模型对照组;C.朝鲜当归10 mg·kg-1组;D.朝鲜当归25 mg·kg-1组;E.朝鲜当归50 mg·kg-1组;F.朝鲜当归100 mg·kg-1组;①与假手术组比较,P<0.01;②与模型对照组比较,P<0.05;③与模型对照组比较,P<0.01。
图3 6组小鼠Akt和PI3K表达比较
A.sham operation group; B.model control group; C.Angelica gigas Nakai 10 mg·kg-1group; D.Angelica gigas Nakai 25 mg·kg-1group; E.Angelica gigas Nakai 50 mg·kg-1group; F.Angelica gigas Nakai 100 mg·kg-1group; ①Compared with sham operation group,P<0.01 ; ②Compared with model control group,P<0.05;③Compared with model control group,P<0.01.
Fig.3ComparisonoftheexpressionofAktandPI3Kamongsixgroupsofmice
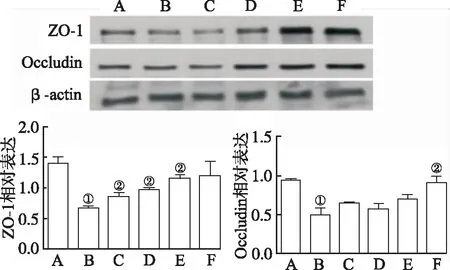
A.假手术组;B.模型对照组;C.朝鲜当归10 mg·kg-1组;D.朝鲜当归25 mg·kg-1组;E.朝鲜当归50 mg·kg-1组;F.朝鲜当归100 mg·kg-1组;①与假手术组比较,P<0.01;②与模型对照组比较,P<0.01。
图4 6组小鼠ZO-1和Occludin表达比较
A.sham operation group; B.model control group; C.Angelica gigas Nakai 10 mg·kg-1group; D.Angelica gigas Nakai 25 mg·kg-1group; E.Angelica gigas Nakai 50 mg·kg-1group; F.Angelica gigas Nakai 100 mg·kg-1group;①Compared with sham operation group,P<0.01 ; ②Compared with model control group,P<0.01.
Fig.4ComparisonoftheexpressionofZO-1andOccludinamongsixgroupsofmice
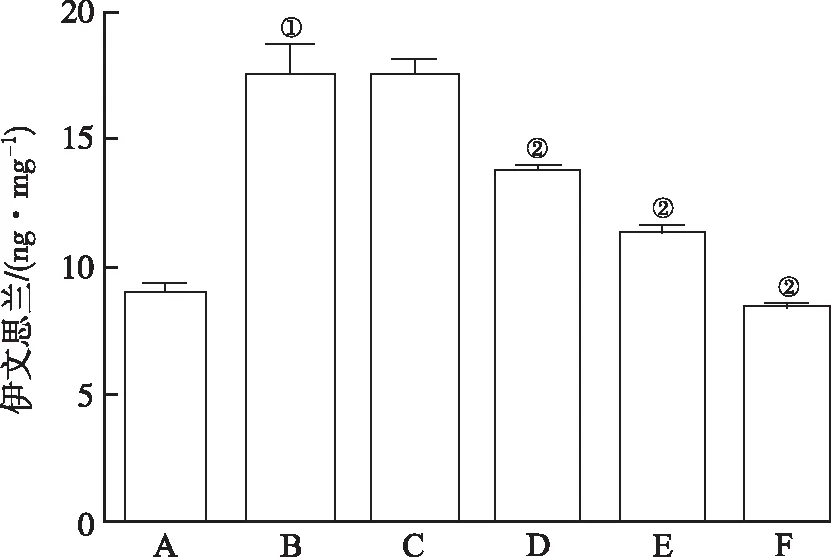
A.假手术组;B.模型对照组;C.朝鲜当归10 mg·kg-1组;D.朝鲜当归25 mg·kg-1组;E.朝鲜当归50 mg·kg-1组;F.朝鲜当归100 mg·kg-1组;①与假手术组比较,P<0.01;②与模型对照组比较,P<0.01。
图5 6组小鼠血-脑屏障通透性比较
A.sham operation group; B.model control group; C.Angelica gigas Nakai 10 mg·kg-1group; D.Angelica gigas Nakai 25 mg·kg-1group; E.Angelica gigas Nakai 50 mg·kg-1group; F.Angelica gigas Nakai 100 mg·kg-1group;①Compared with sham operation group,P<0.01 ; ②Compared with model control group,P<0.01.
Fig.5Comparisonofblood-brainbarrieramongsixgroupsofmice
血-脑屏障是一个高度复杂的结构。一些神经系统疾病,如卒中、癫、阿尔茨海默病和脑肿瘤与血-脑屏障功能障碍有关[16]。此外,血-脑屏障损伤有助于继发性炎症和神经元损伤,从而促使疾病发展。在本研究中,朝鲜当归提取物处理减少I/R小鼠血-脑屏障破坏。紧密连接蛋白是血-脑屏障内皮细胞之间一种有效的屏障。在生理和病理条件下,紧密连接蛋白表达、亚细胞定位、翻译后调节和蛋白质-蛋白质相互作用会发生变化[17]。朝鲜当归提取物促进缺血脑组织中ZO-1和Occludin蛋白表达,呈剂量依赖性关系。因而朝鲜当归提取物可以有效预防I/R小鼠血-脑屏障损伤引起的神经元损伤。此外,朝鲜当归主要含有紫花前胡素、紫花前胡醇当归酯、7-去甲基软木花椒素、异紫花前胡内酯和紫花前胡醇,均为香豆素类化合物,可抑制诱导型一氧化氮合酶、白细胞介素-1和环氧化酶-2等[18]。由于朝鲜当归具有抗炎作用,也可能在缓解I/R小鼠血-脑屏障损伤引起的神经元损伤中发挥作用。
总之,朝鲜当归可激活PI3K/Akt通路,增加血管生成诱导蛋白Ang-1、VEGF 和紧密连接蛋白ZO-1和 Occludin表达,因而具有减小I/R引起的脑梗死体积及血-脑屏障通透性等作用。

