肿瘤坏死因子超家族成员14调控炎症反应和脂质代谢的作用机制*
袁小媚,顾清,刘莉,王文艳
(四川省医学科学院·四川省人民医院心内科,成都 610047)
高脂血症以血液中脂质或脂蛋白水平异常升高为特征。高脂血症是引起动脉粥样硬化、冠心病和急性胰腺炎最常见的原因[1]。高脂血症分为原发性和继发性两种。原发性高脂血症通常是由于遗传基因或高脂饮食引起;继发性高脂血症通常由于其他代谢疾病引起,例如高血压和糖尿病。近年来,高脂血症和炎症之间的关系受到越来越多的关注。慢性感染性疾病,如红斑狼疮和类风湿关节炎已表现出高脂血症高发[2]。研究表明,免疫细胞参与脂质代谢调节[3],而高脂血症伴有免疫激活和炎症反应,因此动脉粥样硬化被认为是脂质代谢介导的慢性炎性疾病。在高脂血症的情况下,低密度脂蛋白( low density lipoprotein,LDL)被氧化为氧化低密度脂蛋白(oxidized low density lipoprotein,oxLDL),并且在动脉内膜内累积进而触发炎症。但炎症对脂质代谢的作用机制目前少有研究。
肿瘤坏死因子超家族(tumor necrosis factor superfamily,TNFSF)成员在免疫学过程中发挥重要作用,例如T细胞活化、共刺激和免疫细胞的动态平衡[4-6]。TNFSF成员14(LIGHT)是由Dr.Mauri 首次发现的II型膜蛋白。LIGHT以同型三聚体形式存在,可以通过HVEM(TNFSFR14)、淋巴毒素β受体(LTβR)和诱饵受体3(DcR3)调控免疫反应过程。LIGHT/HVEM相互作用有助于T细胞活化,LIGHT/ LTβR相互作用可能与调节基质/抗原呈递细胞(APC)/T细胞应答相关[7]。动物模型和一些临床研究显示LIGHT可能对各种炎症疾病的发生有重要作用[8-9],LIGHT也涉及血管炎症的发病[10]。此外,LIGHT可能通过促进炎症反应途径与肥胖和2型糖尿病关联[11-13]。但是,LIGHT参与动脉粥样硬化的研究很少。
基于LIGHT在血管炎症和代谢紊乱疾病中的作用,推测LIGHT可能参与了动脉粥样硬化的发病过程,导致高脂血症的最终形成。这个假设通过各种实验方法来证实,包括在冠心病患者中开展临床研究和在oxLDL诱导的人源单核巨噬细胞(THP-1)的实验研究。
1 资料与方法
1.1研究对象 32例冠心病患者根据临床诊断标准分2组,即不稳定型心绞痛组和稳定型心绞痛组,各16例。16例健康人作为正常对照组,收集研究对象的血液样本进行研究。所有的患者都由四川省人民医院心内科募集,并签署知情同意书,研究通过本院伦理委员会批准。
1.2酶联免疫吸附测定(ELISA) ELISA 方法根据说明书操作(Sigma,St.Louis,USA)。血浆样品预先滴定在ELISA板上作为抗原。O-联茴香胺(Sigma-D3252,St.Louis,USA)作为底物,吸附的染色辣根过氧化物酶(HRP)产物通过分光光度计(TU2450,Shimadzu,Japan)在405 nm处使用自动读板机测定(Thermo,Waltham,USA)。
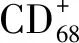
1.4细胞培养和处理 细胞分为5组:①阴性对照组;②LIGHT组;③oxLDL组;④LIGHT+oxLDL 组;⑤LIGHT+oxLDL+LTβR免疫球蛋白凝集素(LTβR-Ig) 组,即THP-1细胞在常规无血清RPMI 1640培养基(Gibco,Grand Island,NY)中在37 ℃、 5%二氧化碳(CO2)条件下培养。由佛波酯(PMA ,100 ng·mL-1,Sigma,St.Louis,USA) 刺激细胞分化为巨噬细胞(阴性对照组),然后单独oxLDL(20 mg·L-1;Sigma,St.Louis,USA)或者联合LIGHT(200 ng·mL-1;R&D Systems,Minneapolis,Minneapolis,USA)、LTβR免疫球蛋白凝集素(LTβR-Ig)一起孵育24 h。
1.5Western blotting检测 细胞全蛋白样本的提取按照标准操作进行。等量的蛋白质样本通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrop-horesis,SDS-PAGE)胶分离,然后转移到聚偏二氟乙烯(poly vinylidene fluoride,PVDF)膜上。PVDF膜在含5%脱脂牛奶的T-BST中室温孵育。在4 ℃条件下孵育一抗(Santa Cruz Biotechnology,CA,USA),然后室温孵育HRP标记的二抗,多次洗膜。最后,使用ChemiDoc XRS成像系统和Quantity One分析软件分别检测和分析蛋白(Bio-Rad,USA)。GAPDH作为内源性参照蛋白。
1.6油红O染色 oxLDL和(或)LIGHT处理的巨噬细胞使用4%甲醛溶液固定30 min,然后油红O染色15 min。最后,细胞的形态通过配置放大200倍数成像系统的光学显微镜观察(Olympus,Tokyo,Japan)。泡沫细胞即被油红O染色的细胞。

2 结果
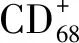
2.2LIGHT促进THP-1巨噬细胞脂质的产生和累积 见图2,oxLDL刺激细胞后,清道夫受体(SR-A)表达和乙酰辅酶A胆固醇酰基转移酶-1(Acyl-CoA cholesterol acyltransferase -1,ACAT1)显著升高(P<0.05),LIGHT作用进一步加强了其表达(P<0.01)。但是,当加入LTβR免疫球蛋白凝集素(LTβR-Ig,)后,LIGHT的增强效果被消除(P<0.01)。LIGHT进一步增强oxLDL诱导脂解基因(PPARα,CPT-1)表达降低,脂肪基因(SREBP-1c,ACS)表达升高以及脂质累积(P<0.05)。LIGHT的这些效果被LTβR-Ig阻止。这些结果表明,LIGHT可以促进THP-1细胞脂质的产生和累积。
2.3LIGHT上调THP-1巨噬细胞的炎症反应 见图3,LIGHT进一步促进oxLDL引起的促炎细胞因子(IL-6、 MCP-1、iNOS)的表达,并抑制抗炎细胞因子(IL-4、 IL-10)的表达。但是,LIGHT的作用被LTβR-Ig阻止(P<0.05)。这些结果表明THP-1巨噬细胞内活化LIGHT信号可加速oxLDL引起的炎症发生。
2.4LIGHT通过NF-κB信号通路调节炎症和脂质代谢 为了探索LIGHT调控作用的可能机制,将特异性细胞渗透性NF-κB核转移肽抑制剂SN50用于本实验。如图4所示,SN50显著抑制NF-κB、p65、IL-6和脂肪基因的表达,并且促进IL-4 和 PPARα在oxLDL或LIGHT刺激的细胞中的表达(P<0.05)。此外,SN50显著抑制LIGHT和oxLDL在炎症反应和脂质生成上的协同作用(P<0.05)。这些结果表明LIGHT通过NF-κB信号通路调节炎症和脂质代谢。
3 讨论
LIGHT参与固有免疫反应和适应性免疫反应,并与各种炎症和自身免疫疾病关联[8-9]。LIGHT在许多代谢疾病,例如2型糖尿病、类风湿关节炎和非酒精性脂肪性肝中高表达[13-14]。另外,巨噬细胞中LIGHT已经被证明可增加脂质的摄取[15],抑制脂肪分化[16],通过抑制肝脂蛋白脂肪酶引起高三酰甘油血症。在实验模型中,LIGHT已经和肥胖建立关联[11],促进代谢引起的炎症[12]。本研究发现LIGHT在冠心病患者中高表达[13]。这个结果从另一个角度验证了LIGHT和高脂血症的相关性。
THP-1细胞在脂质代谢相关研究中被广泛应用,因为THP-1分化巨噬细胞在诱导清道夫受体、积聚胆固醇酯和分泌脂蛋白脂肪酶等方面可以模拟人单核细胞衍生的巨噬细胞[17]。清道夫受体是整合膜蛋白,可以介导脂蛋白的内吞作用。ACAT-1在细胞内胆固醇动态平衡和动脉粥样硬化疾病中是一个关键的酶[18]。本研究结果显示,在oxLDL刺激的巨噬细胞中,LIGHT显著升高有助于脂肪生成的SR-A、 ACAT-1、 SREBP-1c 和ACS因子的表达。此外,LIGHT显著降低脂解基因PPARa 和 CPT-1的水平。这些发现证实在细胞和分子水平,LIGHT可以促进脂肪生成。
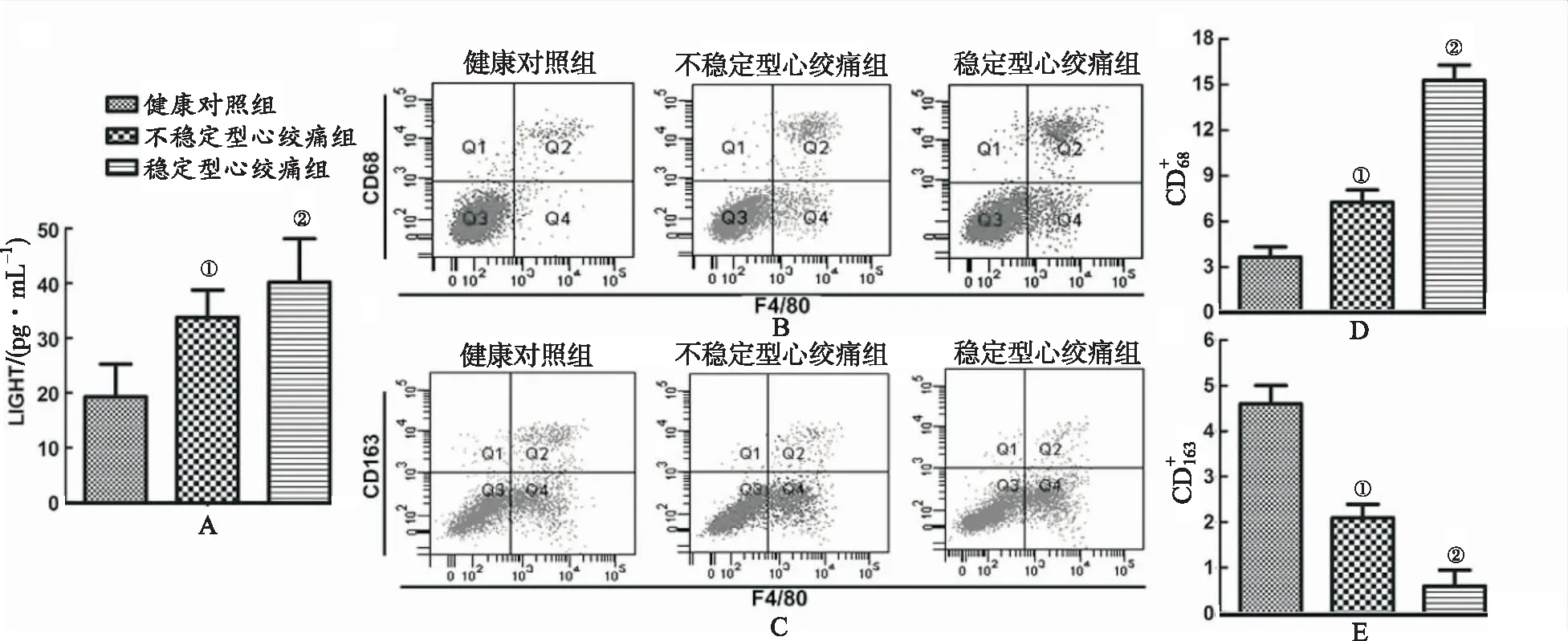
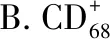
图1 3组LIGHT表达及炎症反应水平(n=3)
Fig.1LIGHTexpressionandinflammatoryresponseinthreegroups(n=3)
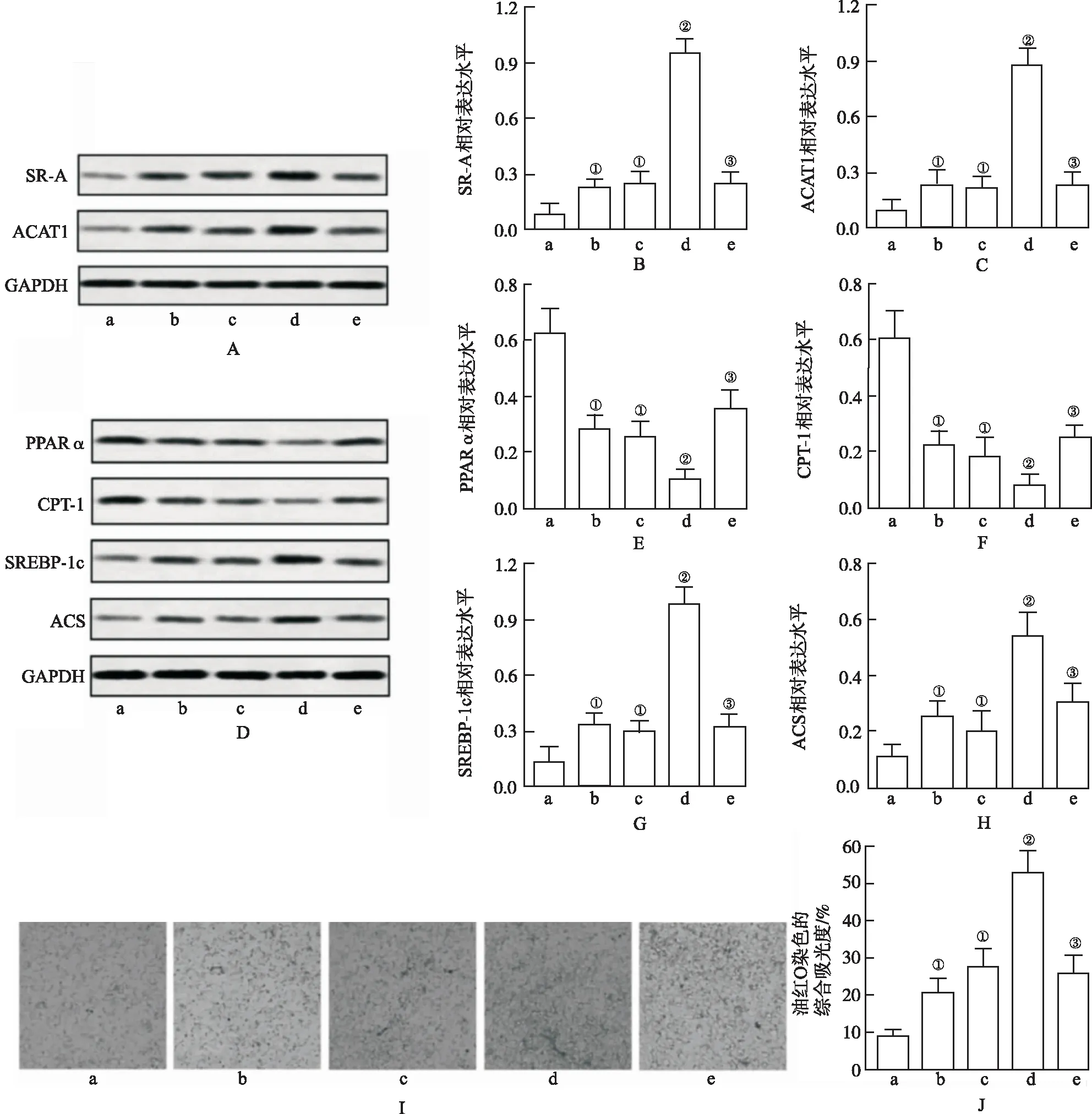
A.阴性对照组;b.LIGHT组;c.oxLDL组;d.LIGHT+oxLDL 组;e.LIGHT+oxLDL+LTβR-Ig组。 A.SR-A 和 ACAT1表达;B.SR-A定量;C.ACAT1定量;D.PPARa、 CPT-1、 SREBP-1c 和 ACS表达; E.PPARα定量;F.CPT-1定量;G.SREBP-1c 定量;H.ACS定量;I.细胞内胆固醇在油红O染色下的阳性表现(×200倍);J.油红O染色的综合吸光度值。 ①与阴性对照组比较,P<0.05;②与oxLDL比较,P<0.05;③与oxLDL+LIGHT组比较,P<0.05。
A.negative control group;b.LIGHT group;c.ox -LDL group;d.LIGHT+oxLDL group;e.LIGHT+ oxLDL +LT beta R -Ig group.A. Expression of SR-A and ACAT1 ;B.SR-A level;C.ACAT1 level;D.Expression of PPARa, CPT-1, SREBP-1c and ACS;E.PPARa level;F.CPT -1 level;G.SREBP-1c level;H.ACS level;I.positive expression of intracellular cholesterol by using red oil O staining(×200);J.Comprehensive optical density of red oil O staining.①Compared with negative control group,P<0.05;②Compared with oxLDL group,P<0.05;③Compared with oxLDL +LIGHT group,P<0.05.
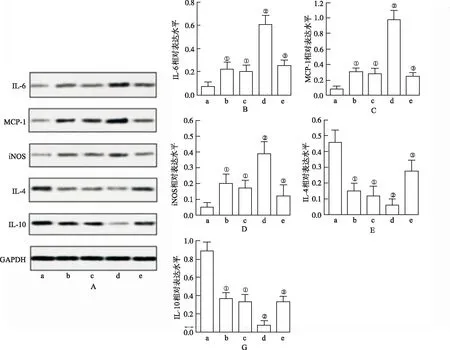
A.阴性对照组;b.LIGHT组;c.oxLDL组;d.LIGHT+oxLDL 组;e.LIGHT+oxLDL+LTβR-Ig组。 A.IL-6、 MCP-1、 iNOS、 IL-4 和IL-10表达;B.IL-6定量;C.MCP-1定量;D.iNOS定量; E.IL-4定量;F.IL-10定量。 ①与阴性对照组比较,P<0.05;②与oxLDL比较,P<0.05;③与oxLDL+LIGHT组比较,P<0.05。
A.negative control group;b.LIGHT group;c.ox-LDL group;d.LIGHT+oxLDL group;e.LIGHT+ oxLDL +LT beta R -Ig group.A.Expression of IL-6, MCP-1, iNOS, IL-4 and IL-10;B.IL-6 level;C.MCP-1 level;D.iNOS level;E.IL-4 level;F.IL-10 level.①Compared with negative control group,P<0.05;②Compared with oxLDL group,P<0.05;③Compared with oxLDL +LIGHT group,P<0.05.
免疫系统和炎症过程在动脉粥样硬化疾病形成和进展中发挥关键作用。在动脉粥样硬化形成过程中,单核细胞聚集到炎症部位,分化为巨噬细胞并引发免疫反应[19]。巨噬细胞可以分化为M1或M2表型,促动脉粥样硬化的M1巨噬细胞以表面标志CD68和高表达的促炎细胞因子,如IL-6和iNOS为特征;抗动脉粥样硬化的M2巨噬细胞主要参与炎症分解和诱导IL-4和IL-10[20-22]。研究发现冠心病患者伴有严重的炎症,因为冠心病患者高表达CD68和低表达CD163。此外,oxLDL刺激THP-1巨噬细胞在LIGHT作用下分化为M1表型。这些结果表明LIGHT诱导炎症可能有助于高脂血症进展。
LIGHT有3种受体,即HVEM、LTβR和DcR3。在免疫系统中,LIGHT活化T细胞应答通过HVEM通路[12-13]。LTβR对淋巴器官和细胞定位有重要影响。LTβR-Ig与LIGHT同型三聚体结合因而阻止LTβR和HVEM两条信号通路,并阻止LIGHT结合到DcR3。本研究中,LTβR-Ig用来阻断LIGHT信号转导,结果显示LTβR-Ig完全抑制LIGHT诱导的炎症和脂肪生成。这个结果进一步证明了LIGHT是一个致动脉粥样硬化因子。
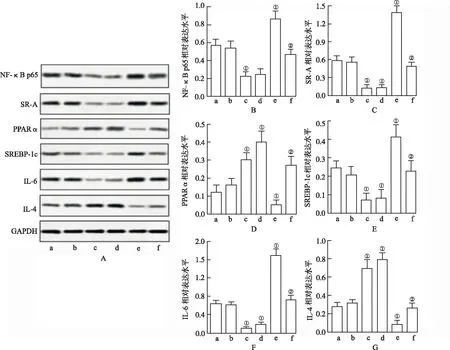
A.阴性对照组;b.LIGHT组;c.oxLDL组;d.LIGHT+SN50 组;e.LIGHT+oxLDL组;f.LIGHT+oxLDL+SN50 组。 A.NF-κB p65、SR-A、PPARα、SREBP-1c、 IL-6 和 IL-4表达;B.NF-κB p65定量;C.SR-A定量;D.PPARα定量; E.SREBP-1c定量;F.IL-6定量;G.IL-4定量。①与oxLDL比较,P<0.05;②与oxLDL+LIGHT组比较,P<0.05。
A.oxLDL group;b.LIGHT group;c.Ox -LDL group;d.LIGHT+SN50 group;e.LIGHT+ oxLDL group;f.LIGHT+ oxLDL +SN50 group.A.Expression of NF-kB p65, SR-A, PPARα, SREBP-1c, IL-6 and IL-4;B.NF-kB p65 level;C.SR-A level;D.PPARα level;E.SREBP-1c level;F.IL-6 level;G.IL-4 level.①Compared with oxLDL group,P<0.05;②Compared with oxLDL +LIGHT group,P<0.05.
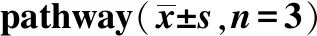
NF-κB在动脉粥样硬化不同阶段均可被激活[23-24]。oxLDL结合到其受体LOX-1激活NF-κB,增强泡沫细胞的形成和炎症细胞因子的释放[24-25]。敲除NF-κB导致动脉粥样硬化病变降低,并且在病灶处几乎没有泡沫细胞。SN50是一个协同蛋白,包含Kaposi成纤维细胞生长因子的信号序列和NF-κB的核定位序列。SN50具有特异性阻断活化的NF-κB核移位的能力。研究发现,SN50介导抑制NF-κB有效逆转LIGHT诱导的炎症和脂肪生成,表明LIGHT通过激活NF-κB表现出促动脉粥样硬化作用。
总之,本研究发现了动脉粥样硬化患者炎症和LIGHT高表达,LIGHT NF-κB依赖性加重炎症反应和促进脂质产生和聚集,这个过程可能是造成高脂血症进展的原因。但是,当前的研究具有一些局限性,LIGHT和高脂血症的这种关系仅仅体现在动脉粥样硬化疾病,特别是冠心病。LIGHT对其他高脂血症相关疾病的影响需要进一步探索。LIGHT可能有助于高脂血症的进展,本研究对高脂血症相关疾病的治疗提供了一个新的潜在靶标。

