巨菌草对鄂尔多斯砒砂岩土壤酶活性和可培养真菌的影响
黄在兴, 梅 兰, 宋昭昭, 贾雨雷, 王泽辉, 王安南, 刘怡萌, 苏德伟, 林占熺
(1.福建农林大学生命科学学院;2.国家菌草工程技术研究中心,福建 福州 350002)
砒砂岩地区是黄河流域能源基地的核心区,但由于其土层薄、营养匮乏,植被生长困难[1],也成为生态环境最脆弱、水土流失最严重的区域[2].目前,沙棘因其柔性而被视作砒砂岩生态治理的植物“柔性坝”,对提高土壤养分和含水量,以及治理水土流失具有一定作用[3-4];但沙棘生长速度慢,并且植物“柔性坝”只能在砒砂岩侵蚀的沟底部种植,对于坡面和沟坡的水土流失不能达到理想的治理效果[5].因此,为解决砒砂岩地区的生态治理难题,急需找到一种生长速度快、生态效益和经济效益明显、能适应恶劣环境的植物作为砒砂岩生态恢复的先锋植物.
巨菌草(PennisetumgiganteumZ.X.Lin)为被子植物门单子叶植物纲禾本科狼尾草属,其具有生长适应能力强、根系发达、生长速度快、产量高等特点,被广泛用于食药用菌生产,能够作为饲料,又可用于制备沼气及治理生态等,有很好的生态效益、经济效益和社会效益[6-8].目前,巨菌草已成为多种生态脆弱区生态综合治理的先锋植物,对土壤改良效果明显[7,9-10].土壤酶参与各种生化过程,可以用来评价土壤质量[11].但有关植物对砒砂岩地区土壤酶的影响鲜有报道,巨菌草对砒砂岩地区土壤酶的影响尚不明确.为此,本研究拟测定巨菌草对砒砂岩地区5种土壤酶,即脲酶(urease, URE)、过氧化氢酶(catalase, CAT)、蔗糖酶(solid-sucrase, S-SC)、碱性磷酸酶(alkaline phosphatase, ALP)、多酚氧化酶(polyphenol oxidase, PPO)的活性和土壤可培养真菌的数量、多样性的影响,以期为应用巨菌草治理砒砂岩生态环境提供依据.
1 材料与方法
1.1 试验区概况
试验区位于黄土高原丘陵沟壑区皇甫川流域——内蒙古自治区鄂尔多斯市准格尔旗暖水乡圪秋沟村,地理坐标为北纬39°46′—39°77′、东经110°40′—110°68′.此处为典型的砒砂岩区,覆沙、覆土、裸露3种类型并存,植被稀疏,基岩裸露,水土流失严重,生态和农牧业生产环境恶劣.从20世纪80年代至今,该区域为国家重点治理和科学界关注的热点区域,代表性强.本研究在该区域选取农田、河滩和山顶为样地,于2017年4月初分别在3块样地种植健康且长势相同的巨菌草,人工灌溉措施均相同.
1.2 土样采集与预处理
分5个时期采集土样,以45 d为一个时期,即4月初为种植前,5月中旬为苗期,以此类推分为种植前、苗期、分蘖期、拔节期和成熟期共5个时期.参照林先贵[12]的方法分别在每个时期灌溉前采集土样:按照“随机”、“等量”、“多点混合”的原则,在各试验区沿“S”形随机选取10个点,清除地表1 cm左右的表层土壤,在0~20 cm深度处采集等量土壤,清除杂物,用四分法对角取2份土壤混合放进取样袋,注明采样地点、时间.将部分土样置于阴凉通风处风干,然后过筛用于土壤酶活性分析;另一部分置于4 ℃冰箱中用于土壤可培养真菌数量的测定;少量土样置于-80 ℃超低温冰箱中,用于分子生物学试验.
1.3 土壤酶活性和可培养真菌数量测定
土壤酶活性测定参照关松荫[13]的方法.土壤可培养真菌数量的测定参照林先贵[12]的方法.
1.4 土壤可培养真菌ITS鉴定
采用稀释涂布平板法分离土壤可培养真菌,挑取具有形态差异的单菌落接到PDA培养基上纯化培养.培养3 d后,截取菌块接种到装有PDA液体培养基的三角瓶中,150 r·min-1、28 ℃培养3 d,收集菌丝,液氮冷冻后研磨成粉末,-80 ℃冰箱保存备用.
采用福州麦力公司快速无毒通用DNA提取试剂盒提取真菌DNA,用1%琼脂糖凝胶进行电泳(110 V,30 min),在紫外光下检测,用超微量分光光度计测定DNA的浓度.
用ITS1和ITS4引物(由上海生工生物工程股份有限公司合成)对供试菌株进行扩增.扩增体系:PCR Mix 12.5 μL, ddH2O 9.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,总体积25 μL.PCR扩增程序:预变性95 ℃ 5 min,变性95 ℃ 40 s,退火56 ℃ 1 min,延伸72 ℃ 1 min,33个循环,最后延伸72 ℃ 10 min.扩增产物用1%琼脂糖凝胶在1×TAE电泳缓冲液中电泳,上样5 μL,凝胶成像仪观察.经PCR筛选后,用具有目的条带的PCR产物和引物直接测序.测序由上海生工生物工程股份有限公司完成.运用GenBank中的Blast工具将测得的供试菌株rDNA序列在DNA系列数据库中进行比较分析.
1.5 数据处理
采用DPS软件进行单因素方差分析,采用SPSS 18.0软件进行相关性分析,采用GraphPad Prism软件制图.
2 结果与分析
2.1 巨菌草对土壤URE活性的影响
由图1A可以看出,3块样地巨菌草各生长期的URE活性均高于种植前的URE活性,且差异显著(P<0.05);在同一时期,山顶土壤URE活性最高,农田次之,河滩土壤的URE活性最低.这表明巨菌草能够明显提高土壤URE活性,但对不同样地的影响不同.
2.2 巨菌草对土壤PPO活性的影响
由图1B可知,巨菌草能够显著(P<0.05)降低土壤PPO活性,农田、山顶和河滩土壤PPO活性最大降幅分别达67.11%、66.11%和73.49%;但在巨菌草不同生长时期,土壤PPO活性变化不显著(P>0.05).
2.3 巨菌草对土壤S-SC活性的影响
由图1C可知,山顶土壤的S-SC活性随着巨菌草的生长逐渐降低,成熟期酶活性最低,比种植前降低了73.66%;农田土壤的S-SC活性在巨菌草生长期内呈先增加再降低的趋势,拔节期时达到最大值,达7.760 mg·g-1,比种植前增加了16.80倍;河滩土壤的S-SC活性在巨菌草不同生长期差异不显著(P>0.05).
2.4 巨菌草对土壤ALP活性的影响
由图1D可知,山顶土壤的ALP活性在5个时期均明显(P<0.05)高于其他2块样地.山顶土壤的ALP活性在苗期时最大,达41.554 μg·g-1,农田和河滩土壤的ALP活性均在巨菌草成熟期时达到最大值,分别为15.134和3.848 μg·g-1.
2.5 巨菌草对土壤CAT活性的影响
由图1E可知,3块样地土壤CAT活性的变化趋势一致(降低—增加—降低),且均在巨菌草拔节期达到峰值;但山顶土壤的CAT活性在不同时期均明显(P<0.05)高于其他2块样地,最大值达4.13 mL·g-1.
2.6 巨菌草对土壤可培养真菌数量的影响
从图1F可知,不同样地的土壤真菌数量在巨菌草生长时期内变化不同.山顶和河滩土壤真菌数量均在种植前最高,且随着巨菌草的生长变化趋势基本一致;农田的土壤真菌数量在巨菌草分蘖期达到峰值,达5.52×104CFU·g-1,比种植前高出1.58倍.
2.7 土壤可培养真菌多样性分析
rDNA的ITS区段PCR扩增产物的电泳检测结果如图2所示,扩增产物的条带单一,大小在500~750 bp之间,表明获得的目的DNA片段产量高、纯度好,可用于测序.
将测序得到的rDNA ITS区段的DNA序列在GenBank序列数据库中进行比对,结果表明,在巨菌草分蘖期,河滩土壤中分离的优势真菌菌株分别属于漆斑菌属(Myrothecium)、被孢霉属(Mortierella)、曲霉属(Aspergillus)、青霉属(Penicillium)、支顶孢属(Acremonium)、顶囊壳(Gaeumannomyces)、栓菌属(Trametes)、小球壳属(Mycosphaerella)、拟层孔菌属(Fomitopsis).其中,属于被孢霉属的菌株数最多,属于青霉属和漆斑菌属的菌株次之(表1).
在巨菌草分蘖期,农田土壤中分离得到的优势真菌菌株分别属于拟青霉属(Paecilomyces)、镰刀霉属(Fusarium)、小球腔菌属(Leptosphaeria)、被孢霉属、青霉属、栓菌属、链格孢属(Alternaria).其中,属于被孢霉属的菌株数最多,属于镰刀霉属和青霉属的菌株次之(表2).

表1 河滩土壤分离的优势真菌菌株Blast比对结果Table 1 Blast comparison of fungal strains isolated from flood land soil
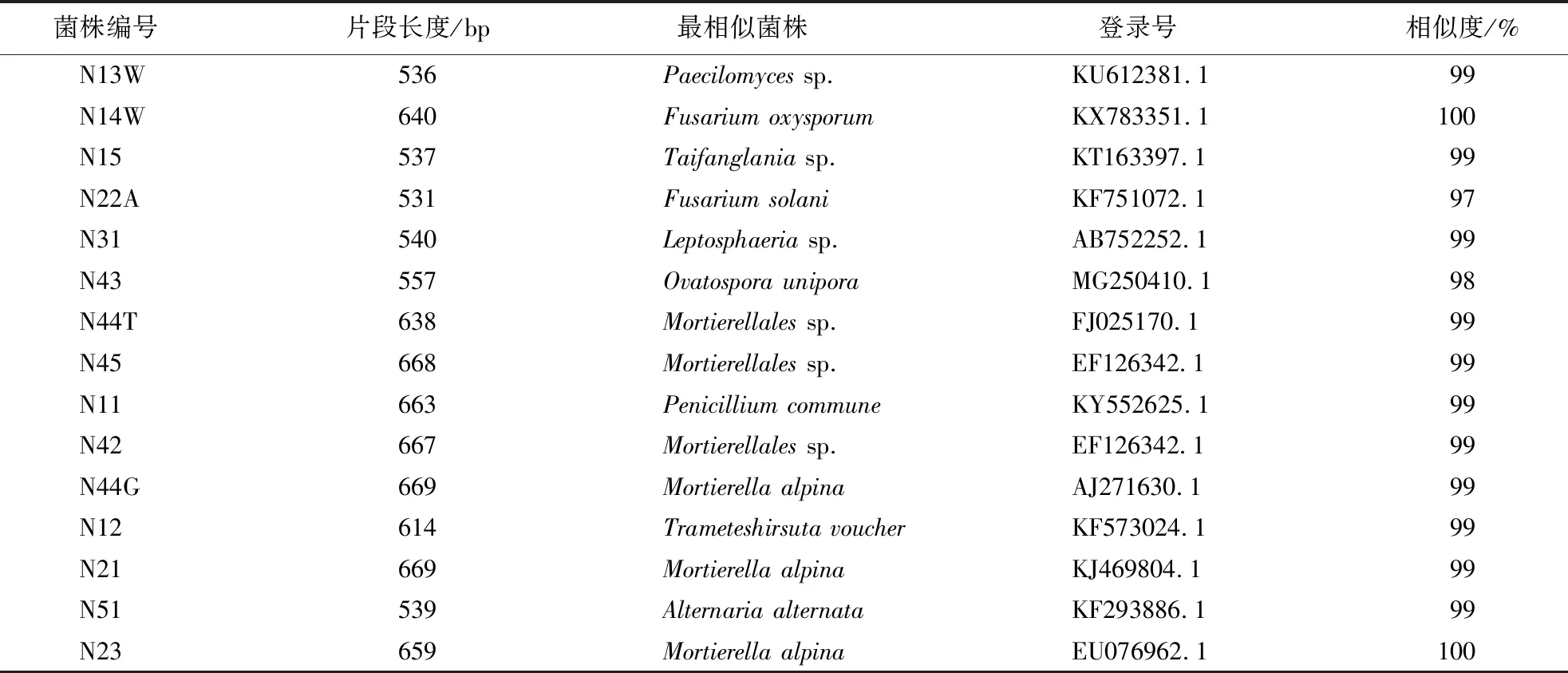
表2 农田土壤分离的优势真菌菌株Blast比对结果Table 2 Blaset comparison of fungal strains isolated from farmland soil
在巨菌草分蘖期,山顶土壤中分离得到的优势真菌菌株分别属于曲霉属(Aspergillus)、被孢霉属、青霉属、踝节菌属(Talaromyces)、篮状菌属(Talaromyces)、分子孢子菌属(Cladosporium)、漆斑菌属.其中,属于被孢霉属的真菌所占的比例最大,属于青霉属的菌株次之(表3).
2.8 土壤酶之间以及土壤酶与可培养真菌之间的关联性分析
如表4所示,URE、S-SC、CAT与ALP之间均呈极显著正相关关系(P<0.01);URE、S-SC与CAT之间呈极显著正相关关系(P<0.01);其他各酶之间不存在显著的相关性(P>0.05).真菌与PPO、S-SC、ALP以及CAT之间均呈正相关关系,而与URE之间呈负相关关系,但相关性均不显著(P>0.05).

表3 山顶土壤分离的优势真菌菌株Blast比对结果Table 3 Blast comparison of fungal strains isolated from hilltop soil

表4 土壤酶之间以及土壤酶与可培养真菌之间的相关性分析1)Table 4 Correlation analysis between soil enzymes and culturable fungi
1)**表示相关性极显著(P<0.01).
3 讨论
3.1 巨菌草对砒砂岩地区土壤酶活性的影响
陈胜男等[14]与刘红艳等[15]的研究结果显示,土壤URE活性与固氮菌呈正相关关系.本研究结果显示,3块样地种植巨菌草后的土壤URE活性比种植前高,这可能与巨菌草根部含有丰富的固氮菌有关[16],说明种植巨菌草能有效促进土壤氮素循环.此外,有研究表明,禾本科—豆科轮作相对其他方式能够更有效增加土壤有机碳储存[17];杨瑞娟等[18]研究表明,禾本科植物伴生番茄,提高了土壤S-SC活性,同时可以减少根结线虫的发生.本研究中的巨菌草也是禾本科植物之一,因此,其在增加土壤有机碳储存和促进团聚体建成方面具有一定优势,可能成为克服连作障碍的伴生植物.
褚素贞等[19]研究了土壤CAT与土壤中全氮、碱解氮、全磷和速效磷、全钾和速效钾等主要肥力因子之间的关系,结果表明土壤CAT与这些肥力因子呈负相关关系.本研究中的3块样地在巨菌草生长期内,土壤CAT活性在拔节期最高,说明土壤肥力在巨菌草拔节期较低.这可能由于巨菌草在拔节期生长迅速,吸收的土壤养分增多,导致土壤中的养分相对较低.但在其他时期CAT活性均低于种植前,表明种植巨菌草总体上能够提高土壤养分.
5种土壤酶之间的关联性分析表明,URE、S-SC、CAT与ALP之间均呈极显著正相关关系,这与安韶山等[20]的研究结果一致.另外,URE、S-SC与CAT之间也呈极显著正相关关系,其他各酶之间不存在显著的相关性.这表明土壤有机物在转化时,土壤酶所发挥的作用并不是孤立的,而是存在相互制约、互相促进的复杂关系,各土壤酶既可专一指示土壤某一种或某一类养分,又可以共同指示土壤肥力.
3.2 巨菌草对砒砂岩地区土壤可培养真菌数量和多样性的影响
真菌具有强大的酶系统,分解复杂有机物质的能力强,可分解植物残体中的纤维素、木质素和果胶等,也可分解含氮蛋白质类化合物释放出氨,对土壤肥力有直接影响[21-22].在巨菌草生长期内,3块样地的土壤可培养真菌数量均在在分蘖期达到峰值,但仅农田分蘖期的土壤真菌数量比种植前高,且农田土壤真菌数量在巨菌草不同生长时期差异显著,说明巨菌草对农田土壤真菌的影响较大.多样性分析发现,3块样地均存在被孢霉属、青霉属的土壤真菌,且所占比例较大.被孢霉属在工业上被广泛用于糖化酶和蛋白酶生产,还可以生产γ-亚麻酸等有机酸[23];土壤青霉菌对瓜果腐霉和尖孢镰刀菌等土壤有害菌有较好的抑制效果[24].此外,在山顶土壤中分离出了产黄青霉(Penicilliumchrysogenum),其对于重金属Cd、Pb、Cu均有一定的抗性[25].因此,种植巨菌草可以提高土壤有益真菌含量.
3.3 土壤酶与可培养真菌之间的相关性
许多研究表明,土壤酶与土壤微生物数量和活性有直接关系[26-28].本研究发现,土壤真菌与URE呈负相关关系,这与李明[29]的研究结果一致.不同学者对于微生物与土壤酶之间的研究有不同的结果[30-32],这与土壤酶来源的广泛、土壤真菌种类的丰富有关[33].本研究中,被孢霉属的土壤真菌是优势菌属,土壤真菌数量与S-SC、ALP、CAT、PPO之间呈正相关关系,其中与S-SC的正相关系数最大.S-SC能够将蔗糖水解成葡萄糖和果糖;顾晓颖等[34]研究表明,高山被孢霉的最佳碳源为葡萄糖.因此,S-SC的增加能够为被孢霉属真菌提供更佳的生长条件.
综上所述,种植巨菌草能够改良土壤状况.今后可从巨菌草不同种植模式、不同种植年限、巨菌草对土壤关键因子的作用方式等方面进一步揭示巨菌草对土壤的改良机制.

