流式细胞术在液体基质食品检测中的应用研究进展
刘婷婷 于靓 孟冬青 吴立蓓 刘璐 郑亦舟 矫强 张建 赵渝
摘 要: 流式细胞术(FCM)是一种新兴的快速检测技术,具有检测快速、简便、灵敏的优势,现已广泛用于食品检测中。因流式检测原理要求,流式细胞术多用于液体食品检测中。该文综述了流式细胞术在液体基质食品如乳制品、酒类、饮料类中的应用。
关键词: 流式细胞术(FCM); 液体食品; 检测
中图分类号: Q 93.338 文献标志码: A 文章编号: 1000-5137(2020)06-0630-07
Abstract: Flow cytometry (FCM) is a new rapid detection technology,which has the advantages of fast,simple and sensitive in detection,therefore has been widely used in food detection.Due to the testing principle of flow detection,FCM is mainly used in detecting for liquid food.This paper reviewed the applications on flow cytometry in liquid matrix foods,such as dairy products,alcohol and beverages.
Key words: flow cytometry(FCM); liquid food; detection
0 引 言
流式細胞术(FCM)[1]是20世纪60年代发展起来的一种细胞分析技术,具有高通量、高灵敏度、高精确度定量和多参数检测的功能特征,能够快速地定量分析和分选液流系统中单个细胞或生物微粒[2]。FCM的工作原理是待测液颗粒依次通过流式细胞仪检测区,被荧光染色标记的细胞在激光照射下激发光信号,光信号经光电倍增管(PMT)转变为电子信号时,以电子波的形式被计算机系统接收和分析[3]。FCM最初主要应用在医学临床检验上[4],随着科学技术的发展和流式细胞仪的完善,FCM开始应用于食品检测[5]。
食品安全问题越来越受到人们的关注,食品中的微生物含量是评价食品卫生的一个重要指标[6],目前,对食品中微生物的快速检测方法有:分子生物学法[7]、荧光PCR(polymerase vhain teaction)法[8]、免疫磁分离法[9]、酶联免疫法[10]、ATP(adenosine triphosphate)生物发光法[11]、LAMP(loop-mediated isothermal amplification)法[12]等。流式细胞术具有检测快速、简便、灵敏的优势,在食品检测领域的应用越来越广泛。流式细胞术检测的样品需为液态,故在液体基质的食品检测中,应用较为广泛,本文作者就流式细胞术在液体基质的食品如乳制品、酒类和饮料产品中应用作了综述。
1 流式细胞术在液体基质食品中的应用
1.1 流式细胞术在乳制品中的应用
近几十年来,中国乳制品行业发展迅速,随着市场规模的扩大和消费需求的提升,相对应的乳制品检测手段也持续发展以满足市场需求。对乳制品中的微生物进行检测是为了保证生产企业产品的质量与安全。目前可用FCM检测的为液体乳类产品。
1.1.1 生乳中菌落总数的检测
根据国家标准GB 19301—2010[13]中规定:原料乳在进行验收时须遵循感官要求、理化指标、微生物限量等指标,其中微生物限量标准为菌落浓度不超过2×106 CFU?g-1(或CFU?mL-1)。目前我国常用的检测方法主要是国标法(GB 4789.2—2016)[14],平板琼脂计数法步骤多、过程较复杂、周期长。1986年,已有国外研究者应用快速检测技术——FCM检测生乳中的单核细胞增生李斯特菌[5]。近年来,国内外研究者开始利用FCM快速检测生乳中的细菌。孙芝杨等[15]、杨莉婷等[16]、王宁等[17]分别以牛乳为原料,加入蛋白酶进行消化处理,通过离心脱脂和尼龙膜过滤去除牛乳中的大颗粒物质,再加入荧光染料孵育,最后通过FCM进行计数分析。结果表明,当细菌浓度分别在1×104~1×107 CFU?mL-1,1×102~1×107 CFU?mL-1,1×104~1×108 CFU?mL-1范围内时,FCM法与国标法检测结果相关性良好,且整个检测过程不超过1 h。HOLM等[18]以农场采集的75份牛乳为原料,加入蛋白酶在40 ℃下反应后再进行离心处理,采用FCM结合荧光染料对牛乳中的细菌进行计数,结果表明:当细菌浓度在1×104~1×106 CFU?mL-1范围内时,FCM计数结果和标准平板法计数结果具有良好的相关性,检测时间约为30 min。CASSOLI等[19]以100份生乳为原料,加入蛋白水解酶和荧光染料一起孵育,再进行超声处理以解离团块细菌,采用流式细胞术和标准平板计数法分别对生乳进行细菌计数,结果表明:牛乳在冷藏条件下,细菌浓度在1×104~1×107 CFU?mL-1范围内,FCM和标准平板计数法的计数结果可进行转换。由于平板计数法的计数结果中不包括受损细胞或不可培养的细胞[20],计数结果有偏差,存在食品安全隐患,采用FCM法检测的结果更加准确。
1.1.2 发酵乳中乳酸菌的检测
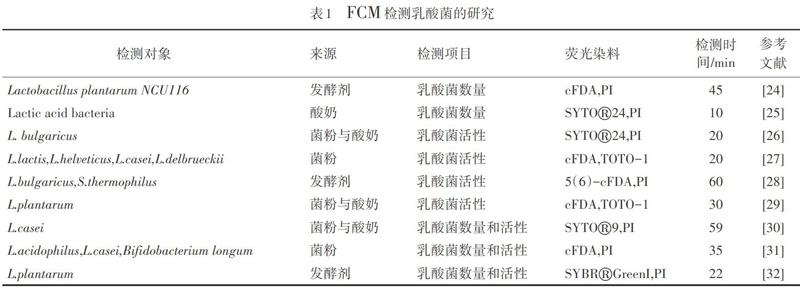
传统发酵乳饮品是以生牛(羊)乳或乳粉为原料,经杀菌和发酵剂发酵制成的[21]。发酵乳具有易消化的蛋白质、脂肪、维生素和矿物质元素,另有研究发现发酵乳具有改善肠道菌群、预防肠道疾病等保健作用[22],因而越来越受到人们的喜爱。由于发酵乳产业发展迅速,为保证其产品质量与食品安全,国家制定了《GB 19302—2010食品安全国家标准 发酵乳》[23],对发酵乳中的乳酸菌含量作了规定,即乳酸菌浓度要大于等于1×106 CFU?mL-1(或CFU?g-1)。国标中所采用的检测方法为MRS(de man,rogosa and sharpe) 琼脂平板计数法,其检测周期较长,因发酵乳产品保质期较短,但市场需求量大,新型兴起的快速检测方法——FCM法非常契合产业需求。国际标准ISO19344:2015提供了流式细胞术用于检测乳制品的发酵产品、发酵菌种和乳酸菌的定量方法。国内外对采用FCM检测发酵乳中的乳酸菌数量与活性的研究越来越多,如表1所示。
1.2 FCM在酒类产品中的应用
FCM在酒类产品的应用主要体现在啤酒和葡萄酒的发酵生产中。在啤酒发酵生产中,利用流式细胞术监测酵母活性情况以及酵母年龄,以便进行回收;在葡萄酒发酵生产中,利用FCM监测发酵微生物活性情况以及监测是否产生腐败酵母,来控制产品质量。
1.2.1 啤酒中酵母的检测
啤酒以麦芽、水为主要原料,加啤酒花,经酵母发酵酿制而成,是含有二氧化碳的、起泡的低酒精度发酵酒[33],其中酵母对啤酒的发酵性能和风味指标具有决定性影响。在啤酒发酵过程中,酵母的生理特征会发生变化,因此全面、高效地评价酵母性能,实时监测酵母的最佳发酵能力,对控制啤酒的质量十分重要[34]。目前,多数啤酒产业采用亚甲基兰染色法[35]和平板培养法检测啤酒发酵中酵母的活性。随着快速检测技术的发展,国内外研究者开始利用FCM来监测酵母活性。M?LLER等[36]利用FCM结合荧光染料FITC/DAPI对啤酒发酵中酵母的生长情况与生理状态进行检测。张岩等[37]利用FCM结合荧光染料DHR和反1,3-二丁基巴比妥酸次甲基着色剂(OXN),对连续斜面接种中酵母的单细胞生理状况进行检测,检测到的荧光强度与酵母细胞的增殖有很密切关系,可以用来监测啤酒发酵后期的酵母状态。罗娜[35]研究了利用FCM与Guava ViaCount Reagent试剂盒中染色剂检测酵母活性的方法,同时将这一方法应用于实际生产中,利用FCM跟踪了发酵过程中,不同代数酵母的发酵液中酵母的细胞数和活性情况。KU?EC等[38]基于选择性芽疤痕染色和FCM检测荧光强度,开发了一种快速评估酵母年龄的方法,可应用于啤酒分批发酵和连续发酵过程中酵母的年龄控制。综上,采用FCM实时监测啤酒发酵过程中酵母的活性和生长情况,对于啤酒发酵具有实际意义。
1.2.2 葡萄酒中的检测
葡萄酒是以葡萄或葡萄汁为原料,经全部或部分发酵酿制而成的含有一定酒精度的发酵酒[39]。对葡萄酒发酵中不断变化的酵母和细菌混合种群进行实时监测,分析发酵菌的活性状态以及是否产生变质酵母,对于葡萄酒品质和安全的控制有一定作用。利用FCM与特定染料对葡萄酒酒精发酵和乳酸发酵过程中细胞的生理状态进行检测在国外已有研究。SALMA等[40]利用FCM结合荧光染料BOX/PI,在同时进行的酒精-乳酸的葡萄酒发酵中快速区分和定量检测活酵母和乳酸菌种群。SERPAGGI等[41]提出了利用流式细胞术结合荧光原位杂交法定量检测葡萄酒发酵中产生的腐败酵母,有利于防止葡萄酒发生变质。
1.3 流式细胞术在饮料产品中的应用
1.3.1 饮用水中微生物的检测
飲用水安全一直是社会热点话题,对饮用水中的细菌检测是非常必要的。在国外,已有使用流式细胞术检测冷却塔水域中的军团菌的相关研究[42]。在计数方面,VAN NEVEL等[43]利用FCM代替异养平板计数法检测饮用水中的细菌总数,可以定量整个细菌群落,结果更加准确。严心涛等[44]建立了基于FCM的高通量定量检系统,实现了对饮用水中细菌的快速定量检测。VAN NEVEL等[45]利用FCM对当地的饮用水官网中细菌的数量和生长情况进行了检测,进一步分析了饮用水安全,表明FCM适用于对微生物点污染的检测。综上,流式细胞术可用于对饮用水中微生物计数和评价饮用水的处理效能,并使得检测更便捷、省时。
在饮用水处理方面,过滤和消毒是饮用水常规处理的关键环节,需要对每个环节进行细菌浓度检测,进而实时评估处理效果。HELMI等[46]对3个水厂的饮用水处理进行为期4个月的监测,分别对砂滤、臭氧处理和活性炭过滤处理后的饮用水进行监测,利用FCM结合荧光染料SYBR Green II/PI对不同饮用水处理后的细胞浓度和细胞活性进行检测,从而评估处理效果。CHESWICK等[47]研究了FCM在饮用水氯消毒过程中的评估效果,通过采用不同自由氯浓度对饮用水进行不同时长的处理,利用FCM SYBR Green I/PI检测处理后的饮用水中细菌细胞膜的完整性来评估氯消毒效果。综上,利用FCM对饮用水中微生物进行计数以及对饮用水处理环节进行监控,有利于饮用水的安全控制。
1.3.2 果汁中微生物的检测
果汁在生产过程中被微生物污染之后,会产生混浊、气泡和不正常的气味,其通常是由霉菌和酵母菌及极少数细菌引起的,因此可通过检测果汁中的微生物数量来测定其被污染程度。目前主要的检测方法是平板计数法,检测的周期长达5 d[48]。在20世纪90年代已有关于流式细胞术应用于饮料中微生物检测的报告[49]。利用FCM不仅可以检测果汁中微生物的数量,还可对其活性进行检测以评价其产品质量。刘道亮等[50]研究了利用FCM快速检测果汁中的霉菌和酵母菌,检测时间从5 d缩短到 100 min。HE等[51]建立了一种纳米FCM与样品预处理方案相结合的无标记方法来检测果汁中的细菌数量。ALMEIDA等[52]研究发现:在番石榴、芒果和菠萝汁中加入薄荷精油,能影响果汁中存在的变质酵母的生理活性,可通过FCM结合荧光染料检测果汁中的酵母活性情况,判断薄荷精油的作用。综上,利用FCM对果汁中的微生物数量和活性进行检测,有利于果汁的质量控制与评价。
2 结 语
FCM的使用与发展不仅克服了平板计数法操作复杂、检测周期长、无法同时检测多个样品的缺点,还可以实时检测细胞活性,对于实际生产具有重要意义。当然,FCM也存在一定局限性,目前FCM多用于检测液体基质食品,并且在检测不同微生物时所用到的荧光染料具有特异性,同种染料不能应用于所有微生物中。随着FCM的发展与完善,荧光染料进一步得到开发,FCM有望在其他食品,如生肉中致病菌、调味品酱油和醋中细菌的等检测中得到应用。
参考文献:
[1] KAMENTSKY L A,MELAMED M R,DERMAN H.Spectrophotometer:new instrument for ultrarapid cell analysis [J].Science,1965,150(3696):630-631.
[2] 夏天爽.流式细胞术在食品微生物检测领域的研究进展 [J].食品安全导刊,2019(34):62-64.
XIA T S.Progress of flow cytometry in the field of food microbiological detection [J].China Food Safety Magazine,2019(34):62-64.
[3] 陈朱波,曹雪涛.流式细胞术:原理,操作及应用 [M].北京:科学出版社,2014:15-28.
CHEN Z B,CAO X T.Flow Cytometry:Principle,Operation and Application [M].Beijing:Science Press,2014:15-28.
[4] NICOLETTI I,MIGLIORATI G,PAGLIACCI M C,et al.A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry [J].Journal of Immunological Methods,1991,139(2):271-279.
[5] DONNELLY C W,BAIGENT G J.Method for flow cytometric detection of Listeria monocytogenes in milk [J].Applied and Environmental Microbiology,1986,52(4):689-695.
[6] 何方洋,萬宇平,贾芳芳,等.流式细胞仪在检测食品中微生物的应用研究 [J].山东畜牧兽医,2016,37(8):82-84.
HE F Y,WANG Y P,JIA F F,et al.Application of flow cytometry in the detection of microorganisms in food [J].Shangdong Journal of Animal Science and Veterinary Medicine,2016,37(8):82-84.
[7] LAIZ?NE L,EGL?TE L,CIBROVSKA A,et al.Detection of Salmonella spp.presence in food and samples from primary steps of food production chain using microbiological and molecular biology methods [J].Environmental and Experimental Biology,2019(1):45-46.
[8] LINACERO R,SANCHIZ A,BALLESTEROS I,et al.Application of real-time PCR for tree nut allergen detection in processed foods [J].Critical Reviews in Food Science and Nutrition,2019,60(7):1-17.
[9] ZHU P,SHELTON D R,LI S,et al.Detection of E.coli O157:H7 by immunomagnetic separation coupled with fluorescence immunoassay [J].Biosensors and Bioelectronics,2011,30(1):337-341.
[10] 肖钢军,林兆盛.酶联免疫吸附(ELISA)法在食品微生物检测中的应用 [J].食品安全导刊,2016(18):106-107.
XIAO G J,LIN Z S.Application of enzyme-linked immunosorbent assay(ELISA) in the detection of food microorganisms [J].China Food Safety,2016(18):106-107.
[11] LEE J,PARK C,KIM Y,et al.Signal enhancement in ATP bioluminescence to detect bacterial pathogens via heat treatment [J].BioChip Journal,2017,11(4):287-293.
[12] 王欢.可视化LAMP法等温快速检测病原菌与恒温纸质微流体芯片构建的研究 [D].重庆:第三军医大学,2017.
WANG H.Isothermal and rapid detection of pathogenic bacteria using a visual LAMP technology and the construction of Isothermal paper microfluidic chip [D].Chongqing:Third Military Medical University,2017.
[13] 中华人民共和国卫生部.食品安全国家标准 生乳:GB 19301—2010 [S].北京:中国标准出版社,2010.
[14] 国家食品药品监督管理总局,国家卫生和计划生育委员会.食品安全国家标准 食品微生物学检验 菌落总数测定:GB 4789.2—2016 [S].北京:中国标准出版社,2016.
[15] 孙芝杨,黄闯,李新建,等.流式细胞法对乳制品中细菌总数的快速检测研究 [J].食品工业.2016,37(11):180-182.
SUN Z Y,HUANG C,LI X J,et al.Rapid determination of total number of bacterial in dairy products by flow cytometry [J].The Food Industry,2016,37(11):180-182.
[16] 杨莉婷,何丽,何海宁,等.流式细胞术对生乳中微生物检测的应用研究 [J].广西师范大学学报(自然科学版),2017,35(2):112-116.
YANG L T,HE L,HE H N,et al.Application of flow cytometry in detection of microorganism in raw milk [J].Journal of Guangxi Normal University(Natural Science),2017,35(2):112-116.
[17] 王宁,刘宁.流式细胞术快速检测生乳中细菌总数 [J].食品工业科技,2007,28(9):197-200.
WANG N,LIU N.A flow cytometry method for rapid detection of total bacteria in raw milk [J].Science and Technology of Food Industry,2007,28(9):197-200.
[18] HOLM C,MATHIASEN T,JESPERSEN L.A flow cytometric technique for quantification and differentiation of bacteria in bulk tank milk [J].Journal of Applied Microbiology,2004,97(5):935-941.
[19] CASSOLI L D,LIMA W J,ESGUERRA J C,et al.Do different standard plate counting (IDF/ISSO or AOAC) methods interfere in the conversion of individual bacteria counts to colony forming units in raw milk? [J].Journal of Applied Microbiology,2016,121(4):1052-1058.
[20] 刘新星,霍转转,云慧,等.流式细胞术在细菌快速检测中的应用 [J].微生物学通报,2014(1):161-168.
LIU X X,HUO Z Z,YUN H,et al.Application of flow cytometry in rapid detection of bacteria [J].Microbiology China,2014(1):161-168.
[21] 胡姝敏,赵臻,巩燕妮.发酵乳的发展及创新趋势 [J].当代旅游(下旬刊),2019(6):183-184.
HU S M,ZHAO Z,GONG Y N.Development and innovation trend of fermented milk [J].Contemporary Tourism,2019(6):183-184.
[22] 刁治民,于學军.发酵乳的营养价值及保健作用 [J].中国乳品工业,1998(5):3-5.
DIAO Z M,YU X J.Nutritional value and health care effect of fermented milk [J].China Dairy Industry,1998(5):3-5.
[23] 中华人民共和国卫生部.食品安全国家标准 发酵乳:GB 19302—2010 [S].北京:中国标准出版社,2010.
[24] 熊涛,廖良坤,黄涛,等.植物乳杆菌NCU116菌剂的喷雾干燥制备 [J].食品与发酵工业,2015,41(8):23-29.
XIONG T,LIAO L K,HUANG T,et al.Application of spray drying on Lactobacillus plantarum NCU116 starter culture [J].Food and Fermentation Industries,2015,41(8):23-29.
[25] 王杰,郑亦舟,姜凯,等.乳酸菌计数结果的比较研究 [J].上海师范大学学报(自然科学版),2018,47(6):713-718.
WANG J,ZHENG Y Z,JIANG K,et al.Comparative study on Lactobacillus count results [J].Journal of Shanghai Normal University(Natural Sciences),2018,47(6):713-718.
[26] 郑亦舟,王杰,刘洋,等.基于流式细胞术的保加利亚乳杆菌活性检测方法的应用研究 [J].食品安全質量检测学报,2019,10(3):589-592.
ZHENG Y Z,WANG J,LIU Y,et al.Application research of Lactobacillus activity detection method based on flow cytometry [J].Journal of Food Safety and Quality,2019,10(3):589-592.
[27] BUNTHOF C J,BLOEMEN K,BREEUWER P.Flow Cytometric assessment of viability of lactic acid bacteria [J].Applied and Environmental Microbiology,2001,67(5):2326-2335.
[28] 叶雷,陈庆森,阎亚丽,等.流式细胞术快速检测直投式发酵剂菌体活力 [J].食品科学,2014,35(10):139-144.
YE L,CHEN Q S,YAN Y L,et al.Rapid assessment of bacterial viability by flow cytometry in direct vat set yogurt starter [J].Food Science,2014,35(10):139-144.
[29] BUNTHOF C J,ABEE T.Development of a flow cytometric method to analyze subpopulations of bacteria in probiotic products and dairy starters [J].Applied and Environmental Microbiology,2002,68(6):2934-2942.
[30] HE S,HONG X,HUANG T,et al.Rapid quantification of live/dead lactic acid bacteria in probiotic products using high-sensitivity flow cytometry [J].Methods and Applications in Fluorescence,2017,5(2):24002.
[31] GANDHI A,SHAH N P.Effect of salt on cell viability and membrane integrity of Lactobacillus acidophilus,Lactobacillus casei and Bifidobacterium longum as observed by flow cytometry [J].Food Microbiology,2015,49:197-202.
[32] BENSCH G,R?GER M,WASSERMANN M,et al.Flow cytometric viability assessment of lactic acid bacteria starter cultures produced by fluidized bed drying [J].Applied Microbiology and Biotechnology,2014,98(11):4897-4909.
[33] 国家质量监督检验检疫总局.啤酒:GB/T 4927—2008 [S].北京:中国标准出版社,2008.
[34] 韩龙.酵母活性之分析与改进 [J].中外酒业·啤酒科技,2018(3):54-57.
HAN L.Analysis and improvement of yeast activity [J].Global Alcinfo BeefTech,2018(3):54-57.
[35] 罗娜.流式细胞仪检测啤酒酵母活性方法的建立及应用研究 [J].中外酒业·啤酒科技,2019(15):17-23.
LUO N.The estabilishement and appication of Saccharomyces cerevisiae valibility detected by flow cytomerte [J].Global Alcinfo BeerTech,2019(15):17-23.
[36] M?LLER S,HUTTER K J,BLEY T,et al.Dynamics of yeast cell states during proliferation and non proliferation periods in a brewing reactor monitored by multidimensional flow cytometry [J].Bioprocess Engineering,1997,17(5):287-293.
[37] 张岩,孙功伟.检测高辅料比啤酒连续转接的酵母细胞生理研究学 [J].啤酒科技,2008(1):55-58.
ZHANG Y,SUN G W.Studies on the physiology of yeast cells after continuous transfer with high excipient ratio beer [J].Beer Science and Technology,2008(1):55-58.
[38] KU?EC M,BASZCZY?SKI M,LEHNERT R,et al.Flow cytometry for age assessment of a yeast population and its application in beer fermentations [J].Journal of the Institute of Brewing,2009,115(3):253-258.
[39] 國家质量监督检验检疫总局.葡萄酒:GB/T 15037—2006 [S].北京:中国标准出版社,2006.
[40] SALMA M,ROUSSEAUX S,SEQUEIRA-LE GRAND A,et al.Cytofluorometric detection of wine lactic acid bacteria:application of malolactic fermentation to the monitoring [J].Journal of Industrial Microbiology and Biotechnology,2013,40(1):63-73.
[41] SERPAGGI V,REMIZE F,GRAND A S L,et al.Specific identification and quantification of the spoilage microorganism Brettanomyces in wine by flow cytometry:a useful tool for winemakers [J].Cytometry Part A,2010,77A(6):497-499.
[42] TYNDALL R L,R E H J,MANN R C,et al.Application of flow cytometry to detection and characterization of Legionella spp.[J].Applied and Environmental Microbiology,1985,49(4):852-857.
[43] VAN NEVEL S,KOETZSCH S,PROCTOR C R,et al.Flow cytometric bacterial cell counts challenge conventional heterotrophic plate counts for routine microbiological drinking water monitoring [J].Water Research,2017,113:191-206.
[44] 严心涛,王策,裴智果,等.快速定量检测细菌的FCM系统研制及性能评估 [J].光学精密工程,2019,27(6):1245-1254.
YAN X T,WANG C,PEI Z G,et al.Development and performance evaluation of flow cytometry for rapid quantitative detection of bacteria [J].Optics and Precision Engineering,2019,27(6):1245-1254.
[45] VAN NEVEL S,BUYSSCHAERT B,DE GUSSEME B,et al.Flow cytometric examination of bacterial growth in a local drinking water network [J].Water and Environment Journal,2016,30(1/2):167-176.
[46] HELMI K,WATT A,JACOB P,et al.Monitoring of three drinking water treatment plants using flow cytometry [J].Water Supply,2014,14(5):850-856.
[47] CHESWICK R,MOORE G,NOCKER A,et al.Chlorine disinfection of drinking water assessed by flow cytometry:new insights [J].Environmental Technology & Innovation,2020,19:101032.
[48] 国家卫生和计划生育委员会.食品安全国家标准 食品微生物学检验 霉菌和酵母计数:GB 4789.15—2016 [S].北京:中国标准出版社,2016.
[49] LAPLACE-BUILH? C,HAHNE K,HUNGER W,et al.Application of flow cytometry to rapid microbial analysis in food and drinks industries [J].Biology of the Cell,1993,78(1):123-128.
[50] 刘道亮,胡连霞,赵占民,等.流式细胞技术快速检测果汁中的霉菌、酵母菌 [J].食品工业科技,2011,32(8):387-391.
LIU D L,HU L X,ZHAO Z M,et al.Study on a flow cytometry method in rapid detection of mold and yeast in fruit juice [J].Science and Technology of Food Industry,2011,32(8):387-391.
[51] HE S,HONG X,ZHANG M,et al.Label-free detection of bacteria in fruit juice by nano-flow cytometry [J].Analytical Chemistry,2020,92(3):2393-2400.
[52] ALMEIDA E T D C,DE SOUZA G T,DE SOUSA GUEDES J P,et al.Mentha piperita L.essential oil inactivates spoilage yeasts in fruit juices through the perturbation of different physiological functions in yeast cells [J].Food Microbiology,2019,82:20-29.
(责任编辑:顾浩然,包震宇)

