金线莲应答高温胁迫的蛋白质组学分析
梅瑜 王继华 蔡时可 陈栋


摘要:金线莲是传统的名贵中药材,以耐热品系金线莲NYJ2为研究对象,分析其在蛋白质水平上对高温胁迫的响应。通过比较高温胁迫前后NYJ2叶片蛋白质组学的变化,获得二级图谱326 478个,匹配到34 376个,鉴定到肽段9 804个,蛋白质2 534个,大多数肽段分布的长度在7~25 aa。通过对高温胁迫前后蛋白质数量和种类的差异分析,共获得143个差异表达的蛋白质,其中,40个蛋白质上调表达,103个下调表达,HSP20家族的基因(HSP17.4)编码蛋白质、病程相关蛋白质(PR)、谷胱甘肽S-转移酶(GSTF1)、过氧化氢酶(CAT)的表达差异较多。另外,在KOG功能分类中发现有112个功能不明确的蛋白质,223个信号转导机制蛋白质。通过分析NYJ2在蛋白质组学层面对热胁迫的响应,为金线莲耐热栽培提供了参考依据。
关键词:金线莲;高温胁迫;耐热资源;蛋白质组学
中图分类号:Q816;S567文献标识码:A文章编号:1000-4440(2020)06-1389-09
Abstract:Anoectochilus roxburghii is a kind of precious Chinese herbal medicine. In this study, the heat-resistant A. roxburghii strain NYJ2 was used as the research object to study its response to high temperature stress at protein level. 326 478 second-order spectra were got by comparing the difference of protemics for the leaves of NYJ2 before and after high temperature stress. After filtering, 34 376 spectra were matched, 9 804 peptides and 2 534 proteins were identified. The length range of most peptides was 7-25 aa. 143 differentially expressed proteins were got by analyzing the number and species differences of the proteins before and after high temperature stress, 40 of which were significantly up-regulated and 103 were significantly down-regulated. There were many expressional differences in the HSP20 family gene (HSP17.4) encoded protein, pathogenesis-related (PR) protein, glutathione S-transferase (GSTF1) and catalase (CAT). In addition, 112 proteins with ambiguous functions were found during functional classification of KOG, and 223 proteins were related to signaling mechanism. References are made for the heat-resistant cultivation of A.roxburghii by analyzing the response of NYJ2 to high temperature stress at protemics level.
Key words:Anoectochilus roxburghii;high temperature stress;heat resistant resources;proteomics
金線莲[Anoectochilus roxburghii(Wall.) Lindl],又名金线兰、金线虎头蕉等,为兰科开唇兰属多年生植物,是一种传统的名贵中药材,主要分布于中国、日本、斯里兰卡、印度和尼泊尔等国家,在中国主要分布在广东、广西、云南、福建和台湾等地区[1]。金线莲以全草入药,具有清热凉血、消炎解毒、强心利尿、扶正固本、养寿延年的功效,对癌症、糖尿病、高血压、心脏病、妇科疾病、小儿发热以及蛇毒咬伤等有很好的疗效,享有“药中之王”的美誉,是珍稀名贵的中药材[2]。高温胁迫是限制植物生长和发育的主要非生物胁迫因子。金线莲喜阴凉湿润环境,对高温敏感,人工栽培的金线莲难以越夏,因此高温严重制约着金线莲产业的发展。喷施外源激素可提高兰科植物铁皮石斛的耐热性,但其调控响应机制的研究还未见报道[3]。药用植物蛋白质组学是开展功能基因挖掘、化合物代谢通路及功能机制等研究的有效工具[4]。对药用植物进行蛋白质组学研究,通过蛋白质差异表达谱的分析比较,能够获得药用植物不同组织部位的蛋白质表达差异,更准确地获得有效成分,也能够揭示其活性成分在植物生长过程中的累积变化规律;在临床研究方面,通过比对分析用药前后模式动物组织中蛋白质表达谱的差异,可以获得对治疗有效的蛋白质,从而寻找到植物中的活性成分,有助于发现药用植物体内有效成分组成及作用机制。利用蛋白质组学研究拟南芥(Arabidopsis thaliana)、大豆[Glycine max (Linn.) Merr.]、水稻(Oryza sativa L.)、小麦(Triticumaestivum L.)、马齿苋(Portulacaoleracea L.)和半夏(Pinelliaternata)等不同耐热类型植物对高温胁迫的响应发现,蛋白质的表达模式变化各异,大多涉及应答网络体系中重要的信号与代谢通路(如热激蛋白、信号转导、胁迫防御和光合作用等) [5]。其中,应激反应性蛋白植物热激蛋白70(Heat shock protein 70, HSP70) 是一类高度保守的蛋白,与植物抗逆性具有密切的关系,HSP70蛋白家族的遗传学和生化功能研究被广泛关注[6]。花楸树叶片在热处理1 h时,SpHSP70-1表达量达到最高值,而后开始显著下降,在热处理24 h 内,其表达量变化差异达到上百倍[7]。药用植物应答逆境胁迫时次生代谢产物相关的蛋白质组学变化也是研究的热点[8]。本研究分析了金线莲如何在蛋白质水平上对高温胁迫进行响应,将有助于了解胁迫因子对植物的伤害机制及植物的适应机制,为耐热金线莲品种选育及栽培技术提高提供帮助。
1材料与方法
1.1供试材料
试验材料为广东省农业科学院作物研究所筛选出的耐热金线莲品系NYJ2。
1.2试验方法
1.2.1材料处理方法将NYJ2的组培苗经驯化后,定植于泥炭土∶蛭石=1∶1(体积比)的培养钵内,放于昼/夜(12 h/12 h)温度为25 ℃/18 ℃、光照度为2 000 lx、相对空气湿度为80%±5%的人工气候培养箱中培养,每天上午浇水1次,每株浇水20 ml。培养15 d后,挑选生长状态一致的金线莲进行45 ℃高温胁迫,在胁迫0 h、1 h时进行取样,每处理2个重复,每处理取金线莲不同部位的叶片,迅速装入冻存管并灌入液氮,待叶片冷冻后迅速放入-80 ℃冰箱保存。
1.2.2叶片蛋白质的提取方法叶片蛋白质的提取参照蛋白质提取试剂盒(BSP001, Sang Biotech Co., Ltd.)的操作規程。
1.2.3同位素标记相对和绝对定量(iTRAQ)测序流程将样品进行还原烷基化处理,将二硫键打开以便于充分酶解蛋白质;按照2D-quant-kit操作方法进行蛋白质浓度测定,等体积进行SDS(十二烷基硫酸钠)电泳;37 ℃下用胰蛋白酶将提取的蛋白质水解过夜;用iTRAQ试剂来标记肽段;然后将标记后的肽段进行等量混合,使用强阳离子交换色谱进行预分离;最后通过液相串联质谱对标记肽进行分析,获取差异表达肽段。
1.2.4iTRAQ数据分析根据iTRAQ定量蛋白质组学分析流程,将质谱获得的肽段进行峰识别,建立参考数据库;利用Mascot2.3.02蛋白质鉴定软件,通过NCBInr数据库选择适合的蛋白质数据库对获得的肽段和蛋白质进行定性、定量分析,并进行GO功能注释、KEGG代谢通路注释、KOG注释,对获得的差异蛋白质进行相关功能注释。
2结果与分析
2.1金线莲应答高温胁迫的蛋白质组学测序基本信息
对高温胁迫前后NYJ2叶片蛋白质表达谱进行分析,结果(图1)显示,二级图谱总数量为326 478个,经过数据过滤,匹配到的图谱数量为34 376个;其中,匹配到的特有肽段图谱数量为30 458个,能够鉴定到的肽段有9 804个,特有肽段序列数量为9 034个,鉴定到的蛋白质数量为2 534个。
2.1.1蛋白质的相对分子质量从高温胁迫前后金线莲叶片中蛋白质的相对分子质量大小来看,鉴定出来的蛋白质相对分子质量主要集中在10 000~80 000,其数量约占总蛋白质数量的83.94%,其中相对分子质量为20 000~30 000和30 000~40 000的蛋白质数量分别为439个和429个,分别占总蛋白质数量的17.32%和16.93%;相对分子质量为0~10 000的蛋白质数量占总蛋白质数量的3.28%,相对分子质量为80 000~100 000的蛋白质数量占总蛋白质数量的5.25%,相对分子质量>100 000的蛋白质数量占总蛋白质数量的7.54%左右(图2)。
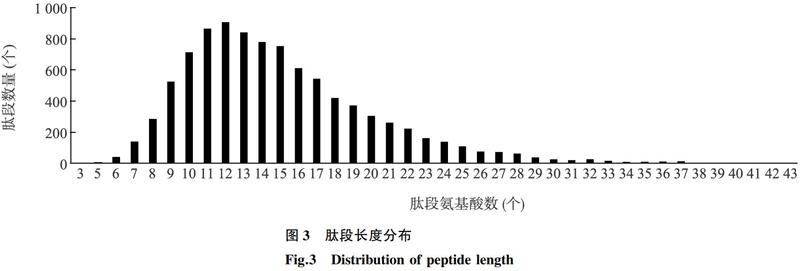
2.1.2肽段长度分布从高温胁迫前后金线莲叶片中肽段的序列长度(图3)来看,大多数肽段长度在7~25 aa,约占总肽段数的96.50%,其中长度在11~15 aa的肽段数所占总肽段数的比例较大,特别是长度为12 aa的肽段数量最多。
2.1.3肽段序列覆盖度分析肽段序列覆盖度可知,蛋白质肽段覆盖度在40%~100%的有222个,占总蛋白质数量的8.76%;其余91%左右的肽段覆盖度≤40%,覆盖度在0~10%的蛋白质数量最多,有1 051个,占总蛋白质数量的41.48%,其次是覆盖度为10%~15%的蛋白质数量,有376个,占总蛋白质数量的14.84%;覆盖度在15%~40%的蛋白质数量占总蛋白质数量的34.93%。
2.1.4肽段数量分布由鉴定到的蛋白质所含肽段的数量分布情况(图4)看出,含有1个肽段的蛋白质数量最多,有858个,占总鉴定蛋白质数量的33.86%;其次是含有2个肽段的蛋白质数量,有491个;大于11个肽段的蛋白质数量有182个;1~10个肽段的蛋白质数量随着匹配肽段数量的增加而减少。
2.2金线莲应答高温胁迫的蛋白质组学蛋白质的功能注释
2.2.1KEGG注释在生物体内,不同蛋白质相互协调行使其生物学行为,为了获得高温胁迫下金线莲叶片蛋白质参与活动的主要代谢途径以及信号转导的途径,对获得的蛋白质进行代谢通路分析,结果发现获得的2 534个蛋白质对应的1 193个基因被注释到115个通路中,按注释基因数量大小依次列出10个通路(表1),其中在碳代谢通路中注释的蛋白质数量最多,为161个,占注释总数的13.50%;其次是氨基酸合成通路,被注释的蛋白质有124个,占注释总数的10.39%;其他包括核糖体(78个,6.54%)、内质网蛋白质加工(76个,6.37%)、糖酵解(61个,5.11%)、氧化磷酸化(59个,4.95%)等代谢通路。
2.2.2GO注释对高温胁迫前后获得的所有金线莲叶片的蛋白质进行GO功能注释,主要对分子功能、生物学过程和细胞组分中所涉及的GO条目及相应的蛋白质ID和数量进行统计分析,并略去没有相应蛋白质的GO条目。结果显示,所有鉴定到的蛋白质被注释到41个GO条目中(图5)。在生物学过程中,注释蛋白质数量较多的是代谢过程、细胞过程和单一生物体过程,分别为1 584个、1 342个、1 205个;在分子功能中,催化活性和结合的注释蛋白质数量较多,分别为1 317个和1 135个;在细胞组分中,细胞和细胞器的注释蛋白质数量较多,分别为1 470个和1 207个。
2.2.3KOG注释将高温胁迫获得的2 534个金线莲叶片蛋白质与KOG数据库进行比对,对这些蛋白质的功能进行预测,并对其做功能分类统计。结果(图6)显示,这些蛋白质被注释到25个功能类群中。其中,翻译后修饰、蛋白质转换、伴侣类群的蛋白质数量最多,为690个,占所有注释蛋白质数量的27.23%;其次,一般功能预测有549个蛋白质,占所有注释蛋白质数量的21.67%;另外,发现未知功能的蛋白质有112个;信号转导机制的蛋白质有223个,占所有注释蛋白质数量的8.80%。
2.3高温胁迫前后差异蛋白质的表达分析
为了进一步揭示高温胁迫对金线莲叶片生理生化的影响及耐高温调控机制,对获得的蛋白质进行高温胁迫前后差异蛋白质表达分析。依据蛋白质丰度水平,当差异倍数达到1.2倍以上,且经统计检验其P值小于0.05时,视为差异蛋白。对高温胁迫前后的蛋白质表达量进行分析,对照样本和高温胁迫处理样本共鉴定到143个差异表达蛋白质,其GO功能注释如图7所示。其中,上调表达的蛋白质有40个,下调表达的蛋白质有103个,说明金线莲在应答高温胁迫时,叶片的蛋白质作用以负调控为主。尤其是HSP20家族的17 400热激蛋白和叶绿体中的牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl pyrophosphate synthase,GGPP)蛋白质的表达量在高温胁迫后显著下调;显著上调的是病程相关蛋白质(Pathogenesis-related protein,PR)、叶绿体的Fructokinase-6(果糖激酶二硫键异构酶)、谷胱甘肽S-转移酶(Glutathione S-transferase,GSTF1)等蛋白质表达量。
2.3.1差异表达蛋白质的KEGG富集分析对高温胁迫后金线莲样本和胁迫前金线莲样本的差异表达蛋白质以KEGG通路为单位,通过超几何检验,寻找差异表达蛋白质显著富集途径。通过通路的显著性富集来确定高温胁迫前后金线莲叶片的差异表达蛋白质参与高温胁迫的主要生化代谢途径和信号传导途径。结果发现,差异表达蛋白质被注释到52个通路中,表2为注释差异表达蛋白质最多的前20条通路。
其中,差异表达蛋白质较多的通路是碳循环途径、卟啉和叶绿素代谢途径、氨基酸合成途径等(表2),且卟啉和叶绿素代谢途径的基因表达量显著上调。
2.3.2差异表达蛋白质的GO富集分析将金线莲高温胁迫前后叶片的差异表达蛋白质通过GO显著性富集分析,与所有鉴定得到的蛋白质进行比较,获得差异表达蛋白质与生物学功能相关性(表3)。
从分组间差异表达蛋白质来看,GO生物学过程富集的条目最多,有506条。差异表达蛋白质有106个,被注释的蛋白质有1 863个,按富集数量依次列出较多的10个通路(表3):代謝过程、细胞过程、有机物代谢过程、细胞代谢过程、单有机体过程、初级代谢过程、单有机体细胞过程、单有机体代谢过程、高分子代谢过程、生物合成过程。
其次是GO分子功能富集过程,共有132个通路,富集较多的前10个通路(表4)为催化活性、结合、有机环状化合物结合、杂环化合物结合、小分子结合、离子结合、阳离子结合、核苷结合、嘌呤核苷酸结合、核糖核苷酸结合等。
GO细胞组分过程富集的通路最少,共有92条,差异基因富集较多的前10个通路(表5)为细胞、细胞部分、细胞内、细胞内部分、细胞内细胞器、细胞器、细胞内膜结合细胞器、膜细胞器、细胞质部分、细胞质。
差异表达蛋白质的GO注释结果如图7所示,在生物学过程中,代谢过程的差异表达蛋白质较多,显著上调的有23个,显著下调的有69个;细胞过程中的差异表达蛋白质,显著上调的有21个,显著下调的有68个;单有机体过程中显著上调的蛋白质有18个,显著下调的蛋白质有54个;其他条目逐渐减少。在分子功能富集过程中,催化活性条目的差异表达蛋白质最多,显著上调的有17个,显著下调的有57个;结合条目中显著上调的蛋白质有17个,显著下调的蛋白质有53个,其他条目较少。细胞组分中,差异表达蛋白质较多的条目是细胞和细胞部分,显著上调的蛋白质均为27个,显著下调的蛋白质为59个;其次是细胞器条目,显著上调的蛋白质有26个,显著下调的蛋白质为46个,其他条目的蛋白质数量相对较少。
3讨论
高温胁迫会导致植物的膜蛋白变性、膜组分发生变化、产生自由基等,使细胞膜脂过氧化程度加剧、内细胞器或膜结构破坏,影响植物的正常代谢[9-13]。热激蛋白(HSP)是植物受高温胁迫产生的一类温度响应蛋白质,主要以分子伴侣蛋白的形式帮助其他多肽折叠、组装或者转移,它本身不参与蛋白质的形成,能够积累受损蛋白、维护细胞内平衡、降低热害[14]。通过iTRAQ技术对高温胁迫下金线莲叶片的蛋白质进行鉴定分析,共得到326 478张总图谱,其中34 376张可与数据库匹配,特有肽段图谱数量为30 458个,鉴定得到的肽段有9 804个。通过对差异蛋白质的分析,143个蛋白质中有40个上调、103个下调,GGPP编码基因在高温胁迫后显著下调;病程相关蛋白质(PR)、叶绿体的果糖激酶二硫键异构酶、谷胱甘肽S-转移酶等蛋白质的表达量则显著上调,尤其是HSP17.4在高温胁迫后表达量差异显著。
HSP20家族为小分子热激蛋白(sHSPs,相对分子质量为15 000~40 000),在植物生长发育中受到高温胁迫或渗透胁迫时,小分子热激蛋白编码基因会被诱导表达,增强植物对非生物胁迫的抗性,该蛋白质的保守性较低[15]。本研究获得的HSP17.4属于HSP20蛋白质家族,其相对分子质量为17 400,基因的开放阅读框(ORF)长度为453 bp、编码150个氨基酸。Zhou等[16]将莲NnHSP17.5基因转入拟南芥,结果显示该基因的过表达提高了拟南芥种子的萌发活力和幼苗的耐热性;李敏等[17]将月季Rchsp17.8基因转入烟草,显著提高了烟草的耐热性。在高温胁迫过程中大多数小分子热激蛋白参与了保护植物PSⅡ的反应,从而提高了植物抵抗高温胁迫的能力[18-19]。当植物细胞中的活性酶受高温胁迫影响变性而丧失原来的功能时,小分子热激蛋白还可以与其他热激蛋白进行复合来修复已损伤的蛋白质[20]。MsHsp16.9在高温胁迫下表达量的增加与新疆野苹果的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等酶的活性增强一致,同时抑制植株体内MDA含量的升高[21]。转入VvHSP17基因的植株在高温胁迫后MDA含量增幅较小,脯氨酸积累量显著增加,SOD活性同样显著增加 [20]。金线莲HSP17.4基因与同为兰科的铁皮石斛HSP17.3基因和白芨BsHsp17.3基因具有较高的同源性,同时具有抵抗高温胁迫和冷胁迫的功能[15]。金线莲的脯氨酸含量、SOD和CAT活性会随高温胁迫时间的延长而增强,耐热品系MDA含量的增幅小于不耐热品系[22]。HSP17.4可能在金线莲抵御高温胁迫中发挥着重要作用。
生物通过信息交流来控制和调节体内细胞的生长发育、增殖、代谢,且细胞会对生理和非生理的信号产生应答来适应环境。KEGG注释结果显示,高温胁迫对金线莲的碳循环和光合作用有较大的影响。通过KOG注释发现112个功能不明确的蛋白质,可能是还没有被发现的蛋白质;还有223个蛋白质被注释到信号转导机制中。因此,在今后的研究中需要进一步关注这些蛋白质并深入挖掘它们的信息。
参考文献:
[1]梅瑜,邱道寿,肖深根,等. 筛选金线莲种质资源的通用 DNA 条形码序列及鉴定其混伪品[J]. 分子植物育种, 2019, 17(15):5163-5170.
[2]张超,易骏,张若青,等. 金线莲及其混伪品中总黄酮含量的比较研究[J]. 药学实践杂志, 2019(6):495-497.
[3]杨岚,师帅,王红娟,等. 水杨酸对高温胁迫下铁皮石斛幼苗耐热性的影响[J]. 西北植物学报, 2013, 33(3):534-540.
[4]付强,赵杰宏,刘育辰,等. 药用植物蛋白质组学的研究进展[J]. 贵州农业科学, 2018, 46(10):22-25.
[5]刘军铭,赵琪,尹赜鹏,等. 利用蛋白质组学技术揭示的植物高温胁迫响应机制[J]. 应用生态学报, 2015,26(8):328-337.
[6]陈旭,石垒,朱璐,等. 植物HSP70蛋白家族分子进化特征及其表达模式分析[J]. 基因组学与应用生物学, 2017(10):370-382.
[7]刘聪聪,张泽,关雪莲,等. 花楸树热激蛋白70基因的克隆及表达分析[J]. 分子植物育种, 2019, 17(19):6276-6286.
[8]姜福星,赵婕,孙晓兰,等. 白花虎眼万年青QtJMT基因的克隆及其植物表达载体的构建[J]. 分子植物育种, 2019(10):3267-3273.
[9]王涛,黄语燕,陈永快,等. 高温胁迫下外源壳聚糖对黄瓜幼苗生长的影响[J]. 江苏农业科学,2019,47(23):142-146.
[10]顾帆,季梦成,顾翠花,等. 高温干旱胁迫对黄薇抗氧化防御系统的影响[J]. 浙江農林大学学报, 2019, 36(5): 894-901
[11]赵勇竣,徐术菁,王钊,等. 高温胁迫对3个番茄品种生长和生理指标的影响[J]. 江苏农业科学,2019,47(17):147-149.
[12]覃泳智,周智丽,刘海涛,等. 外源水杨酸对高温胁迫微型月季生理指标的影响[J].南方农业学报,2018,49(10):2028-2033.
[13]李艳艳,王俊青,李植良,等. 高温胁迫对不同耐热性茄子叶肉细胞超微结构的影响[J].江苏农业科学,2018,46(18):138-140.
[14]查倩,奚晓军,蒋爱丽,等.高温胁迫对葡萄高温相关基因和蛋白表达的影响[J].中国农业科学,2017,50(9):1674-1683.
[15]江爱明,蔡高磊,曹俊,等.白及小分子热激蛋白BsHsp17.3基因的克隆与表达分析[J].广西植物,2018(9):1191-1198.
[16]ZHOU Y, CHEN H, CHU P, et al. NnHSP17.5, a cytosolic class II small heat shock protein gene from Nelumbo nucifera, contributes to seed germination vigor and seedling thermotolerance in transgenic Arabidopsis[J]. Plant Cell Reports, 2012, 31(2):379-389.
[17]李敏,蒋昌华,胡永红,等. 月季Rchsp17.8基因转化烟草的非生物胁迫耐性研究[J]. 园艺学报, 2009, 36(8):1191-1196.
[18]BIBI A C, OOSTERHUIS D M, GONIAS E D. Photosynthesis, quantum yield of photosystem Ⅱ and membrane leakage as affected by high temperatures in cotton genotypes[J]. Journal of Cotton Science, 2008,12(2):150-159.
[19]HECKATHORN S A, RYAN S L, BAYLIS J A, et al. In vivo evidence from an Agrostis stolonifera selection genotype that chloroplast small heat-shock proteins can protect photosystem Ⅱ during heat stress[J]. Functional Plant Biology, 2002, 29(8):933-944.
[20]张杰,单宝来,田永生,等.葡萄HSP17基因的合成与功能分析[J].江苏农业学报,2017,33(3):503-509.
[21]YANG M, ZHANG Y, ZHANG H,et al. Identification of MsHsp20 gene family in Malus sieversii and functional characterization of MsHsp16.9 in heat tolerance[J]. Frontiers in Plant Science, 2017(8):1761.
[22]MEI Y, QIU D, XIAO S, CHEN D. Evaluation of high temperature tolerance of different Anoectochilus germplasm resources and their physiological responses[J]. Applied Ecology and Environmental Research, 2018, 16(5):7017-7031.
(责任编辑:陈海霞)

