银杏果实(白果)多糖提取工艺优化及其抑菌活性分析
吴海霞 田志芳

摘要:以银杏(Ginkgo biloba L.)果实(白果)为原料,利用响应面分析法优化白果多糖的提取工艺,并分析白果多糖的抑菌活性。以多糖得率为指标,通过单因素试验及响应面分析,探讨液料比、提取温度及提取时间等因素对白果多糖得率的影响,从而建立白果多糖的提取工艺模型,得出其最佳提取工艺条件;结合牛津杯法及二倍稀释法,分析白果多糖的抑菌活性及最小抑菌质量浓度。结果表明,白果多糖的最佳提取工艺条件如下:液料比45 ml∶1 g,95 ℃浸提3.0 h,在该条件下多糖得率为19.67%。抑菌试验结果表明,白果多糖对细菌有一定的抑制活性,对枯草芽孢杆菌(Bacillus subtilis)的抑制活性最强,最小抑菌质量浓度为2.50 mg/ml;白果多糖对大肠杆菌(Escherichia coli)的抑制活性也较强,当白果多糖质量浓度为15.00 mg/ml时,抑菌圈直径约为2.25 cm;白果多糖对真菌几乎无抑制活性,因而不具有广谱抑菌活性。
关键词:银杏果实(白果);多糖;响应面分析;抑菌活性
中图分类号:S792.950.1文献标识码:A文章编号:1000-4440(2020)06-1551-08
Abstract:Ginkgo biloba seed was used as raw material, the conditions of extracting polysaccharides were optimized based on response surface method (RSM), and the antibacterial activity was studied. The yield of polysaccharide was used as the index, single factor tests and RSM were performed to study the effects of liquid-to-solid ratio, extraction temperature and extraction time on polysaccharide yield. The mathematical model of polysaccharides extraction was established, and the optimum extraction conditons were obtained. The antibacterial activity and minimum inhibitory concentration of polysaccharides were analyzed by Oxford cup method and double dilution method. The results showed that the optimum extraction conditons were as follows: liquid-to-solid ratio 45∶1(ml/g), extraction temperature 95 ℃ and extraction time 3.0 h. Under the optimum extraction conditions, the yield of polysaccharide was 19.67%. The results of antibacterial test indicated that polysaccharide from Ginkgo biloba seed showed the strongest antimicrobial activity against Bacillus subtilis, and the minimum inhibitory concentration was 2.50 mg/ml. The polysaccharide from Ginkgo biloba seed also had strong antibacterial activity against Escherichia coli. When the mass concentration of polysaccharide was 15.00 mg/ml, the antibacterial diameter was 2.25 cm. But the polysaccharide has no inhibitory activity against fungi and has no broad-spectrum antimicrobial activity.
Key words:Ginkgo biloba L. fruit(Ginkgo biloba seed);polysaccharide;response surface method;antibacterial activity
银杏(Ginkgo biloba L.)的果实俗称白果,又名鸭脚子、灵眼、佛指柑[1]。随着银杏种植规模的不断扩大,白果的产量也随之增加,民间有“白果有毒”[2-3]的說法,从而使白果的加工利用受到限制,严重影响了银杏产业的发展,因此亟需研究和挖掘具有高新技术含量的白果深加工产品。多糖是一种结构复杂的高分子化合物,具有多种生物活性[4-7],在生物体内起着重要作用。大量研究发现,银杏叶、外种皮中的多糖具有免疫调节[8]、抗肿瘤[8-9]、抗衰老[10-11]等生物活性。也有研究发现,很多植物来源的多糖具有抑菌活性,例如姚以才等[12]研究发现,芦根多糖对酵母菌、金黄色葡萄球菌、枯草芽孢杆菌和黑曲霉均有不同的抑菌活性;Jiang等[13]以金黄色葡萄球菌、枯草芽孢杆菌及大肠杆菌为供试菌,研究了花生水溶性粗多糖的抑菌活性,认为当其质量浓度为12.5 mg/ml时,可以抑制革兰氏阳性菌的生长;蔡铭等[14]、袁海娜[15]、胡国元等[16]、孟俊龙等[17]、万艳娟等[18]、陈灿辉等[19]也分别对黑木耳多糖、仙人掌多糖、金针菇多糖、香菇多糖、南瓜多糖、竹笋多糖等的抑菌活性进行了分析。但是目前有关白果多糖抑菌活性的相关研究仍较少[20-21]。
在前期的研究中,笔者已经对白果蛋白[22]、白果酚酸[3]的抑菌活性进行了探讨。本研究在对白果多糖提取工艺进行优化的基础上,对白果多糖的抑菌活性进行分析,以期为挖掘白果价值、促进白果的应用提供依据。
1材料与方法
1.1材料与试剂
本试验所用白果为大佛指,购自江苏省泰州市集泰农产品有限公司。将白果冷冻、干燥、粉碎后过40目筛,用石油醚脱色、脱脂后得到白果粉,备用。
本试验所用主要试剂石油醚、无水乙醇、丙酮、乙醚、三氯乙酸、硝酸钠、硫酸镁、磷酸氢二钾、硫酸亚铁、氯化钾(分析纯)与高温淀粉酶、糖化酶(化学纯),购自国药集团化学试剂有限公司;牛肉膏、蛋白胨、琼脂粉、虎红琼脂粉等(分析纯),购自上海博微生物科技有限公司。
本试验所用2种细菌[大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)]和3种真菌[戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)、鲁氏毛霉(Mucor rouxianus)、黑根霉(Rhizopus nigricans)]由运城学院食品微生物与发酵实验室提供;另外2种细菌[枯草芽孢杆菌(Bacillus subtilis)、绿脓假单胞菌(Pseudomonas aeruginosa)]和另外3种真菌[产紫青霉(Penicillium purpurogenum)、黑曲霉(Aspergillus niger)、沙门柏干酪青霉(Penicillium camemberti)]由南京林业大学食品科学与工程实验室提供。所有细菌均用牛肉膏蛋白胨琼脂培养基培养,戴尔凯氏有孢圆酵母用虎红琼脂培养基培养,其余真菌均用察氏培养基培养。
1.2主要仪器
R-210旋转蒸发仪,产自瑞士BUCHI;Lambda 35紫外可见分光光度计,产自美国PerkinEimer;2-16k台式高速冷冻离心机,产自德国SIGMA;ALPHA 1-2 LD plus冷冻干燥机,产自德国Christ;HHS-250B恒温恒湿培养箱,产自南京恒裕仪器设备制造有限公司。
1.3试验方法
1.3.1白果多糖的制备(1)白果多糖的浸提流程:脱脂白果粉→95 ℃水浴浸提并加0.1%高温α-淀粉酶酶解约1 h(通过KI定性检测判断原料中的淀粉是否完全水解)→加0.1%糖化酶→95 ℃保温浸提→过滤,取上清液→旋转蒸发→4 000 r/min离心10 min,取上清液→调节pH值为4.62 →静置过夜除蛋白质→4 000 r/min离心10 min,取上清液→用3倍体积的95%乙醇沉淀、过夜→5 000 r/min离心10 min,取沉淀→分别用无水乙醇、无水乙醚、无水丙酮洗涤沉淀→-40 ℃冷冻干燥约48 h→白果粗多糖。
(2)白果多糖精制流程:白果粗多糖复溶于蒸馏水→4 000 r/min离心10 min,取上清液→Sevag法脱蛋白质→透析→旋蒸浓缩→分级醇沉→9 000 r/min离心10 min→收集沉淀(50%~80%醇沉)→无水丙酮、无水乙醚洗涤→风干→冷冻干燥→白果精制多糖,醇沉过程中用的醇为乙醇。其中,Sevag法脱蛋白质的步骤:按1 g∶18 ml的料液比将粗多糖充分复溶于蒸馏水中,4 000 r/min离心10 min后取上清液;将上清液与Sevag试剂(三氯甲烷、正丁醇的体积比为4∶1)按2∶1的体积比混合,充分振荡30 min,进行脱蛋白质处理,3 000 r/min离心2 min,取上清液。重复多次上述脱蛋白质操作,直至中间的蛋白质层消失并且于280 nm紫外检测无明显吸收峰。
分级醇沉的步骤:将复溶脱蛋白质后的多糖溶液蒸发浓缩至原体积的1/5,往其中加入无水乙醇,使其终浓度为50%,静置过夜,9 000 r/min高速离心10 min,取上清液并量体积后,继续加入无水乙醇,使其终浓度为80%,静置过夜后于9 000 r/min高速离心10 min,收集沉淀得50%~80%醇沉级分。
(3)白果多糖得率的计算:白果多糖得率=[粗多糖质量(g)/原料质量(g)]×100%。
(4)精制白果多糖纯度的分析:采用考马斯亮蓝法对步骤(2)中得到的精制白果多糖中的蛋白质含量进行分析测定(回归模型为Y=6.400x+0.009,R2=0.998 0,其中x为牛血清蛋白含量,Y为吸光度),并计算其含量,测定波长为595 nm;采用蒽酮-硫酸法对精制白果多糖中的白果多糖含量进行分析测定(回归模型为Y=0.616x-0.007 3,R2=0.998 5,其中x为白果多糖含量,Y为吸光度),并计算其纯度,测定波长为630 nm。结果表明,该白果多糖中的蛋白质含量为1.03%,白果多糖纯度为92.39%±0.01%。
1.3.2单因素试验分别称取5.0 g脱脂白果粉于500 ml锥形瓶中,以蒸馏水为提取液,設置不同液料比(15 ml∶1 g、25 ml∶1 g、35 ml∶1 g、45 ml∶1 g、55 ml∶1 g)、不同浸提时间(1.0 h、2.0 h、3.0 h、4.0 h、5.0 h)、不同浸提温度(45 ℃、55 ℃、65 ℃、75 ℃、85 ℃、95 ℃)及不同提取次数( 1次、2次、3次),按照方法1.3.1中的白果多糖提取工艺路线对白果多糖进行水浴浸提和乙醇沉淀,冷冻干燥后称质量,考察不同因素对白果多糖得率的影响。
1.3.3响应面优化试验应用Design-Expert 7.0软件,根据Box-Behnken Design(BBD)中心组合试验设计原理,综合单因素试验结果,选取对多糖得率有显著影响的3个因素[液料比(x1)、浸提时间(x2)、浸提温度(x3)]为自变量,采用响应面分析法设计3因素3水平试验方案,以多糖得率为指标,对多糖提取工艺条件进行优化。试验因素与水平的设置见表1。根据试验所得数据进行回归拟合,建立回归模型。
1.3.4抑菌活性研究(1)菌悬液的制备。采用牛肉膏蛋白胨固体培养基平板进行细菌接种,于37 ℃进行培养活化;细菌菌悬液的制备采用麦氏比浊法,调节OD540为0.15,制备活菌量约为108CFU/ml的细菌菌悬液,备用。取灭菌竹签,在各真菌平板上挑取真菌孢子或菌丝于装有10 ml无菌水的离心管中,涡旋振荡混匀,得真菌菌悬液,备用。
(2)抑菌活性及最小抑菌质量浓度(MIC)的分析。用牛津杯法进行抑菌活性试验,用2倍稀释法分析最小抑菌质量浓度。制备带菌平板并按正三角形排列放置牛津杯,将各0.2 ml不同质量浓度梯度的多糖溶液加入牛津杯中,以同体积的无菌水作空白对照。于(4±1) ℃冰箱中进行4 h扩散处理后,将细菌于37 ℃培养24 h,将真菌于28 ℃培养72 h,观察各培养皿中菌落的生长情况并用十字交叉法记录抑菌圈直径,以几乎无菌生长(抑菌圈直径≥3.3 cm)的最低多糖溶液质量浓度作为MIC[23]。每组试验重复3次。
2结果与分析
2.1单因素试验结果分析
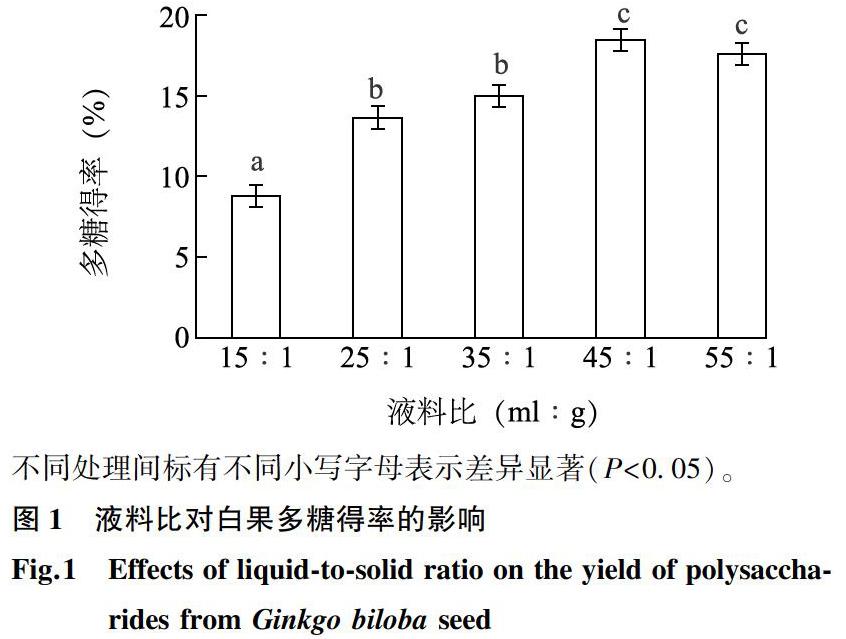
2.1.1液料比对白果多糖得率的影響液料比是影响物质溶出的关键因素之一,在活性成分的浸提过程中,适当增加溶剂用量,可有效增加物质的溶出量。将白果粉分别以15 ml∶1 g、25 ml∶1 g、35 ml∶1 g、45 ml∶1 g和55 ml∶1 g的液料比与蒸馏水混合搅匀后,于90 ℃水浴浸提5.0 h。如图1所示,多糖得率随液料比的增大而提高,当液料比为45 ml∶1 g时,多糖得率最高,为18.48%,显著高于液料比为35 ml∶1 g时的多糖得率(P<0.05);随着液料比继续增加,多糖得率的变化不显著,说明此时物质扩散已达平衡状态,继续增加液料比对提高多糖得率的影响不大,并且溶剂用量的增大会极大增加后期的浓缩负荷及乙醇沉淀成本。综上,选择45 ml∶1 g的液料比进行后续试验。
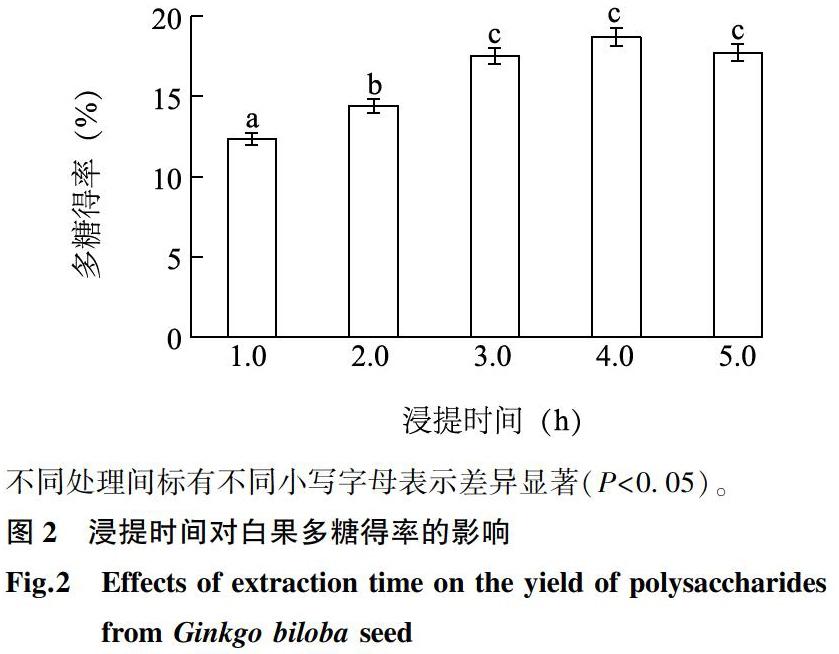
2.1.2浸提时间对白果多糖得率的影响浸提过程主要通过原料颗粒与浸提液的充分接触而实现目标物质的溶出。在一定的提取条件下,浸提时间的长短对目标物质是否能够充分溶出有重要影响。从图2可以看出,当浸提时间为1.0~3.0 h时,随着浸提时间的延长,多糖得率从12.34%提高至18.52%,并且各处理间的多糖得率差异显著(P<0.05);进一步延长浸提时间至4.0~5.0 h后,多糖得率的变化趋于平缓,可见更长浸提时间对多糖得率的影响不显著。适宜的浸提时间有利于原料颗粒细胞的细胞膜破裂,从而促进多糖溶出,提高多糖得率,但是当物质溶出达到平衡后,浸提时间的继续延长反而会增加能耗,降低效率,并且增加了杂质溶出的机会。综上,选择3.0 h的浸提时间进行后续试验。
2.1.3浸提温度对白果多糖得率的影响在一般情况下,目标化合物在溶剂中的溶解度随着温度的升高而提高。研究发现,较高的温度能极大地减弱由范德华力、氢键等引起的溶质与基质之间的相互作用力,加速溶质分子的解析,从而使溶质从基质中快速溶出。从图3可以看出,多糖得率随着浸提温度的升高而不断提高,在45~85 ℃温度范围内,随着浸提温度的升高,多糖得率先显著提高(P<0.05),之后趋于平缓,当浸提温度由85 ℃提高至95 ℃时,多糖得率的变化不显著。主要是由于温度的升高可以加速多糖类物质的渗透、扩散等,使其更容易被提取出来,但是温度过高容易对多糖的结构和性能产生影响。综上,本试验选择85 ℃的浸提温度进行后续白果多糖的浸提试验。
2.1.4浸提次数对白果多糖得率的影响为了使原料得到充分利用,白果粉用蒸馏水浸提1次后,过滤浸提液,取上清液,然后将沉淀按照方法1.3.1的浸提工艺路线依次进行2次、3次、4次浸提。如图4所示,浸提1次后,白果粉的多糖得率为18.41%,重复浸提1次(浸提2次)后累计多糖得率为21.27%,较浸提1次的多糖得率显著提高(P<0.05),但浸提3次、4次后的累计多糖得率分别为21.51%、21.71%,与浸提2次的结果无显著差异。由此可见,从提高效率、经济节约的角度考虑,选择浸提2次为宜。
2.2响应面优化浸提工艺试验结果分析
2.2.1回归模型的建立及方差分析根据响应面试验结果(表2),用Design Expert软件对多糖得率进行回归拟合,建立如下回归模型:Y=19.21+0.36x1+0.53x2+2.76x3-0.64x1x2-0.83x1x3-1.70x21-2.07x22-1.39x23,式中,Y为多糖得率,x1、x2、x3分别为液料比、浸提时间、浸提温度。
方差分析和显著性检验结果(表3)表明,回归模型自变量中的一次项x2、x3,交互项x1x3及二次项x21、x22、x23 这6项均为极显著项,一次项x1、交互项x1x2 项为显著项,表明液料比、浸提时间、浸提温度均对多糖得率有显著或极显著影响。由表3还可以看出,失拟F值为0.97,说明使用该模型进行拟合的效果很好;失拟项的P>0.050 0,表明使用该模型时其他因素对试验结果的干扰较小;多糖得率回归模型的P<0. 000 1,表明该回归模型能很好地预测白果多糖的提取情况。
2.2.2不同因素交互对白果多糖得率的影响由表3可知,多糖得率回归模型中的交互项x1x2(液料比与浸提时间的交互)作用影响显著,x1x3(液料比与浸提温度的交互)作用影响极显著,因而对其进行交互作用响应面分析。
2.2.2.1液料比与浸提时间交互的影响由图5可以看出,当浸提温度在0水平(85 ℃)、液料比为35 ml∶1 g~40 ml∶1 g时,随着浸提时间的延长,多糖得率先缓慢升高后略微降低;当液料比为40 ml∶1 g~55 ml∶1 g时,随着浸提时间的延长,多糖得率呈现明显的先升后降的趋势;当浸提时间为2.0 h时,随着液料比的不断增大,多糖得率呈现先缓慢升高后缓慢降低的趋势,当浸提时间延长至3.0 h时,多糖得率随着液料比的增大呈现显著的先升后降的趋势。当多糖得率较高时,液料比及浸提时间均在0水平附近。
2.2.2.2液料比与浸提温度交互的影响由图6可以看出,当浸提时间为0水平(3.0 h)、液料比为35 ml∶1 g~55 ml∶1 g时,随着浸提温度的升高,多糖得率显著提高;当浸提温度为75~95 ℃,液料比的变化对多糖得率的影响不明显,当浸提温度较低时,随着液料比增大,多糖得率先升高后略有降低,当浸提温度较高时,多糖得率较高。
2.2.3响应面优化及验证试验运用Design-Expert 7. 0软件,在设置多糖得率为极大值的条件下,得到多糖浸提的最优理论条件如下:液料比43.31 ml∶1 g,浸提时间3. 15 h,浸提温度95 ℃,在此条件下的多糖得率预测值为20.66%。结合实际情况,对最优理论浸提条件进行调整,得到最佳浸提条件如下:液料比45 ml∶1 g,浸提时间3.0 h,浸提温度95 ℃,在此条件下经3次试验验证得出,多糖得率为19.67%±0.39%,与预测值(20.66%)间的误差较小,且每组试验结果均处于95%可信度区间(19.61%~21.70%),表明所得回归模型可以较好地擬合白果多糖的浸提情况。
2.3抑菌活性分析
如表4所示,白果多糖对枯草芽孢杆菌(B.subtilis)的抑制活性最强,当白果多糖质量浓度为0.15 mg/ml时,其抑菌圈直径即达(1.95±0.12) cm;随着白果多糖质量浓度的不断增加,其抑菌圈直径显著增大(P<0.05),最小抑菌质量浓度为2.50 mg/ml。白果多糖对大肠杆菌(E.coli)的抑制活性也较强,当白果多糖质量浓度为5.00 mg/ml时,抑菌圈直径为2.25 cm。此外,白果多糖对绿脓假单胞菌(P.aeruginosa)、金黄色葡萄球菌(S.aureus)也有一定的抑制作用,当白果多糖质量浓度为10.00 mg/ml时,抑菌圈直径均约为1.60 cm。本试验同时测定白果多糖对戴尔凯氏有孢圆酵母(T.delbrueckii)、鲁氏毛霉(M.rouxianus)、黑根霉(R.nigricans)、产紫青霉(P.purpurogenum)、黑曲霉(A.niger)、沙门柏干酪青霉(P.camemberti)6种真菌的抑制活性,发现白果多糖对这6种真菌均没有表现出明显的抑制活性。因此认为,白果多糖不具有广谱抑菌活性。
3结论
采用响应面分析法对白果多糖的浸提工艺进行优化并建立白果多糖浸提的回归模型。结果表明,液料比、浸提时间及浸提温度对白果多糖得率有显著或极显著影响。结合回归模型及实际情况得到白果多糖提取的最优条件如下:液料比45 ml∶1 g,浸提时间3.0 h,浸提温度95 ℃,在此条件下白果多糖得率为19.67%±0.39%,与预测值的误差较小。
抑菌试验结果表明,白果多糖具有较强的抑菌活性,对革兰氏阳性细菌(金黄色葡萄球菌、枯草芽孢杆菌)、革兰氏阴性细菌(大肠杆菌、绿脓假单胞菌)均有抑制活性,其中对枯草芽孢杆菌的抑制活性较强,最小抑菌质量浓度为2.50 mg/ml,对大肠杆菌也有较强的抑制活性,当白果多糖质量浓度为10.00 mg/ml时,抑菌圈直径约为2.61 cm,在相同质量浓度(10.00 mg/ml)条件下,白果多糖对绿脓假单胞菌、金黄色葡萄球菌的抑菌圈直径为1.50~1.60 cm。此外,由于白果多糖对真菌几乎无抑制活性,因此不具有广谱抑菌活性。
参考文献:
[1]曹福亮. 中国银杏志[M]. 北京: 中国林业出版社, 2007.
[2]杨剑婷,吴彩娥. 白果致过敏成分及其致敏机理研究进展[J]. 食品科技, 2009, 34(6): 282-286.
[3]吴海霞,吴彩娥,刘金达,等. 银杏种仁酚酸的纯化、鉴定及其抑菌活性分析[J]. 中国食品学报, 2015, 15(3): 207-215.
[4]NAKAMURA A, TAKAHASHI T, YOSHIDA R, et al. Emulsifying properties of soybean soluble polysaccharide[J]. Food Hydrocolloids, 2004, 18(5): 795-803.
[5]YE C L, HUANG Q. Extraction of polysaccharides from herbal Scutellaria barbata D. Don (Ban-Zhi-Lian) and their antioxidant activity[J]. Carbohydrate Polymers, 2012, 89(4): 1131-1137.
[6]TIAN Y T, ZENG H L, XU Z B, et al. Ultrasonic-assisted extraction and antioxidant activity of polysaccharides recovered from white button mushroom (Agaricus bisporus)[J]. Carbohydrate Polymers, 2012, 88(2): 522-529.
[7]ZENG W C, ZHANG Z, GAO H, et al. Characterization of antioxidant polysaccharides from Auricularia auricular using microwave-assisted extraction[J]. Carbohydrate Polymers, 2012, 89(2): 694-700.
[8]陈群,刘天骄. 银杏叶多糖的抗肿瘤和免疫调节作用[J].中药药理与临床, 2003, 19(5): 18-19.
[9]许爱华,陈华圣,孙步蟾,等. 银杏外种皮多糖对人胃癌细胞凋亡及其凋亡誘导基因表达的影响[J].中药药理与临床, 2003, 19(3): 11-13.
[10]费文勇,彭爱军,王爱萍,等. 银杏外种皮多糖拮抗D-半乳糖致小鼠衰老作用的实验研究[J].辽宁中医学院学报,2004,6(1): 56-57.
[11]靳菊情,丁东宁,边晓丽,等. 银杏叶多糖的化学及清除羟自由基作用[J].西安医科大学学报, 2000,21(5): 417-419.
[12]姚以才,耿中华,王乃馨,等. 芦根多糖的超声辅助提取及其抗菌活性[J]. 食品科学, 2011, 32(14): 147-151.
[13]JIANG S J, MA Y H, YAN D Z. Antioxidant and antimicrobial properties of water soluble polysaccharide from Arachis hypogaea seeds[J]. Journal of Food Science & Technology. doi: 10.1007/s13197-012-0786-9.
[14]蔡铭,罗印龙,孙培龙. 黑木耳多糖的抑菌活性与单糖组分分析[J]. 浙江工业大学学报, 2014, 42(5): 533-538.
[15]袁海娜. 仙人掌及其多糖对几种食品污染菌的抑菌作用[J].食品研究与开发, 2012, 33(8): 10-13.
[16]胡国元,李超影,陈默,等.香菇多糖和金针菇多糖的提取及其抑菌活性[J].武汉工程大学学报, 2013, 35(6): 30-34.
[17]孟俊龙,冯翠萍,常明昌,等. 香菇多糖抑菌作用的研究[J].山西农业大学学报(自然科学版),2012, 32(3): 261-264.
[18]万艳娟,刘晓娟,赵力超,等. 南瓜多糖抑制α-淀粉酶及抑菌活性的研究[J]. 食品科技, 2012, 37(3): 44-47.
[19]陈灿辉,江文韬,林彤,等. 竹笋多糖的提取、结构鉴定与生理功效研究进展[J].江苏农业学报,2019,35(6):1513-1520.
[20]CHEN Q, YANG G W, AN L G. Apoptosis of hepatoma cells SMMC-7721 induced by Ginkgo biloba seed polysaccharide[J]. World Journal Gastroenterol, 2002, 8(5): 832-836.
[21]郑敏燕,耿薇,魏永生,等. 萘酚-硫酸显色光度法测定白果多糖含量方法的研究[J].应用化工,2010,39(3): 447-449,452.
[22]吴海霞,吴彩娥,范龚健,等. 银杏种仁蛋白分离纯化及其抑菌活性[J].食品科学, 2014, 35(13): 108-113.
[23]PIERRE G, SOPENA V, JUIN C, et al. Antibacterial activity of a sulfated galactan extracted from the marine alga Chaetomorpha aerea against Staphylococcus aureus[J]. Biotechnology and Bioprocess Engineering, 2011, 16(5): 937-945.
(责任编辑:徐艳)

