玉米大斑病菌StTOXE蛋白的原核表达及分析
张运峰
(唐山师范学院生命科学系,河北 唐山 063000)
【研究意义】植物病原真菌中TOXE蛋白作为转录因子在真菌寄主选择性毒素的合成方面具有重要的作用,通过建立玉米大斑病菌StTOXE蛋白原核表达体系,为进一步开展StTOXE蛋白抗体制备、结构解析和StTOXE蛋白功能研究奠定基础。【前人研究进展】玉米大斑病(Setosphaeriaturcica)是玉米上的重要叶部病害之一,在世界各地的玉米产区均有发生,流行的年份会造成高达50 %的玉米减产[1-3]。近年来,关于玉米大斑病菌的研究主要集中于对病原菌的Ras[4]、MAPK[1,5]、cAMP及Ca2+途径等信号转导途径的结构及功能分析,尤其以对MAPK信号途径的研究最为深入[6]。由于不同的信号转导途径之间存在着广泛的交互调控(Cross Talk)[7],造成一个信号途径产生变化时,其它信号途径会产生补充效应。因此,利用这些基因作为靶位点防治玉米大斑病菌的技术面临很大的挑战。在中国玉米产区发现了超过15个玉米大斑病菌致病小种,包括0、1、3、N、12、13、1N、23、2N、3N、123、12N、13N、23N和123N[8]。玉米大斑病菌是否能够对寄主玉米产生侵染并形成病害,主要取决于玉米Ht基因的类型[9]。例如:1号小种会使基因型为Ht1的玉米品种感病,而对于Ht2和Ht3、HtN等基因型的玉米植株不能形成侵染。许多植物病原真菌都是通过分泌真菌毒素侵染寄主植物并使植物产生病理反应[10],真菌毒素分为两类,一类为非寄主选择性毒素,具有广泛的寄主侵染活性,一类为寄主选择性毒素(Host-Selective Toxins,HSTs),它是由病原真菌分泌的一类低分子量次级代谢产物[11],这一类毒素仅会对特异基因型的植物产生病理反应,决定了病原真菌的寄主范围和致病性[12]。Ahn Joong-Hoon等[10]首先在玉米圆斑病菌(Cochlioboluscarbonum)研究了HSTs毒素合成的机制,后相继在Alternariajesenskae[13]、Burkholderiaglumae[14]等少数真菌中开展研究。研究发现HSTs合成需要Tox2基因簇,并发现基因簇中的ToxE基因起着重要作用,TOXE蛋白作为一种转录因子调控Tox2基因簇多个基因的协同表达,进而调控毒素的合成,ToxE基因突变以后,突变体的致病力会丧失[12]。目前,HSTs合成的机制在其它植物病原真菌中报道还较少。【本研究切入点】玉米大斑病菌侵染玉米过程中存在明显的小种专化现象,推测玉米大斑病菌病菌也具有玉米圆斑病菌类似的寄主选择性毒素合成机制,因此,开展玉米大斑病菌中StToxE基因和其蛋白的研究对证明和研究玉米大斑病菌寄主选择性毒素合成机制具有重要作用。【拟解决的关键问题】本研究将克隆StToxE基因,构建StTOXE融合蛋白原核表达载体,并确定StTOXE融合蛋白最优表达条件及其可溶性特征。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 原核表达载体pET-28a(+)由河北农业大学真菌毒素实验室惠赠。玉米大斑病菌野生型Wt01-23和大肠杆菌菌株BL21(DE3)由本实验室构建和保存。
1.1.2 试剂 磁珠法 DNA 胶回收试剂盒、SanPrep 柱式质粒 DNA 小量抽提试剂盒、ECL化学发光检测试剂盒和异丙基-β-D-硫代半乳糖苷(ITPG)等试剂均购自生工(上海)生物工程有限公司;TaqTMDNA 聚合酶、EcoR I和Hind III购自宝日医生物技术(北京)有限公司;细菌蛋白提取试剂盒、Western Blot Marker(PR1800)和Pfu DNA Polymerase购自北京索莱宝科技有限公司。Anti-His Tag Antibody (Monoclonal, 9C11)一抗和Goat Anti-Mouse IgG(H+L)Secondary Antibody(HRP Conjugate)二抗均购自博士德生物工程有限公司(Boster Biological Technology co.ltd)。氯化钠、蛋白胨和酵母提取物等试剂均为国产分析纯试剂。
1.2 方法
1.2.1StToxE基因的克隆和凝胶回收 参照张运峰[15]的方法提取玉米大斑病菌Wt01-23的RNA,反转成cDNA。以StToxE-F(5’-GCGAATTCATGGCCGATGTCAACGAG-3’)和StToxE-R(5’-GCAA GCTTGGGCACAGCCTAGATTTACATTC-3’)特异引物进行高保真PCR扩增。 PCR扩增体系为:Pfu DNA Polymerase 1.0 μl,10×Pfu buffer 2.5 μl,上下游引物各0.5 μl,cDNA 0.25 μl, 双蒸水(ddH2O)补足至25 μl。PCR反应程序为:95 ℃预变性5 min;94 ℃变性10 s,55 ℃退火30 s, 72 ℃延伸3 min,30个循环;最后72 ℃延伸10 min。经1 %琼脂糖凝胶电泳检测,用磁珠法 DNA 胶回收试剂盒回收PCR产物。
1.2.2 玉米大斑病菌StToxE基因表达载体的构建和鉴定 将1.2.1回收获得的PCR产物与载体pET28a(+)质粒分别用限制性内切酶HindIII和EcoR I进行37 ℃酶切过夜反应,用DNA回收试剂盒回收目的基因及载体片段,随后将载体和PCR产物按1∶5进行连接反应后,将连接产物转化DH5α感受态细胞,用StToxE基因特异引物进行筛选阳性克隆菌落。使用SanPrep 柱式质粒 DNA 小量抽提试剂盒提取重组质粒,并进行双酶切鉴定,最后将验证正确的质粒交生工(上海)生物工程股份有限公司测序。
1.2.3 ITPG最适诱导浓度摸索 将含有pET28a-StToxE质粒的BL21(DE3)菌株在LB培养基上划线培养,挑取单菌落接入3 mL LB液体培养基中震荡培养过夜,按照1∶100将菌液接种入50 mL LB液体培养基中37 ℃,200 r/min振荡培养,待OD600≈0.8时,加入终浓度为0、0.2、0.4、0.6、0.8、1.0 mmol/L的IPTG,继续振荡培养4 h,离心收集菌体沉淀。
1.2.4 StTOXE蛋白的SDS-PAGE和Western Blot检测 参考宋杨等[16]将收集菌体沉淀并用PBS(磷酸缓冲液pH7.4)悬浮,加入2×聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液,100 ℃煮沸10 min,冰浴5 min后4 ℃、12 000 r/min 离心10 min。使用12 %的SDS-PAGE凝胶对上清液进行电泳,考马斯亮蓝染色检测蛋白表达。
将目的上清液进行SDS-PAGE电泳后,将蛋白转移到PVDF膜上,然后进行Anti-His Tag Antibody (Monoclonal, 9C11)一抗孵育1.5 h,TBST洗涤5次,再进行Goat Anti-Mouse IgG(H+L) Secondary Antibody(HRP Conjugate)孵育1.5 h,经TBST洗膜后用ECL显色,最后置于化学发光成像仪(上海嘉鹏科技有限公司,ZF-670)中检测;另外,利用Image J软件对不同ITPG浓度条件下StTOXE融合蛋白的Western blot检测结果进行灰度分析,定量分析蛋白表达量的差异。
1.2.5 StTOXE蛋白的可溶性分析 将经过诱导培养的菌液12 000 r/min离心2 min,用PBS(pH 8.0)缓冲液洗涤2次后,沉淀用1 mL PBS缓冲液重悬。细胞超声破碎仪功率为200 W,超声3 s,冷却5 s进行循环破碎40 min。裂解完成后4 ℃、10 000 r/min离心10 min,分别收集破碎后的上清和沉淀,SDS-PAGE电泳和Western Blot检测分析重组蛋白的可溶性。
2 结果与分析
2.1 pET28a-StToxE原核表达载体的构建及其鉴定
以玉米大斑病菌的cDNA为模板、StToxE的特异引物进行PCR扩增,在1500 bp的位置扩增出一条的清晰、明亮、单一的条带,与1470 bp理论值 的相同(图1-A)。将StToxE基因与pET28a载体的连接产物转化DH5α并获得转化子,以DH5α、DH5α-pET28a和DH5α-pET28a-StToxE菌体为模板进行的PCR筛选,在随机挑取的菌落中均扩增出了1470 bp的条带,而对照组DH5α、DH5α-pET28a均没有扩增出条带(图1-B),证明随机挑选的转化菌落均为DH5α-pET28a-StToxE转化子。提取DH5α-pET28a-StToxE转化子质粒后,HindIII和EcoR I双酶切鉴定,发现5400和1470 bp的2个条带,分别与载体pET28a和StToxE基因大小相同。经过华大基因测序,碱基序列正确。

1~4:StToxE基因的扩增结果;5~11:DH5α-pET28a-StToxE;12:pET28a-StToxE重组质粒Hind III和EcoR I双酶切;M:DL2000;M1:1Kb Marker
2.2 pET28-StToxE表达载体的诱导表达及Western Blot检测
通过高温煮沸裂解细菌菌体获得的上清液进行SDS-PAGE电泳和考马斯亮蓝染色,发现条带数目没有明显差异,但在72 kD区域条带存在明显加粗(图2-A),初步确定StTOXE蛋白已经表达。由于表达蛋白携带His标签,我们利用Western Blot试验进一步检测了StTOXE融合蛋白,结果发现BL21-pET28a上清液中未检测到任何条带,而BL21-pET28a-StToxE转化子中检测到72 kD的条带(图2B)。综合考马斯亮蓝染色和Western Blot试验结果进一步确定StTOXE蛋白在BL21细胞中表达,且StTOXE蛋白约为72 kD。
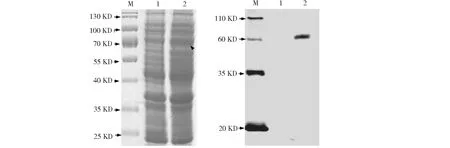
1:BL21-pET28a表达蛋白; 2: BL21-pET28a-StToxE表达蛋白
2.3 不同浓度ITPG对StTOXE融合蛋白表达的影响
BL23-pET28-StToxE转化子在不同浓度ITPG诱导4 h后,Western Blot检测结果发现随着ITPG浓度的增加蛋白表达量逐渐增加,ITPG浓度在0.2 mmol/L时有明显的条带形成,0.4~0.6 mmol/L时达到最大;随后杂交条带逐渐变浅,表明融合蛋白表达量逐渐减少(图3);灰度分析显示:以0.2 mmol/L为对照,ITPG浓度达到0.4和0.6 mmol/L时显著高于对照,表明蛋白表达量较高,而其它ITPG浓度条件下蛋白表达量均降低,ITPG浓度达到0.1 mmol/L,蛋白表达量显著低于对照组(图4)。
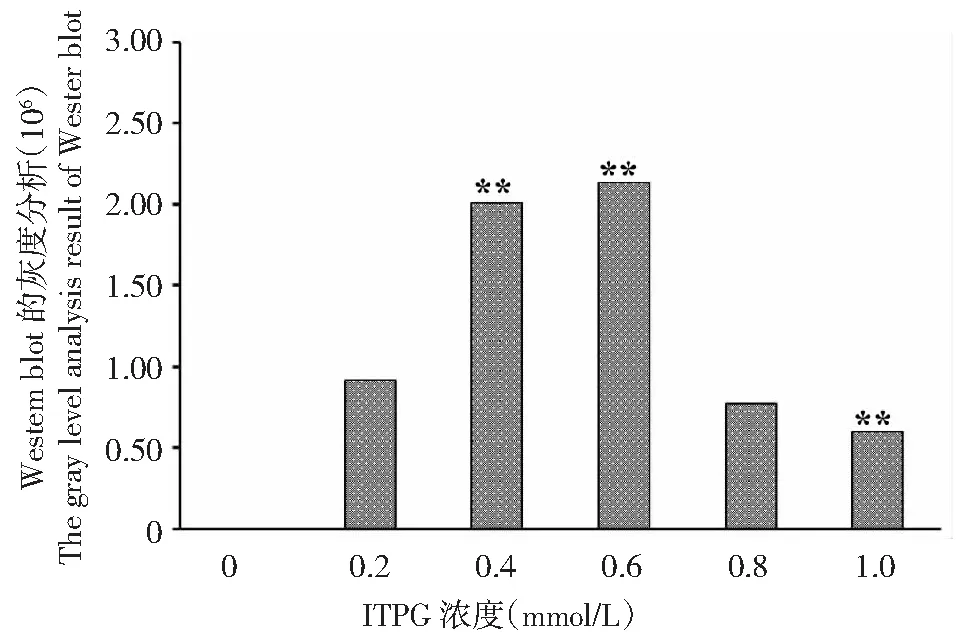
图4 StTOXE融合蛋白Western blot的灰度分析结果Fig.4 Gray analysis results of StTOXE fusion protein Western blot
2.4 StTOXE表达蛋白的可溶性检测
离心收集诱导表达后的含有pET28a-StToxE表达质粒的大肠杆菌BL21 (DE3),取上清及沉淀分别进行SDS-PAGE和考马斯亮蓝染色、Western blot检测,结果显示沉淀中在72 kD发现一条清晰条带,在上清中没有出现同等大小的条带(图3-A);Western blot结果也仅在72 kD位置检测到一条清晰的条带,而上清中为检测出StTOXE蛋白(图3-B)。因此,StTOXE融合蛋白仅存在于沉淀中,在上清中无明显表达,表明重组蛋白以包涵体的形式存在,且重组蛋白单体为可溶性蛋白(图5)。
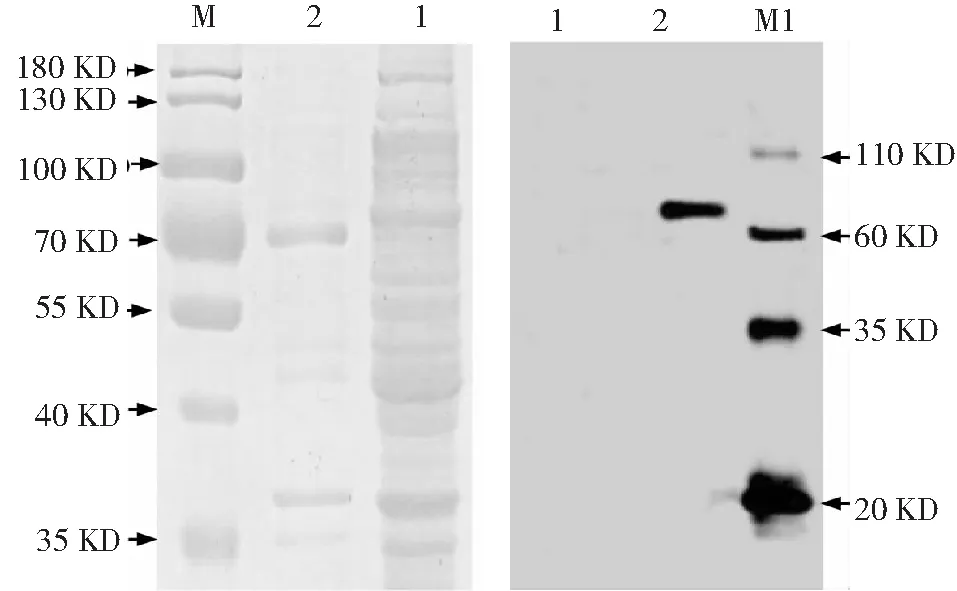
1:裂解上清;2:裂解沉淀;M:PageRulerTM prestained protein lader;M1:Western blot marker(PR1800)
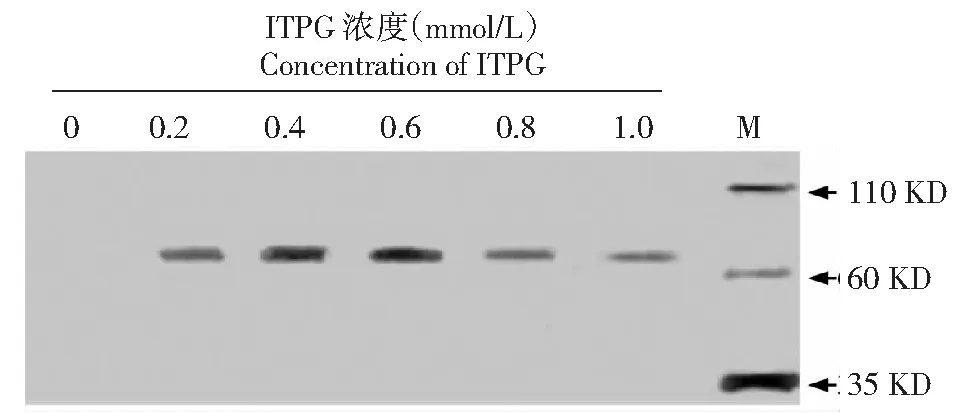
图3 不同ITPG浓度条件下StTOXE融合蛋白的Western blot检测(M:Western blot marker)Fig.3 Western blot detection of StTOXE fusion protein under different concentrations of ITPG
3 讨 论
毒素是植物病原真菌重要的致病因子,也是植物病原真菌的研究热点。董金皋等[17]的研究发现玉米大斑病菌可以产生致病毒素,且该毒素具有寄主专化性活性;张利辉等[18]在研究玉米大斑病菌2号小种毒素成份时指出玉米大斑病毒素中含有寄主选择性毒素组份。本研究从玉米大斑病菌野生型菌种Wt01-23中克隆获得了StToxE基因,构建了原核表达载体pET28a-StToxE,并在大肠杆菌BL21 (DE3)中进行了原核表达,通过分别收集破碎细胞的上清和沉淀,分析了表达蛋白的形式和可溶性。
由于构建的pET-28a (+)载体的StToxE无终止子,且StTOXE融合蛋白在N端和C端分别各含有1个His-Tag,在N端还有1个T7-Tag,结合前期利用生物信息学工具分析StToxE融合蛋白获得数据(数据另行发表)理论分子量约为55 kD。通过对诱导表达蛋白SDS-PAGE和Western blot检测结果显示StTOXE融合蛋白的大小约为72 kD,比理论值大30.9 %。在前人研究结果中显示表达蛋白分子量与预测值存在差异的情况并不少见[19-22],甚至有文献报道SDS-PAGE检测结果超过预测值的70 %~100 %[23-24],这个结果产生的原因His是碱性氨基酸带有正电荷,而6个His的标签所带的正电荷就更多,从而降低了泳动速率,导致表观分子质量变大;另外,具有结合DNA的活性的蛋白,也会进一步增加蛋白的分子质量[24],从而导致电泳结果和预测值有较大差异。
实验结果发现在低浓度时StTOXE外源蛋白的表达量随IPTG 浓度增加而逐渐升高,在IPTG 浓度为0.4~0.6 mmol/L时达到最大值,此后随着IPTG 浓度的增加表达量反而下降,可能是因为高浓度的IPTG 会对细菌菌体的生长造成毒害作用,同时为了节约研究成本,选择0.5 mmol/L为最适诱导浓度。另外,在37 ℃条件下,StTOXE融合蛋白全部以包涵体形式存在于宿主菌中。包涵体的形成是外源蛋白高效表达时的普遍现象[25],较高的温度可以提高翻译起始效率,增加蛋白表达量[26],但是外源蛋白表达过快时往往造成蛋白不能自发折叠卷曲生成有一定空间结构的蛋白质,从而形成包涵体,影响蛋白活性。减少包涵体的形成比率可以通过优化培养基、降低诱导温度[27-28]、使用增溶标签[29]、使用突变菌株[30]等方法,其中,降低诱导温度是常用的增强蛋白可溶性[31]的有效方法,后期试验中可开展通过降低诱导温度增加StTOXE融合蛋白溶解性的研究。
4 结 论
本研究通过RT-PCR克隆了玉米大斑病菌StToxE基因;将StToxE基因插入PET28原核表达载体中成功构建了StTOXE融合蛋白表达载体pET28a-StToxE,并将表达载体转化BL21菌株中获得BL21-pET28a-StToxE转化子;通过ITPG诱导、Western Blot检测确认了StTOXE融合蛋白在BL21菌株中表达,并发现ITPG浓度为0.4~0.6 mmol/L时融合蛋白表达效率最高;当诱导温度为37 ℃时StTOXE融合蛋白基本以包涵体形式存在细胞内,且融合蛋白单体为可溶性蛋白。

