胡桃醌对大鼠血清中与脑组织损伤相关生物标志物的影响
董文婷 霍金海 孙国东 王伟明

中图分类号 R965
文献标志码A
文章编号 1001-0408( 2020)03-0298-05
DOI 10.6039/j.issn.1001-0408.2020.03.09
摘要 目的:考察胡桃醌对大鼠脑组织的影响及其与脑组织损伤相关生物标志物的关系。方法:将40只大鼠分为空白组和胡桃醌高、中、低剂量组(34.832、17.416、8.708mg/kg),每组10只,每天灌胃给药1次,连续给药4周。末次给药后,考察各组大鼠的一般行为学、脑指数及脑组织病理形态。采用超高效液相色谱一多反应检测质谱(UPLC-MRM-MS)法检测各组大鼠血清中左旋多巴(L-Dopa)、L-酪氨酸(L-Tyr)、L-色氨酸(L-Trp)的含量。色谱条件为色谱柱Waters Acquity UPLC BEHC18,流动相为乙酸铵水溶液-乙腈,梯度洗脱,流速为0.3mL/min,选样量为5μL,柱温为30 ℃;质谱条件为电喷雾离子源,正离子模式下检测,毛细管电压为3500V,去溶剂气流量为650L/h,去溶剂化温度为350℃,离子源温度为110℃。结果:与空白组比较,胡桃醌各剂量组大鼠出现倦怠、四肢无力的行为;脑组织可见大、小脑皮质内血管充血,锥体细胞层部分神经元固缩,核深染,形态不规则,边界不清晰等病理性改变;胡桃醌高剂量组脑指数显著增加(P<0.05)。建立的UPLC-MRM-MS法专属性良好,L-Dopa、L-Tyr、L-Trp的检测质量浓度线性范围分别为31.25~32000、31.25~32000、15.625~16000ng/mL(r=0.9991~0.9999),检测限分别为6.250、5.625、3.125ng/mL,定量限分别为15.625、18.75、10.00ng/mL,精密度、准确度、稳定性(24h)试验RSD均小于2.6% (n=6),基质效应为95.1%~100.1%(RSD均未超过3.25%,n=3)。动物实验结果显示,与空白组比较,胡桃醌中、高剂量组L-Dopa含量显著升高(P<0.01);胡桃醌低、中、高剂量组L-Tyr含量显著升高,L-Trp含量显著降低(P<0.05或P
关键词 胡桃醌;脑组织;生物标志物;超高效液相色谱一多反应检测质谱法;含量测定
胡桃楸(Juglans mandshurica)作为一种具有潜在药用价值的中药,在我国民间可用于治疗肿瘤和减轻肿瘤引起的疼痛,在临床上也有诸多应用[1-2]。胡桃醌是胡桃楸中重要的活性成分,又名5-羟基-1,4一萘醌[3-4]。近年来关于胡桃醌体外抗肿瘤的研究越来越多,研究发现,胡桃醌具有抗胃癌、肝癌及肺癌等多种肿瘤的活性,但是由于其具有一定的毒性,且难溶于水,使得其安全性和疗效受到影响[5-6]。
本课题组前期基于非靶向代谢组学研究,发现胡桃醌可明显升高正常大鼠血清中左旋多巴(L-Dopa)、L-酪氨酸(L-Tyr)水平,同时降低L-色氨酸(L-Trp)水平,且这3种生物标志物与脑组织正常生理功能密切相关[7-9]。基于此,笔者首先研究胡桃醌作用于大鼠后,其脑指数、脑组织病理切片的变化;然后利用超高效液相色谱一多反应检测质谱(UPLC-MRM-MS)法,对上述3种生物标志物进行定量分析,明确胡桃醌对3种生物标志物的影响,从生物标志物层面判断胡桃醌的脑毒性,为其开发为抗肿瘤新药的安全性评价奠定基础。
l 材料
1.1 仪器
ACQUITY型液相色谱系统、XEVO TSQ型三重串联四级杆MS仪,配有电喷雾(ESI)离子源以及Masslynx数据处理软件(美国Waters公司);DW-86L959型超低温冰箱(青岛海尔集团有限公司);BSA224S-CW型分析天平(赛多利斯科学仪器北京有限公司);ST16R型低温高速离心机(美国赛默飞公司);KD-BM型生物组织包埋机(金华科迪仪器设备有限公司);RM2235型生物组织切片机(德国Lecia公司);DP72型倒置显微镜(日本Olympus公司)。
1.2 试剂
胡桃醌(成都瑞芬思生物科技有限公司,批号:H-075-131230.纯度:>98%);L-Dopa(批号:LRAA9068,纯度:≥99.5%)、L-Tyr(批号:SLBN0617V,纯度:≥99.5%)、L-Trp(批号:BCBR1025V,纯度:≥99.5%)对照品均购自美国Sigma公司;甲醇、乙腈均为色谱纯;水为纯净水。
1.3 动物
SPF級Wistar大鼠,雄性,体质量(200±20)g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2016-0011。动物于室温22~24℃、湿度40%~70%条件下饲养,期间自由摄食、饮水。
2 方法与结果
2.1 分组、给药
取40只大鼠,随机分为空白组和胡桃醌高、中、低剂量组(34.832、17.416、8.708mg/kg,剂量依据预试验结果确定,开始出现毒性症状的剂量为中剂量,再以此确定高、低剂量),每组10只,每天灌胃给药1次,灌胃体积为2mL/100g,空门组给予等体积纯净水,连续给药4周。给药期间大鼠自由摄食、饮水。
2.2 各组大鼠行为学观察
对各组大鼠一般行为学进行观察记录。结果,与空门组比较,胡桃醌各给药组大鼠行为活动均有明显差异:灌胃初期,大鼠出现耸毛、活动减少或不动、不食等现象;灌胃后期,胡桃醌高、中剂量组大鼠逐渐出现呆顿、倦怠眯眼、精神不佳、躯体瘫软、四肢明显无力,同时伴有毛色干枯等现象。
2.3 各组大鼠体质量及脑指数的测定
末次灌胃给药后,称量大鼠的体质量;处死大鼠,取出脑组织,生理盐水清洗并用滤纸吸干多余水分,计算脑指数(脑指数=脑质量/体质量Xl00%)。采用SPSS17.0软件对实验数据进行单因素方差分析,数据以 ±5表示,组间比较采用t检验,P<0.05表示差异有统计学意义。各组大鼠体质量及脑指数的测定结果见表1。
由表1可知,与空门组比较,胡桃醌高、中、低剂量组大鼠体质量显著下降(P<0.01),胡桃醌高剂量组大鼠脑指数显著升高(P<0.05)。
2.4 各组大鼠脑组织病理学观察
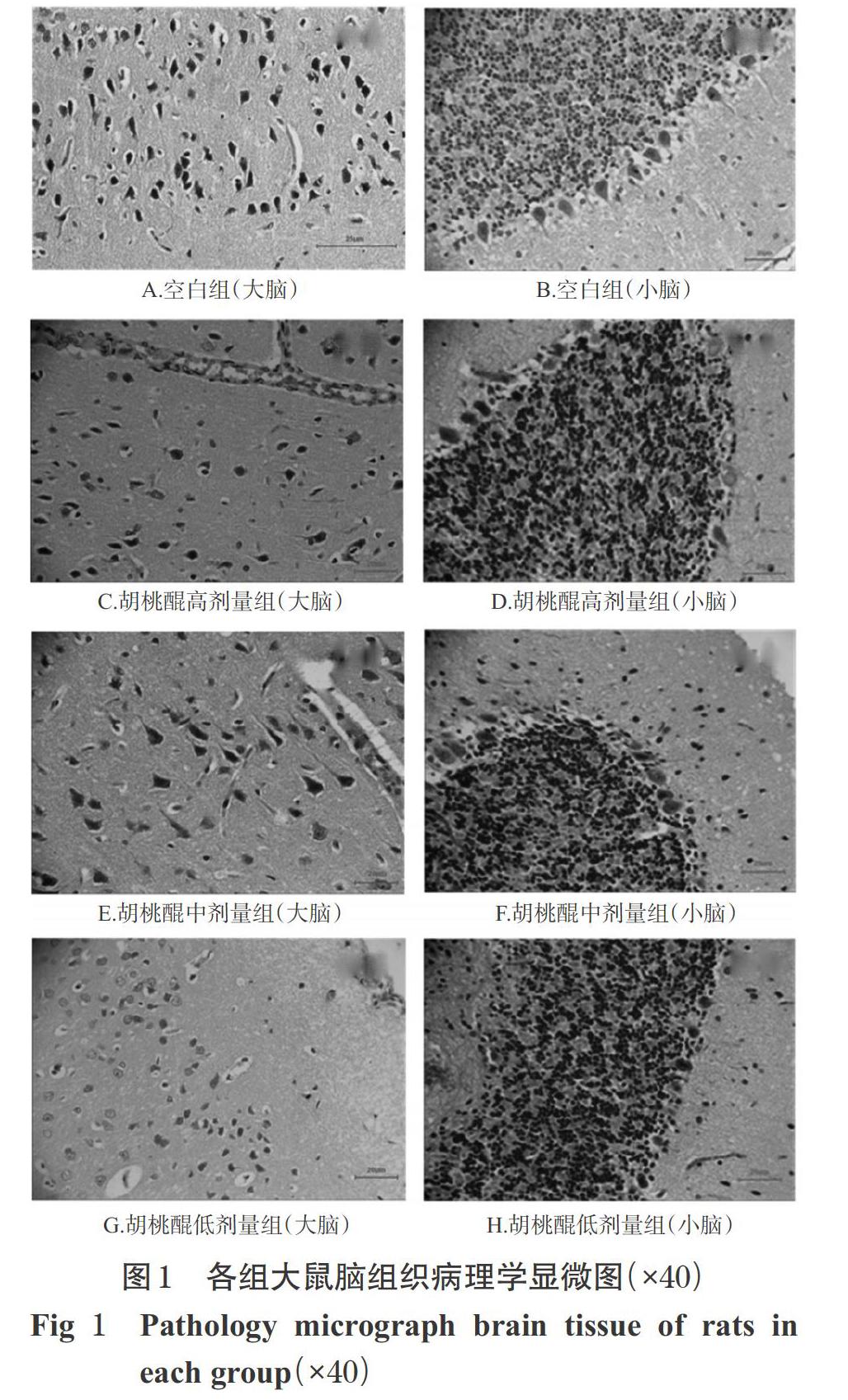
各组大鼠进行脑指数测定实验后,将大鼠大脑、小脑组织于10%中性甲醛(pH 7.2)固定、组织修切、石蜡包埋、常规切片、苏木精一伊红(HE)染色、酒精梯度脱水、透明、封片,最后于显微镜下观察。各组大鼠脑组织病理学观察结果见图1。
由图1可知,空白组大鼠大脑组织皮层椎体细胞形态结构完整,胞核清晰,毛细血管未见明显充血;小脑组织的蒲金野氏细胞层细胞形态清晰、结构完整、排列规则,毛细血管未见明显充血。胡桃醌各剂量组大鼠大脑组织出现皮质内小血管充血,锥体细胞层部分神经元固缩,核深染,形态不规整,边界不清晰,尤其胡桃醌高剂量组现象较为明显,神经元甚至溶解消失;小脑皮质内小血管充血,部分蒲金野氏细胞的细胞质内可见微小空泡、肿胀,胡桃醌高、中剂量组部分细胞核深染、变小,甚至溶解消失。
2.5 大鼠血清中L-Dopa、L-Tyr、L-Trp的含量测定
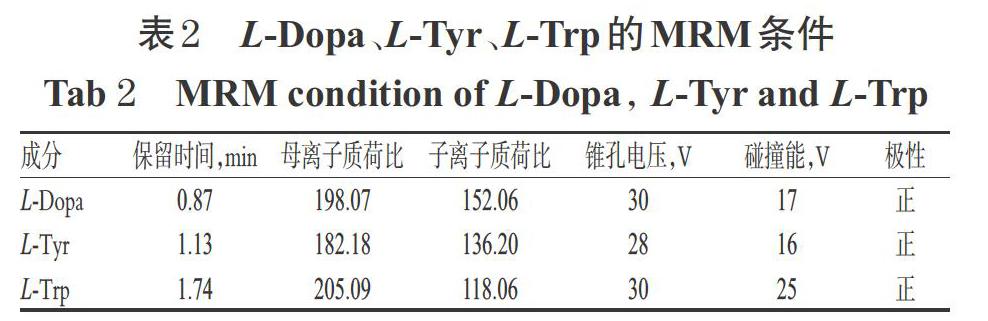
2.5.1 色谱与质谱条件(1)色谱条件。色谱柱为Wa-ters Acquity UPLC BEH C.8色谱柱(100mm×2.1mm.1.7 μm);流动相为5mmol/L乙酸铵水溶液(A)-乙腈(B),梯度洗脱(0~2min.5%B;2~11min, 5% B→35% B; 11~12.5min, 35% B→l00% B; 12.5~13min,100% B; 13~13.1min, 100%B→5% B; 13.1~15min,5%B);进样量为5μL;流速为0.3mL/min;柱温为30 0C。(2)质谱条件。采用ESI离子源,正离子模式下检测,毛细管电压为3500V,去溶剂气流量为650L/h,去溶剂化温度350℃,离子源温度为110℃,MRM扫描测定。L-Dopa、L-Tyr、L-Trp的MRM条件见表2。
2.5.2 血清样本处理大鼠末次给药后,腹腔注射10%水合氯醛进行麻醉,腹主动脉取血,3000r/min离心10min,取上清加入2倍活性炭,涡旋混合,4℃、13000r/min离心10min,取上清液,经0.45mm微孔滤膜过滤后为空白血清样本,-80℃低温保存备用;取各组大鼠血清样本200μL,加入800μL甲醇,涡旋2min,4℃13000r/min离心10min,定量取800μL的上清液氮气吹干,用200μL初始流动相复溶,4℃13000r/min离心10min,取上清液备用。
2.5.3 对照品溶液的制备 分别精密称取L-Dopa、L-Tyr、L-Trp对照品适量,置于10mL量瓶中,用甲醇制成质量浓度为1mg/mL的标准储备液,4℃低温保存待用。精确量取L-Dopa、L-Tyr、L-Trp对照品储备液适量,用甲醇制成L-Dopa、L-Tyr质量浓度分别为64000、16000、4000、1000、250、62.5ng/mL,L-Trp质量浓度分别为32000、8000、2000、500、125、31.25ng/mL的系列对照品溶液。
2.5.4 专属性试验分别取空白血清、空白血清+混合对照品溶液(与L-Dopa、L-Tyr、L-Trp的对照品溶液适量混合)、末次灌胃给药后大鼠的血清样品,按“2.5.2”项下方法处理样品后,再按“2.5.1”项下的色谱与质谱条件进样分析,记录色谱图。结果表明,空白血清基质对所测的3种成分不产生影响,各离子通道中的目标待測物未出现明显的干扰峰,末次灌胃给药后大鼠的血清样品中各待测物出峰位置和空白血清加混合对照品的出峰位置一致,说明该方法专属性较好。样品总离子流图见图2。
2.5.5 线性关系、检测限及定量限考察取空白血清200μL,加入800μL甲醇,涡旋2min,4℃13000r/min离心10min,定量取800μL的上清液,精密加入“2.5.3”项下系列质量浓度的L-Dopa、L-Tyr、L-Trp对照品溶液100μL,共同氮气吹干后,用200μL初始流动相复溶,最后制成/-Dopa( 31.25、125、500、2000、8000、32000ng/mL)、L-Tyr( 31.25、125、500、2000、8000、32000ng/mL)、L-Trp( 15.625、62.5、250、1000、4000、16000ng/mL)的系列溶液,按“2.5.1”项下色谱与质谱条件进样分析。以L-Dopa、L-Tyr、L-Trp的质量浓度为横坐标(x)、峰面积为纵坐标(y)进行线性回归;另取“2.5.3”项下各对照品溶液适量,以甲醇倍比稀释后测定,以信噪比为3:1、10:1计算检测限、定量限,结果见表3。
2.5.6 精密度试验取空门血清200μL,加入800μL甲醇,涡旋2min.4℃13000 r/min离心10min,定量取800μL的上清液,精密加入不同质量浓度的L-Dopa、L-Tyr、L-Trp对照品溶液100μL,共同氮气吹干,200μL初始流动相复溶,分别制成L-Dopa、L-Tyr、L-Trp的高、中、低质量浓度(4000、2000、1000ng/mL)的血清样品溶液,以“2.5.1”项下色谱与质谱条件连续进样6次,记录峰面积,计算日内精密度,以L-Dopa、L-Tyr、L-Trp峰面积计算相应质量浓度,其与真实质量浓度的比值计算准确度。结果,高、中、低质量浓度样品溶液的L-Dopa、L-Tyr、L-Trp的日内精密度RSD均未超过2.51%,准确度在93%~100%之间(n=6),符合生物样品定量分析的相关要求。精密度、准确度结果见表4。
2.5.7 稳定性试验同“2.5.6”项下方法“取空白血清……200μL初始流动相复溶”,分别制成L-Dopa、L-Tyr、L-Trp的高、中、低质量浓度(4000、2000、1000ng/mL)的血清样品溶液,分别于室温下放置0、2、4、8、12、24h后,按“2.5.1”项下色谱与质谱条件进样分析。结果,高、中、低质量浓度样品溶液的L-Dopa、L-Tyr、L-Trp峰面积的RSD均小于2.5%(n=6),表明各被测成分24h稳定性良好。
2.5.8 基质效应同“2.5.6”项下方法“取空白血清……200μL初始流动相复溶”,分别制成L-Dopa、L-Tyr、L-Trp的高、中、低质量浓度(4000、2000、1000ng/mL)的血清样品溶液,按“2.5.1”项下色谱与质谱条件进样分析,记录峰面积A;另用初始流动相代替空门血清,配制相同质量浓度的样品溶液,按“2.5.1”项下色谱与质谱条件进样分析,记录峰面积B。按公式计算基质效应:A/B×100%:结果,L-Dopa、L-Tyr、L-Trp的基质效应在95.1%~100.1%之间,RSD均未超过3.25%(n=6),符合生物样品定量分析的相关要求,结果见表4。
2.5.9 含量测定 末次给药后,取各组大鼠血清,按“2.5.2”项下方法处理后,按“2.5.1”项下色谱与质谱条件进样分析,计算各组大鼠血清中L-Dopa、L-Tyr、L-Trp的含量,结果见表5。
由表5可知,与空白组比较,胡桃醌中、高剂量组L-Dopa含量显著升高(P<0.01);胡桃醌低、中、高剂量组L-Tyr含量均显著升高,L-Trp含量均显著降低(P<0.05或P
3 讨论
L-Dopa是生物体脑内一种重要的生物活性物质,是从L-Tyr到儿茶酚或黑色素的生化代谢途径过程中重要的中间产物,L-Dopa通过血脑屏障脱羧生成多巴胺(DA);高浓度L-Dopa和DA可通过自身氧化,生成具有高毒性的氧化活性物质,如过氧化氢、超氧自由基、羟自由基等,这些高毒物质超出机体氧化应激平衡,即可攻击脑组织中细胞膜上的多聚不饱和脂肪酸,产生脂质过氧化物,诱发大鼠脑组织的氧化应激状态,使黑质致密部羟自由基形成增加、纹状体脂质过氧化水平增高,产生潜在脑细胞毒性[10-14]。本实验结果显示,与空门组比较,胡桃醌各剂量组大鼠血清中L-Dopa及L-Trp含量明显增加,中、高剂量组的变化尤为明显,结合脑组织病理学观察结果,提示胡桃醌可能通过影响Trp-Dopa代谢过程而造成潜在脑毒性。
L-Trp是机体必需氨基酸之一,血液中游离Trp通过血脑屏障进入大脑,在中枢神经系统中经色氨酸羟化酶作用转化成5-羟色胺(5-HT),后者是与行为、情绪、睡眠及认知等诸多脑生理活动密切相关[15-17]。本研究结果显示,与空门组比较,胡桃醌各剂量组大鼠血清中L-Trp含量均显著降低,且成剂量依赖趋势,提示胡桃醌可干扰正常大鼠机体Trp代谢。
综上所述,本研究发现胡桃醌对大鼠的行为学、脑指数、脑组织形态均有明显影响,推测其可能通过升高大鼠血清中L-Dopa、L-Tyr含量,降低L-Trp的含量影响脑组织功能,可为胡桃醌的临床用药提供安全性评价基础。
参考文献
[1]黑龙江省药品监督管理局黑龙江省中药材标准:2001年版[S].哈尔滨:黑龙江省科学技术出版社,2001: 69-70
[2] YUE CF,LEI儿,YU B Effect of qinglongyi polysaccha-rides on complex mobility of erythrocytes in S180 mice[J]. Chinese Herbal Medicines,2013,27(1):58-61.
[3]YANG Q,YAO QS,KUANG Y,et al Antimicrobial andcytotoxic juglones from the immatureexocarps of Juglansmandshurica[J]. Nat Prod Res, 2019, 33(22): 3203-3209
[4]XU HL,YU XF,QU SC,et al Anti-proliferative effect ofjuglone from Juglans mandshurica Maxim on human leu-kemia cell HL-60 by inducing apoptosis through the mito-chondria-dependent pathway[J]. Eur J Pharmacol, 2010,645(1/3):14-22
[5]BHATTACHARJEE AK,PUNDLIK SS,GADRE SR. Co-nformational and electrostatic properties of naphthazarin,juglone, and naphthoquinone: an abinitio theoretical study[J]. Cancer Invest, 1997, 15(6):531-41
[6]INBARAJ JJ,CHIGNELL CF. Cytotoxic action of juglo-ne and plumbagin:a mechanistic study using HaCa T kera-tinocytes[J]. Chem Res Toxicol, 2004, 17(1):55-62
[7]何睦,姚衛峰,蔡秀江,等,代谢组学在肝肾损伤研究中的应用[J]中国临床药理学与治疗学,2012,17(8):924-930.
[8]WIDNER B,LEDOCHOWSKIM,FUCHS D Sleep dis-turbances and tryptophan in patients with Alzheimer's dis-ease[J]. Lancet, 2000, 355 (9205): 755-756
[9]刘洋,焦玥,孙丹丹,等首乌方对左旋多巴诱发异动症模型大鼠脑内氨基酸类神经递质水平的影响[J]中国比较医学杂志,2016,26(1):7-13.
[10]尹伟华,刘春风,苏敏,左旋多巴对健康老年大鼠的神经毒性[J]江苏医药,2005,30(11):814-816.
[11]王慧媛,杜彦,赵志刚,帕金森病的药物治疗研究进展[J]中国药房,2007,18(32):2543-2545.
[12]金同章.黑质DA的氧化应激与帕金森病脑内多巴胺的生物医学[M].上海:上海科技教育出版社,1998, 171-174
[13]HASTINGS TG,LEWIS DA,ZIGMOND MJ. Role of ox-idation in the neurotoxic effects of intrastriatal dopamineinjections[J]. Proc Natl Sci USA, 1996, 93 (5): 1956-1961
[14]KOSHIMURA K, TANAKA, MURAKAMI Y, et al Ef-fects of dopamine and L-dopa on survival of PC12 cells[J].,Neurosci Res ,2000,62(1):112-1 19.
[15]JAHAN K, PILLAI KK,VOHORA D Parachlorophenyl-alanine-induced 5-HT depletion alters behavioral andbrain neurotransmitters levels in 6-Hz psychomotor sei-zure model iIl mice[J]. Fundam Clin Pharmacol,2017,31(4):403-410.
[16]AKANA SF. Feeding and stress interact through the sero-tonin 2C receptor in developing mice[J]. Physiol Behav,2008,94(4):569-579
[17]11 Y, LIU J,LIU X, et al.Antidepressant-Iike action ofsingle facial injection of botulinum neurotoxin a is assoa-ated with augmented 5-HT levels and BDNF/ERK/CREBpathways in mouse brain[J]. Neurosci Bull, 2019, 35(4):661-672
(收稿日期:2019-08-05修回日期:2019-10-12)
(編辑:唐晓莲)

