UPLC-MS/MS法测定不同温度定向炮制黄芪中8种苷类和4种苷元成分的含量
刘蓬蓬 张凡 史辑 单国顺 贾天柱
中图分类号 R283
文献标志码A
文章编号1001-0408(2020)03-0287-07
DOI 10.6039/j.issn.1001-0408.2020.03.07
摘要 目的:建立測定黄芪中8种苷类(黄芪皂苷I、Ⅱ、Ⅲ、Ⅳ和毛蕊异黄酮苷、芒柄花苷、黄芪异黄烷苷、黄芪紫檀烷苷)及4种苷元(毛蕊异黄酮、芒柄花素、黄芪异黄烷、黄芪紫檀素)成分含量的方法,并考察不同炮制温度对上述12种成分含量的影响。方法:分别以生黄芪和不同温度(120、140、160、180、200℃)烘制后的黄芪为样品,采用超高效液相色谱一串联质谱(UPLC-MSIMS)法测定其中12种成分的含量。色谱柱为ACQUITY UPLC HSST。,流动相为0.1%甲酸水溶液- 0.1%甲酸乙腈溶液c梯度洗脱),流速为0.5mL/min,柱温为30℃,检测波长为260 nm,进样量为2μL。采用电喷雾离子源,在正离子模式下进行监测扫描,扫描范围为质菏比50~1500,毛细管电压为2000V,离子源温度为100℃,脱溶剂温度为400℃,雾化气(N2)流速为40L/h,脱溶剂气(N2)流速为800L/h,碰撞能量为20~30V.数据采集速率为0.5s/scan。结果:黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪异黄烷苷、黄芪异黄烷、黄芪紫檀烷苷、黄芪紫檀素的检测质量线性范围分别为0.00116~0.2320、0.000276~0.0552、0.00022~0.0440、0.000225~0.0450、0.000734~0.587 0、0.00117~0.2340、0.000742~0.1480、0.00130~0.260、0.00398~0.795 0、0.000476~0.4760、0.001 89~0.378 0、0.000336~0.3360μg(R2均不低于0.9992);检测限分别为6.2x10-6、4.8xl0-6、3.8xl0-6,3.4x10-6、5.8xl0-6、4.8x10-6、4.2 Xl0-6、3.2x10-6、5.8xl0-6、2.6x10-6、4.2 X10-6、6.4x10-6μg;定量限分别为l2.6xl0-6、l6.2xl0-6、l4.4xl0-6、l4.8xl0-6、l8.8xl0-6、l6.4xl0-6、15.4×l0-6、10.8xl0-6、20.2xl0-6、12.4x10-6、14.6x10-6、23.4X10-6μg;精密度、稳定性(24h)、重复性试验的RSD均小于3.O%(n=6);平均加样回收率分别为99.1%、100.2%、98.7%、101.9%、98.6%、102.1%、99.2%、100.3%、98.7%、99.2%、99.3%、100.8%,RSD分别为1.9%、2.2%、2.4%、1.8%、2.1%、1.7%、2.3%、l.9%、2.4%、1.8%、2.2%、1.9%(n=6)。含量测定结果显示,黄芪皂苷I、Ⅱ、Ⅲ的含量随着烘制温度的升高而逐渐降低,黄芪皂苷Ⅳ的含量随着温度的升高而逐渐升高;黄酮苷类成分毛蕊异黄酮苷、芒柄花苷、黄芪异黄烷苷、黄芪紫檀烷苷的含量均随着烘制温度的升高而降低,而对应的苷元成分毛蕊异黄酮、芒柄花素、黄芪紫檀素的含量均随着烘制温度的升高而先升高后降低;黄芪异黄烷的含量随着烘制温度的升高而降低。结论:所建立的UPLC-MS/MS法可用于黄芪中12种成分含量的测定;黄芪经不同温度炮制后,苷类成分含量总体呈降低趋势,苷元成分含量总体呈升高趋势。
关键词黄芪;超高效液相色谱一串联质谱法;苷类;苷元;含量测定;定向炮制
黄芪为豆科植物蒙古黄芪[Astragalus membrana-ceus (Fisch.)Bge.var.mongholicus( Bge.) Hsiao]或膜荚黄芪[Astragalus membranaceus (Fisch.)Bge.1的干燥根,主要有补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、敛疮生肌之功[1]。现代研究发现,黄芪中主要以黄芪皂苷I、Ⅱ、Ⅲ、Ⅳ等皂苷类成分,毛蕊异黄酮苷、芒柄花苷等黄酮苷类和少量其对应的苷元类成分及多糖类成分为有效成分[2]。有学者研究发现,中药的苷类成分经口服进入肠道后,由肠道内的微生物代谢转化,脱掉糖基成为次级苷或苷元而发挥药效[3-4]。本课题组前期研究发现,黄芪中的黄酮苷类成分主要以脱掉糖基生成对应的苷元成分而吸收入血,进入体循环。
黄芪传统炮制方法有净制、切制、蒸制、炙制、炒制、煨制等16种。在2015年版《中国药典》(一部)中收载的黄芪炮制品主要是生黄芪和蜜炙黄芪[1]。黄芪蜜炙时需用文火加热炒制,而中药中的苷类成分在炮制过程中由于受温度的影响会发生脱掉糖基生成苷元的转化过程。那么,黄芪中的苷类成分在炒制过程中是否会受温度的影响而发生变化?该问题尚未见报道。基于此,本研究通过模拟炮制的方式,将黄芪在不同温度下进行烘制,采用超高效液相色谱一串联质谱(UPLC-MSIMS)技术分析不同烘制温度下黄芪中8种苷(黄芪皂苷I、Ⅱ、Ⅲ、Ⅳ和毛蕊异黄酮苷、芒柄花苷、黄芪异黄烷苷、黄芪紫檀烷苷)及4种苷元(毛蕊异黄酮、芒柄花素、黄芪异黄烷、黄芪紫檀素)的含量,考察温度对黄芪中苷类及苷元成分含量变化的影响,为开展黄芪的现代化、创新性的炮制转化工艺研究提供参考依据。
l 材料
1.1 仪器
ACQUITY I-CLASS型UPLC仪(包括二极管阵列检测器、二元高压泵、在线脱气装置、自动进样器、柱温箱,数据采集与处理采用Masslynx软件)和XEVOG2-XS型UPLC-MS仪均购自美国Waters公司;AE240型十万分之一分析天平(瑞上Mettler-Toledo公司);FA1004B型电子天平(上海精密科学仪器有限公司);YP5102型电子天平(上海光正医疗仪器有限公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);Milli-Q型纯水仪(美国Millipore公司);DX-200型粉碎机(温岭市林大机械有限公司);WGL-125B型电热鼓风干燥箱(天津泰斯特仪器制造有限公司)。
1.2 药品与试剂
黄芪药材于2017年10月采自山西省五寨县黄芪“中药材生产质量管理规范”(GAP)种植基地,经辽宁中医药大学药学院王冰教授鉴定为豆科植物蒙古黄芪的干燥根。黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素对照品(成都曼斯特生物科技有限公司,批号:MUST-16012906、MUST-16031010、MUST-16090204、MUST-16022804、MUST-16031205、MUST-16120911、MUST-16031111、MUST-16031005,纯度均不低于98%);2'-羟基-3',4'-二甲氧基异黄烷葡萄糖苷(黄芪异黄烷苷)、7,2'-二羟基-3',4'一二甲氧基异黄烷(黄芪异黄烷)对照品(成都普菲德生物技术有限公司,批号:160217、160816,纯度均不低于98%);9,10-二甲氧基紫檀烷葡萄糖苷(黄芪紫檀烷苷)对照品(上海普誉科贸有限公司,批号:16112732,纯度:≥98%);3一羟基-9,10-二甲氧基紫檀烷(黄芪紫檀素)对照品(上海源叶生物科技有限公司,批号:Y29D7H27839,纯度:≥98%);甲酸、甲醇、乙腈均为色谱纯,水为超纯水。
2 方法与结果
2.1 色谱条件
参考文献[5-6]设置色谱条件。色谱柱为ACQUI-TY UPLC HSS T3(100 mmx2.1 mm.1.8μm),预柱为ACQUITY UPLC HSS T3(5mmx2.1mm, 1.8μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱(0~5min,18%B→30%B;5~8min,30% B→36%B;8~10 min, 36%B;10~12min, 36% B→40%B;12~13min, 40%B→48% B; 13~15 min, 48%B→70%B; 15~16min, 70%B→90% B; 16~19min, 100% B;19~22min,18%B);检测波长为260nm;流速为0.5mL/min;柱温为30℃;进样量为2μL。
2.2 MS条件
采用电喷雾离子源(ESI),在正离子模式下(ESI+)进行监测扫描,扫描范围为质菏比(m/Z)50~1500;离子源温度为100℃;毛细管电压为2000V;脱溶剂温度为400℃;雾化气(N2)流速为40L/h,脱溶剂气(N2)流速为800L/h;碰撞能量(CE)为20~30V,数据采集速率为0.5s/scan。采用质量锁定(Lock-Mass)技术以亮氨酸一脑啡肽(LE,ESI+:m/z 556.277 1)调谐液作为校正溶液,时时校正确保质量数的准确测定,其流速为10μL/min,切换频率为20s/次[7-8]。
2.3 黄芪样品的制备
生黄芪:取净制黄芪20g,粉碎,过65目筛,备用。烘制黄芪:取净制黄芪5份,每份20g,分别在120、140、160、180、200℃温度下烘制30min,取出,放凉,粉碎,过65目筛,备用。
2.4 溶液的制备
2.4.1 供试品溶液称取生黄芪和不同温度下模拟炮制的烘制黄芪粉末各约lg,精密称定,分别置于50mL具塞锥形瓶中,精密加入甲醇50mL,称定质量,超声(功率:250W,频率:40kHz)th,取出放至室温,再次称定质量,用甲醇补足减失的质量,摇匀,溶液经0.22μm微孔滤膜滤过,取续滤液,即得[9-10]。
2.4.2 对照品溶液精密称取黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪异黄烷苷、黄芪异黄烷、黄芪紫檀烷苷、黄芪紫檀素各对照品适量,用甲醇溶解并制成质量浓度分别为0.1163、0.1382、0.1101、0.1125、0.2936、0.1172、0.1484、0.1301、1.193、1.191、1.135,1.008g/L的对照品贮备液。取上述各贮备液等量,以甲醇制备成8种黄酮类成分(毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪异黄烷苷、黄芪异黄烷、黄芪紫檀烷苷和黄芪紫檀素)的混合对照品溶液1以及4种黄芪皂苷类成分(黄芪皂苷I、Ⅱ、Ⅲ、Ⅳ)的混合对照品溶液2。将以上溶液4℃贮藏备用,使用时用甲醇稀释至所需质量浓度即可。
2.5 线性关系考察
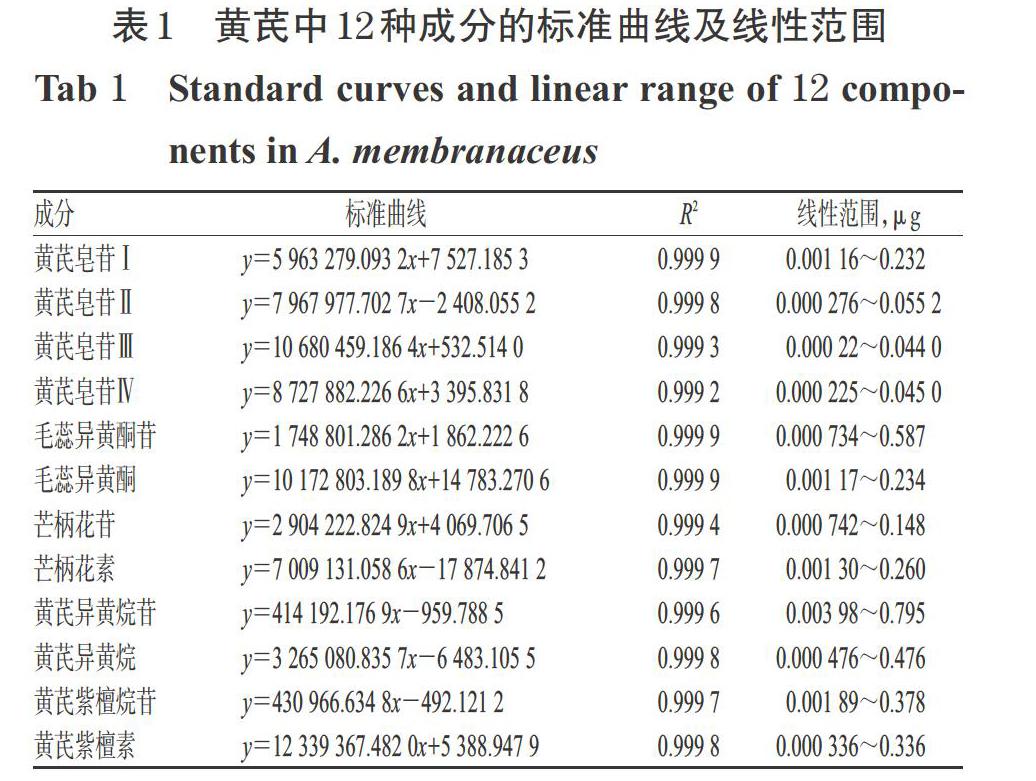
精密吸取混合对照品溶液1、混合对照品溶液2适量,制备成5个质量浓度梯度的混合对照线性溶液,按“2.1”“2.2”项下条件进行测定,记录峰面积,以各对照品的进样量(μg)为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线。结果表明,各对照品的进样量与峰面积均呈良好的线性关系。黄芪中12种成分的标准曲线及线性范围见表1。
2.6 检测限与定量限考察
精密量取“2.4.2”项下混合对照品溶液1、混合对照品溶液2适量,以甲醇倍比稀释,然后按“2.1”“2.2”项下条件连续进样测定6次,记录峰面积。当信噪比为3:1、10:1时分别得检测限、定量限。结果显示,黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪异黄烷苷、黄芪异黄烷、黄芪紫檀烷苷、黄芪紫檀素的检测限分别为6.2XlO-6、4.8xlO-6、3.8xlO-6、3.4xlO-6、5.8xlO-6、4.8 XlO-6、4.2Xl0-6、3.2×lO-6、5.8xlO-6、2.6xlO-6、4.2xlO-6、6.4×lO-6μg,定量限分別为12.6×10-6、16.2xlO-6、l4.4xl0-6、14.8xl0-6、18.8xlO-6、l6.4xl0-6、15.4xlO-6、10.8xlO-6、20.2xl0-6、l2.4xl0-6、14.6xlO-6、23.4X10-6μg。
2.7 稳定性试验
精密吸取同一生黄芪供试品溶液,分别在室温下放置O、2、4、6、12、24h后,按“2.1”“2.2”项下条件进样测定,记录峰面积。结果显示,黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪异黄烷苷、黄芪异黄烷、黄芪紫檀烷苷和黄芪紫檀素峰面积的RSD分别为2.0%、1.8%、2.1%、2.1%、2.5%、1.9%、1.8%、2.2%、2.3%、1.7%,2.0%和1.9%(n=6),表明供试品溶液在室温条件下放置24h内稳定。
2.8 精密度试验
精密吸取“2.4.2”项下混合对照品溶液1、混合对照品溶液2适量,按“2.1”“2.2”项下条件进样测定,重复进样6次,记录峰面积。结果显示,黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪异黄烷苷、黄芪异黄烷、黄芪紫檀烷苷、黄芪紫檀素峰面积的RSD分别为1.2%、1.1%、1.1%、1.5%、1.3%、1.7%、1.2%、1.8%、1.3%、1.1%、1.4%、1.3%(n=6),表明仪器精密度良好。
2,9 重复性试验
精密称取同一批生黄芪样品6份,按“2.4.1”项下方法制备供试品溶液,然后按“2.1”“2.2”项下条件进样测定,记录峰面积并计算各成分的含量。结果显示,黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、毛蕊异黄酮苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪异黄烷苷、黄芪异黄烷、黄芪紫檀烷苷和黄芪紫檀素含量的RSD分别为1.7%、2.2%、2.3%、1.9%、2.6%、2.1%、1.8%、2.3%、2.2%、1.8%、2.5%、2.O%(n=6),表明本方法重复性良好。
2.10 加样回收率试验
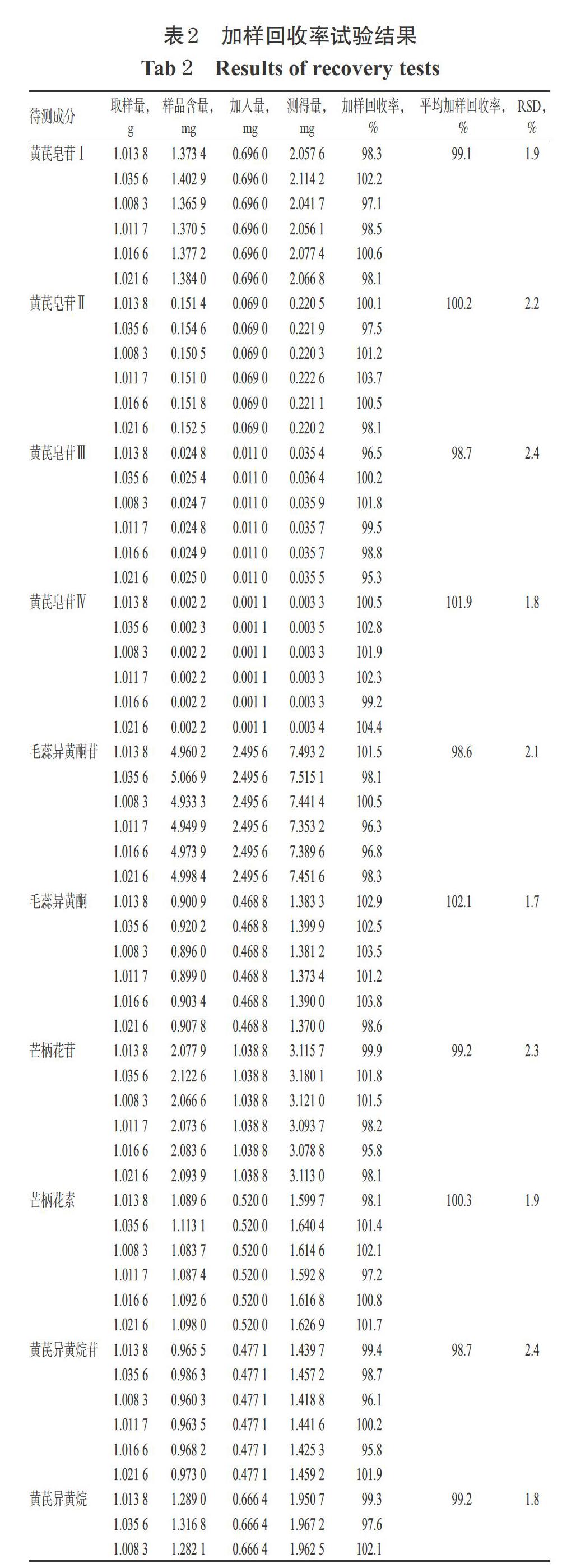
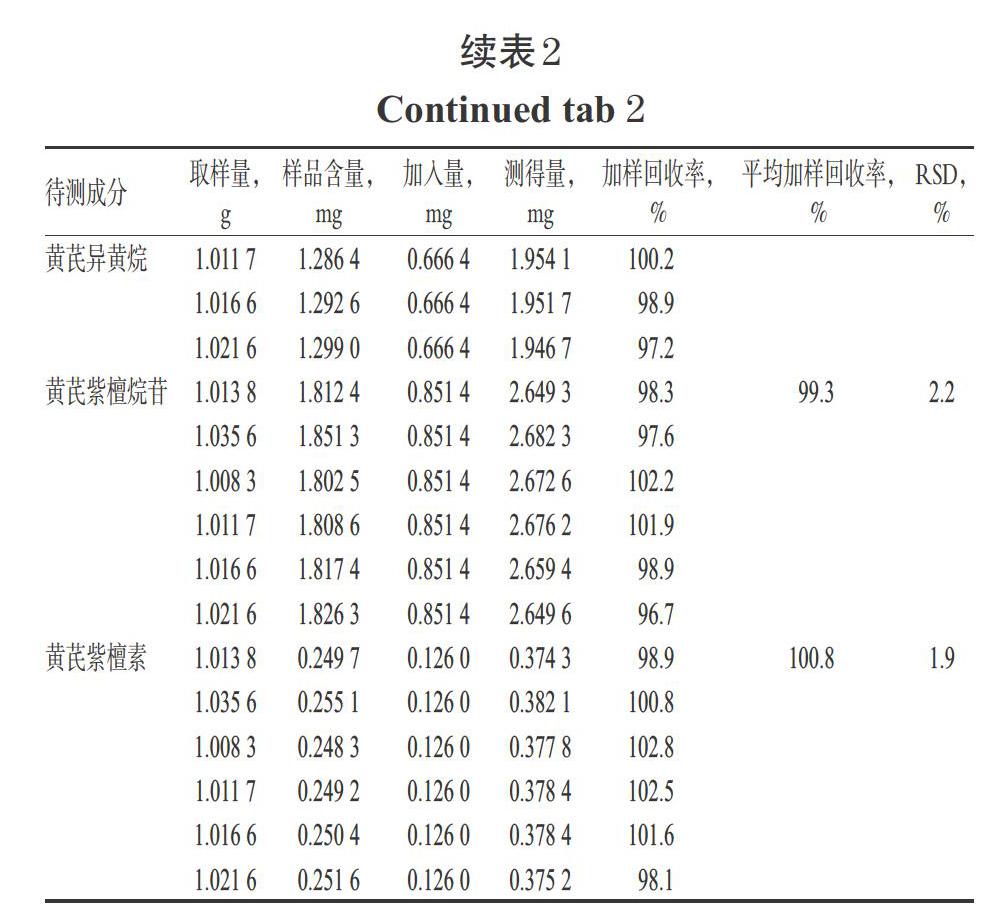
取同一批已知含量的生黄芪样品lg,平行6份,精密称定,按已知成分含量的50%加入相应量对照品,按“2.4.1”方法制备供试品溶液后,按“2.1”“2.2”项下条件进样测定,记录峰面积并计算各成分的加样回收率。结果显示,12种成分的平均加样回收率在98.7%~102.1%之间,RSD在1.7%,~2.4%之间(n=6),表明该方法的准确度较好,结果见表2。
2.11 样品含量测定
取生黄芪和不同温度下模拟炮制的烘制黄芪样品适量,平行3份,按“2.4.1”项下方法制备供试品溶液,并取“2.4.2”项下8种黄酮类成分混合对照品溶液1和4种黄芪皂苷类混合对照品溶液2,分别按“2.1”“2.2”项下条件进样测定,计算样品中12种成分的含量,并分析其在不同烘制温度下的变化情况。结果显示,黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ的含量随着烘制温度的升高而逐渐降低,提示其转化生成了其他化合物,使得含量降低;黄芪皂苷Ⅳ含量随着烘制温度的升高而逐渐升高,表明黄芪在不同温度下进行烘制后,黄芪中的某些成分可能转化生成了黄芪皂苷Ⅳ,使得黄芪皂苷Ⅳ含量增加。黄酮苷类成分毛蕊异黄酮苷、芒柄花苷、黄芪异黄烷苷和黃芪紫檀烷苷的含量均随着烘制温度的升高而降低,而对应的苷元成分毛蕊异黄酮、芒柄花素和黄芪紫檀素的含量均随着烘制温度的升高而先升高再降低。这提示毛蕊异黄酮苷、芒柄花苷和黄芪紫檀烷苷在烘制后脱掉糖基定向转化成了对应的苷元成分,从而使上述黄酮苷类成分含量降低,对应的苷元成分含量增加;然而随着烘制温度的升高,黄酮苷元成分又进一步转化生成了其他化合物,使得苷元类成分含量降低。此外.黄芪异黄烷含量随着烘制温度的升高而降低。各样品的总离子流图见图1,黄芪中12种成分的含量测定结果见表3,140℃烘制黄芪样品中12种成分的提取离子流图见图2。
3 讨论
本研究选取黄芪中的主要皂苷类成分黄芪皂苷I、Ⅱ、Ⅲ、Ⅳ和既存在苷类又存在对应苷元的黄酮类成分(毛蕊异黄酮苷和毛蕊异黄酮、芒柄花苷和芒柄花素、黄芪异黄烷苷和黄芪异黄烷、黄芪紫檀烷苷和黄芪紫檀素)作为含量测定研究的指标性成分。结果显示,黄芪经不同温度烘制后,苷类成分、黄酮苷元类成分含量均发生了变化;建立的UPLC-MS/MS方法可为不同温度定向炮制黄芪后其苷类和苷元成分含量影响的分析提供方法参考。
蜜炙法一般使用文火进行炒制,而文火温度通常为(130±10)℃,所以本研究将120℃设为起始温度,然后以每次增加20℃作为梯度依次递增至300℃,以考察温度对黄芪中苷类和苷元成分含量变化的影响趋势。但由于温度在220--300℃时黄芪皂苷、黄酮苷及其对应的苷元成分基本上都发生了分解,均未检出,故在结果中未展示这一温度范围烘制黄芪后苷类和苷元成分含量变化。
综上,所建立的UPLC-MS/MS法可用于黄芪中12种成分含量的测定;黄芪经不同温度炮制后,苷类成分含量总体呈降低趋势,苷元成分含量总体呈升高趋势。
参考文献
[1] 同家药典委员会.中华人民共和国药典:一部[S].2015年 版北京:中同医药科技出版社,2015:302-303
[2]蔡金坊,代云桃,肖永庆,等系统评价蜜炙对黄芪药效物质基础的改变[J]中国实验方剂学杂志,2016,22(8):47-52
[3]HATTORI M,KIM G,MOTOIKE S,et al.Metabolism ofsennosides by intestinal flora[J]. Chem Pharm Bull,1982,30(4): 1338-1346.
[4]El-SEDAWY AI,HATTORI M,KOBASHI K,et al. Me-tabolism of gentiopicroside(gentiopicrin) by human intes-tinal bacteria[J]. Chem Pharm Bull, 1989, 37 (9): 2435-2437.
[5]杜国军.恒山黄芪道地药材质量标准研究[D]太原:山西大学,2013
[6]芮雯,冯毅凡,姜苗苗,等不同产地黄芪药材的UPLC/Q-TOF-MS指纹图谱研究[J]药物分析杂志,2012,32(4):607-611、642
[7]张桂平,王东旭.HPLC-PDA法同时测定大黄蛰虫丸中6种成分的含量[J]中国药房,2019,30(1):54-58
[8]陆文瑾,窦志华,曹瑞,等.HPLC法同时测定大黄药材中8个非蒽醌类成分的含量[J]中国药房,2019,30(14):1975-1980
[9]李翔,朱臻宇,柴逸峰,等.HPLC-MS测定黄芪药材中3种成分的含量[J]药学学报,2006,41(8):793-796
[10]张曦,孙衍同,梁鑫淼,等中药黄芪中异黄酮苷类化合物的高效液相色谱一串联质谱分析[J]精细化工,2005,22(12):898-902
(收稿日期:2019-09-12修回日期:2019-11-18)
(编辑:林静)

