敲除NOR1基因对人肝癌裸鼠移植瘤的影响及作用机制
游 焜, 王大军, 王 亮, 王建国
新乡医学院第一附属医院 肝胆外科, 河南 新乡 453100
肝癌是临床上发病率仅次于食管癌和胃癌的消化系统肿瘤,可分为原发性和继发性,严重威胁人类健康[1]。原发性肝癌起源于肝脏的上皮或间叶组织,且原发性肝癌的发病是一个多因素的复杂过程,与HBV和HCV感染[2-3]、黄曲霉素[4]、酒精和非酒精因素导致的肝损伤[5-6]等因素有密切关联。NOR1(oxidored-nitro domain containing protein1) 基因是由中南大学肿瘤研究所克隆的基因,定位于1p34.2,基因组DNA总长33.4 kb,包含11个外显子,编码389个氨基酸残基,在人类组织中广泛表达[7]。最近发现该基因与肝癌发生发展有着重要关系,研究[8]显示,NOR1在人肝癌组织中表现出高表达水平,且敲除NOR1基因的小鼠对二乙基亚硝胺诱导肝癌产生抗性,抑制小鼠肝癌的发生发展,说明NOR1基因可能是肝癌相关的抑瘤、易感基因候选者。Notch基因最早发现于果蝇,Notch信号通路除了在调节细胞、组织、器官的分化和发育等方面发挥重要作用,还对多种肿瘤的发展起到调节作用[9-10]。近年来,使用RNA干扰技术进行基因治疗及基因功能研究备受关注。本研究旨在探究敲除NOR1基因后对Notch信号通路活性、肝癌裸鼠移植瘤生长、模型裸鼠存活率以及细胞转移的影响,为肝癌的治疗提供理论依据。
1 材料与方法
1.1 材料 SPF级雄性BALB/C裸鼠,4~6周龄,体质量16~20 g,共30只,购自湖南斯莱克景达实验动物有限责任公司,许可证号[SCXK (湘) 2016-0002];人肝癌细胞株HepG2购于中国科学院细胞库;RPMI-1640培养基购自美国Gibco公司;胎牛血清购自武汉四季青生物制品公司;Lipofectamine 2000转染质粒和siRNA购自日本TaKaRa公司;苏木素伊红染色试剂盒购自碧云天公司;EDTA抗原修复缓冲液购自福州迈新生物公司;DAB 显色试剂盒购自北京中杉金桥生物公司;RIPA裂解液购自碧云天公司;Ki-67、Caspase-3、Notch1、NICD、Hes1、Hey1抗体均购自英国Abcam公司。细胞培养箱购自美国Thermo公司,垂直电泳槽购自美国Bio-Rad公司。本方案经由新乡医学院第一附属医院实验动物伦理委员会审批(批号:2018-12-5),符合实验室动物管理与实验准则。
1.2 细胞培养及转染 将人肝癌细胞株HepG2接种于含10%的胎牛血清和1%双抗的RPMI-1640培养基,培养于37 ℃、含5% CO2培养箱,当细胞密度达到90%时进行传代,待细胞状态稳定后取对数期细胞用于后续试验。将HepG2细胞培养于6孔板,待其生长密度达到50%时,将无序序列质粒 (Scramble) 和siNOR1质粒分别转染至HepG2细胞。采用逆转录-聚合酶链式反应(RT-PCR)检测转染效率。操作步骤按照转染试剂盒执行即可,48 h后用于后续试验。
1.3 MTT检测细胞增殖 将各组细胞接种于96孔板(100 μl/孔),每组设3个复孔,置于37 ℃,含5% CO2细胞培养箱中培养24 h,每孔加入50 μL 1×MTT溶液,孵育4 h,吸出上清液,每孔加150 μl DMSO,用平板摇床摇匀,用酶标仪在570 nm处检测各剂量OD值。
1.4 裸鼠肝癌皮下移植瘤模型的建立及分组 转染后,将各组HepG2细胞密度调整为1×106个/ml,分别接种于裸鼠的腋窝皮下,并根据接种的细胞将大鼠随机分为Control组、Scramble组和siNOR1组,各组10只。饲养30 d,记录裸鼠死亡时间和个数,30 d取出存活裸鼠皮下移植瘤标本, 测量瘤的体积和质量。
1.5 石蜡切片 将各组小鼠颈椎脱臼处死后,取出瘤体及肝、肾、肺、脑剪切成5 mm ×5 mm×5 mm大小的组织块浸泡于4%多聚甲醛中固定48 h,常规方法制作厚度为4 μm的石蜡切片。
1.6 免疫组化检测 取上述裸鼠模型瘤体组织切片,并按常规方法进行脱蜡处理,滴加3%H2O2封闭过氧化物酶,使用0.01 mol/L枸橼酸盐缓冲液进行热修复,5% BSA室温封闭2 h,PBS清洗3次后分别孵育一抗Ki-67(1∶200)、Caspase-3(1∶500),4 ℃封闭过夜,洗去一抗后孵育二抗,经DAB显色后于显微镜下观察并图像采集。
1.7 Western Blot检测 取各组模型裸鼠瘤体组织,并充分匀浆,使用预冷RIPA裂解液充分裂解后提取各组裸鼠瘤体组织总蛋白。经SDS-PAGE凝胶电泳分离蛋白后,将蛋白转印至PVDF膜,5%脱脂奶粉封闭2 h,PBST洗脱后孵育一抗,4 ℃条件下孵育过夜,PBST洗脱一抗,加入对应二抗室温下孵育2 h,PBST洗脱后,加入BCL,进行曝光,计算灰度值。
1.8 HE染色 取上述裸鼠模型各组织器官石蜡切片,分别在二甲苯中进行脱蜡,再经梯度酒精水化。将切片置于苏木紫溶液中染色7 min后,蒸馏水洗净后将切片放于0.5%盐酸乙醇中30 s,自来水轻轻冲洗10 min,放入伊红染液中浸泡3 min,蒸馏水浸泡,梯度酒精进行脱水后经二甲苯透明后滴加中性树胶进行封片,显微镜下观察。
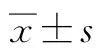
2 结果
2.1 3组裸鼠质粒转染效率比较 RT-PCR检测结果显示,siNOR1组NOR1敲除效率显著低于Control组(P<0.05)(图1),表明NOR1敲除成功。
2.2 3组裸鼠细胞增殖情况比较 采用MTT检测细胞增殖情况,结果显示,siNOR1组第3、4、5、6天细胞增殖倍数显著高于Control组(P值均<0.05)(图2)。
2.3 3组裸鼠肿瘤体积与质量的比较 从建模第20天开始,与Control组相比,siNOR1组第20、25、30 天移植瘤体积显著减小[(418.71±78.24)mm3vs (149.6.16±60.05)mm3、(864.22±125.66)mm3vs (239.83±100.51)mm3、(1468.45±199.78)mm3vs (446.54±147.09)mm3,P值均<0.05];第30天时取出移植瘤,与Control组相比,siNOR1组移植瘤质量显著减小[(0.45±0.07)g vs (0.12±0.04)g,P<0.05](图3)。
2.4 3组裸鼠Ki-67、Caspase-3、Notch、NOR1阳性表达率的比较 与Control组相比,siNOR1组移植瘤组织中Ki-67、Notch、NOR1阳性表达率显著降低[Ki-67:(48.98±9.75)% vs (11.51±5.09)%;Notch: (62.51±9.26)% vs (18.75±4.61)%;NOR1:(76.33±8.31)% vs (16.57±3.76)%,P值均<0.05],Caspase-3阳性表达率显著升高[(6.39±4.67)% vs (38.03±9.28)%,P<0.05](图4)。
注:a,第30天时移植瘤大小;b、c,与Control组比较,*P<0.05。
图3敲除NOR1基因对移植瘤生长的影响
2.5 3组裸鼠生存率及Survivin蛋白表达量的比较 与Control组相比,siNOR1组模型裸鼠30 d内生存率显著高于Control组[(77.66±6.75)% vs (25.32±4.63)%,χ2=6.897,P<0.05];Western Blot检测结果显示,与Control组相比,siNOR1组Survivin蛋白表达水平显著降低(0.34±0.06 vs 0.02±0.01,P<0.05)(图5)。
2.6 3组裸鼠Notch1、NICD、Hes1、Hey1蛋白表达量的比较 Western Blot检测结果显示,与Control组相比,siNOR1组Notch1、NICD、Hes1、Hey1蛋白表达水平均显著降低(Notch1:0.16±0.03 vs 0.03±0.01;NICD:0.26±0.05 vs 0.04±0.02;Hes1:0.35±0.04 vs 0.06±0.02;Hey: 0.29±0.06 vs 0.05±0.02,P值均<0.05)(图6)。
2.7 3组裸鼠各器官损伤程度比较 Control组和Scramble组小鼠肝组织肝索紊乱,肝细胞呈大小不等的空泡样变,嗜酸性变,可见小灶性坏死;局部肾小管扩张,肾小管上皮细胞有变性甚至坏死脱落,肾小管基底膜裸露;肺实质结构紊乱,肺泡腔内可见坏死细胞,肺泡间隔增宽且有炎症细胞浸润;脑中神经元胞核边界不清,核仁肿胀或消失,核固缩浓染,空泡变性多,细胞间隙增大,呈无序排列。而siNOR1组中裸鼠各组织器官损伤情况均得到有效缓解(图7)。
注:a,病理图片(免疫组化,×400 );b,与Control组比较,*P<0.05。
图4敲除NOR1基因对Ki-67、Caspase-3、Notch、NOR1表达的影响
图6敲除NOR1基因对Notch信号通路的影响
图7裸鼠各器官病理图片(HE染色,×400)
3 讨论
原发性肝癌是常见的消化道恶性肿瘤疾病,但由于原发性肝癌的病因及确切分子机制尚不完全清楚,且各种治疗手段存在局限性,肝癌患者的病死率较高,严重威胁人类健康[11]。近年来,肝癌综合治疗策略仍在不断发展和细化中[12]。其中,Notch信号通路已被证明在多种癌症中发挥调节作用,有望成为癌症治疗的关键通路[13]。而NOR1基因也已被证实在肝癌的发生发展中发挥重要作用,有望成为肝癌治疗的靶基因。
本研究发现敲除NOR1基因后人肝癌HepG2细胞移植瘤生长受到显著促进,同时Ki-67表达水平显著下降,Caspase-3表达水平显著升高。在恶性肿瘤中,细胞不受控制的增殖是肿瘤形成的关键原因。Ki-67是分布于细胞核内与增殖相关的关键蛋白,与细胞的有丝分裂密切相关,是反应肿瘤细胞分裂增殖的标志物[14]。细胞凋亡是细胞在一定生理或病理条件下的程序性死亡,可有序去除受损细胞,在肿瘤的发生发展中可以发挥抑制肿瘤细胞生长作用[15]。Caspase是细胞凋亡的关键蛋白酶家族,并参与细胞的生长、分化与凋亡调节[16]。其中Caspase-3是Caspase家族中的重要一员。有研究[17]显示,NOR1基因过表达可改变PDK1表达和线粒体Bax-Bcl2平衡从而抑制肿瘤细胞对缺氧的适应,引起鼻咽癌细胞在缺氧环境凋亡,发挥出抑癌作用。相反,Xiang等[18]研究显示,NOR1基因在肝癌细胞表现出高表达NOR1水平,可能作为肝癌的抑制基因发挥作用。结合已有研究,NOR1基因可能在不同的肿瘤细胞中发挥不同的作用,而在肝癌细胞中NOR1基因可能发挥抑癌作用,抑制肝癌的发生发展。
本实验结果显示,敲除NOR1基因可显著下调Survivin蛋白和Notch信号通路下游Notch1、NICD、Hes1和Hey1蛋白表达水平,并且敲除NOR1基因移植瘤裸鼠30 d内存活率显著高于NOR1基因高表达移植瘤裸鼠。存活蛋白Survivin是凋亡抑制蛋白家族成员,只表达于肿瘤和胚胎组织,参与控制细胞分裂并抑制细胞凋亡,与肝癌的浸润或远处转移等恶性发展密切相关, 可作为肝癌基因治疗的新靶点[19]。Notch信号可通过相邻细胞之间的相互作用进而发挥对细胞增殖分化、器官发育的调控作用[20]。有研究[21]显示,Survivin蛋白在人肝癌组织中高表达,而在正常肝组织中没有存活蛋白的表达,且Survivin高表达患者的生存时间显著低于低表达患者。You等[22]发现,过表达NOR1基因可上调Notch信号通路下游Notch1、NICD、Hes1和Hey1蛋白表达水平,显著提升HepG2或Hep3 B淋巴细胞的增殖和迁移能力。结合已有研究,本研究结果提示,敲除NOR1基因可通过Notch信号通路抑制HepG2细胞移植瘤生长。
肿瘤细胞黏附性降低是恶性肿瘤发生转移侵入周遭正常组织的重要特征,也是肿瘤治疗中的关键。在肿瘤细胞的转移过程中,肿瘤细胞分泌特殊物质,溶解及破坏周围组织,引起侵袭部位炎症反应,造成组织损伤[23]。有研究[24]显示,肝细胞核因子1β可通过激活Notch信号通路促进肝癌细胞向肝癌干细胞分化,增强肝癌细胞的侵袭和转移能力。本研究结果显示,Control组和 Scramble组裸鼠的肝、肾、肺、脑均有不同程度的组织损伤,而敲除NOR1基因后组织损伤均好转。提示,敲除NOR1基因可抑制HepG2细胞侵袭转移。
综上所述,敲除NOR1基因可有效下调Notch信号通路下游蛋白及Survivin蛋白表达水平,进而抑制HepG2细胞裸鼠移植瘤生长,提高裸鼠模型生存率,抑制HepG2细胞侵袭转移。接下来笔者团队将进一步探究NOR1基因及Notch信号通路对HepG2细胞上皮间质转换、侵袭以及向肝癌干细胞分化的影响。

