东北刺人参的抗氧化作用研究
王艳艳,翟春梅,怀雪,孟永海,申柯欣,李廷利,黄莉莉
(黑龙江中医药大学,黑龙江哈尔滨150040)
刺人参为五加科刺人参属刺人参(Oplopanax elatus Nakai.)的干燥根及根茎,也称刺参或东北刺人参,有补气助阳、强心利尿的功效,主要分布于我国的吉林省长白山地区,以及俄罗斯远东山区和朝鲜北部山区[1]。在韩国,东北刺人参被认为具有与人参类似的适应原样作用,主要用于治疗慢性疲劳综合症、神经衰弱、精神分裂症、心血管疾病等,苏联早在20 世纪50年代就将其正式批准作为补品和抗糖尿病药物用于临床[2-4]。东北刺人参主要含有皂苷、蒽醌、脂肪酸、黄酮、氨基酸、挥发油等化学成分。现代药理学研究表明,东北刺人参具有抗菌、抗炎、抗衰老、抗惊厥、抗疲劳、解热、改善睡眠、调节血压、改善生殖功能和降糖等多方面的生物活性。目前,国内对东北刺人参不定根抗氧化能力研究已有文献报道[5],而野生东北刺人参药材的抗氧化活性研究较少。本文对产于吉林长白山的东北刺人参水煎液的抗氧化和抗衰老作用进行考察,为人工栽培品的药效质量的研究提供理论依据,同时,也为更好的保护和利用刺人参的野生资源奠定基础。
1 材料与方法
1.1 动物
野生型Canton S 品系黑腹果蝇,由中国科学院上海生命科学院果蝇技术平台提供。ICR 小鼠,雌雄各半,体重(20±2)g,SPF 级,均由黑龙江中医药大学药物安全评价中心提供,许可证号:SCXK(黑)2013-004。
1.2 试验药物
东北刺人参产自吉林省集安市野生药材种植基地,秋季采收,将其根及根茎,洗净,切段晒干备用。经黑龙江中医药大学王振月教授鉴定为东北刺人参的根及根茎。
东北刺人参根及根茎冻干粉由黑龙江中医药大学中药药理实验室自制:称取一定量的野生东北刺人参药材,用10 倍量的蒸馏水浸泡2 h,加热回流提取2 次,每次1.5 h,合并提取液,滤过浓缩得东北刺人参水煎液,冻干,待用。
1.3 试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenyl hydrazine,DPPH):上海梯希爱化成工业发展有限公司;蔗糖(批号20180103):天津市滨海科迪化学试剂有限公司;琼脂细菌学级(批号1182GR500):Oxoid L.td.Wade Road.Basingstoke.Hants;丙酸(批号20160327):天津市福晨化学试剂厂;酵母粉(批号LP0021):英国OXOID 公司。考马斯亮蓝测试盒(批号20180514)、丙二醛测试盒(MAD,批号20180710)、超氧化物歧化酶测试盒(SOD,批号20180709):南京建成成生物工程研究所。
1.4 仪器
CT15RE 高速冷冻离心机:日本HITACHI 公司;AL 204 电子天平:美国 METTLER TOLEDO 公司;SynergyMX 酶标仪:美国 BIOTEK 公司;EYELA 冷冻干燥机:上海爱郎仪器有限公司;FJ-200 高速万能粉碎机:上海申胜仪器公司;HH.WZ.CY600 电热恒温水浴锅:上海精宏实验设备公司。
1.5 实验环境
将实验动物置于独立通气笼中(噪音≤55dB(A),换气次数:20 次/h~50 次/h,洁净度:100 级,压差≥10 Pa,菌落数≤1 个/皿时)饲养;外界温度(24±2)℃,湿度(55±15)%,光照强度:300 lux,12 h/12 h 明暗交替(7:00-19:00 光照;19:00~次日 7:00 黑暗)。
1.6 方法
1.6.1 微板法检测DPPH 自由基方法的建立
1.6.1.1 DPPH 溶液制备
取16 mg DPPH 试剂,精密称定,至10 mL 容量瓶,用无水乙醇为溶剂溶解并定容,摇匀,得到DPPH储备液的浓度为1.6 mg/mL,DPPH 储备液在4 ℃冰箱避光冷藏。
1.6.1.2 DPPH 标准曲线的制备
取DPPH 储备液,稀释成以下系列浓度:1、0.75、0.5、0.25、0.125、0.062 5 mg/mL,摇匀,在波长 517 nm 下测定吸光度值,以吸光度(A)为纵坐标,DPPH 浓度为横坐,标绘制标准曲线。
1.6.1.3 DPPH 法实验参数的优化
1)不同反应温度的考察
参照 Brand-WilliamsW 和 Zim mer AR[6-7]建立的DPPH 自由基清除实验稍作改进,即DPPH 溶液与样品溶液按体积比 1 ∶1 加入 96 孔板,振摇 30 s,分别考察避光反应时间分别为 15、30、45 min 后,于 517 nm 处测定的吸光度(OD 值)。其中DPPH 溶液中加入样品溶液的吸光度为 A1(100 μL DPPH 溶液+100 μL 样品溶液);样品溶液吸光度为A2(100 μL 无水乙醇+100 μL样品溶液),DPPH 溶液加入空白溶剂的吸光度为A3(100 μL DPPH 溶液+100 μL 无水乙醇)。根据公式计算DPPH 清除率(%)。样品溶液清除DPPH 自由基减少吸光度为 A3-(A1-A2)[8-9]。DPPH 清除率/%=[1-(A1-A2)/A3]×100%。
2)不同反应体系的考察
在反应时间确定的基础上,考察了DPPH 溶液与样品溶液按不同反应体积体系配比(3 ∶2,2 ∶1,1 ∶1),对DPPH 自由基清除率(%)的影响,其它步骤同1.6.1.3中1)的方法。
1.6.1.4 东北刺人参的抗氧化作用
精确称量刺人参冻干粉0.5 g,溶剂定容于25 mL容量瓶,摇匀,并稀释为不同的浓度梯度(0.625、1.25、2.5、5、7.5、10 mg/mL),以维生素 C(VC)为阳性对照药,按照“1.6.1.3”中1)的优化方法测定各组吸光度值,计算DPPH 自由基清除率,并把清除率对浓度作非线性回归拟合,得到两者的量效关系,求出当清除率为50 %时对应的浓度,从而得出各自的IC50值[8]。
1.6.2 东北刺人参对果蝇寿命的影响
果蝇培养基的制备采用基础培养基配方,主要由蒸馏水69 mL,玉米粉 6.3 g,蔗糖 4.65 g,琼脂 0.45 g,酵母粉0.45 g,丙酸0.45 mL 组成,在该培养基配制过程中添加 0.374、0.187、0.098、0.049 g 的刺人参提取物冻干粉,分别折合药物质量浓度为0.46 %、0.23 %、0.12%、0.06%,对照组则给予正常培养基饲养。参照文献方法加以改进[10-12]对果蝇行为学考察如下。
1.6.2.1 寿命实验
收集12 h 内羽化成虫的果蝇,随机分为对照组和给药组,每组雌雄各 100 只,在(25±4)℃、相对湿度为(60±10)%、光/暗时间为 12 h/12 h 的恒温恒湿智能培养室中培养。每4 天更换一次培养基并观察记录果蝇的情况。计算平均寿命、中间寿命、最高寿命。
1.6.2.2 亚急性氧化损伤实验
取30 日龄果蝇,每组雌雄各100 只,分别给予含20%的H2O2的6%的葡萄糖溶液,每4 小时记录一次,直至果蝇全部死亡。
1.6.2.3 衰老果蝇的攀爬实验
收集12 h 内羽化成虫的果蝇,每组10 只果蝇,雌雄各半。于第 0、10、20、30 天移入空的果蝇管中,观察10 s 内攀爬超过8 cm 处的果蝇只数。每组重复实验 5 次。
1.6.2.4 生殖实验
分别取7、15、30 天果蝇,每管雌雄各一只,饲养3天后取出,记录第一天出生的子代蝇个数,连续记录7天,每组实验平行6 次。
1.6.3 刺人参对力竭游泳实验小鼠MDA 含量和SOD活力的影响
选取ICR 小鼠,置于实验环境中适应一周。随机分为5 组,每组12 只,分别为空白对照组,东北刺人参冻干粉高、中、低剂量组。高、中、低剂量组分别按500、250、125 mg/kg 剂量灌胃给药,空白组动物给予生理盐水溶液,给药容积为0.2 mL/10 g 体重,连续给药15天,小鼠末次给药30 min 后,不负重游泳90 min,颈椎脱臼处死,解剖取出肝脏,生理盐水洗去血液,制成10%肝匀浆。参照丙二醛测定试剂盒、超氧化物歧化酶试剂盒说明书操作测定MDA 含量和SOD 活力。
1.7 统计学处理
计量资料的统计采用SPSS 17.0 软件进行方差分析(Analysis of variance,ANOVA)单因素方差分析,数据以D 表示,组间做t 检验,P<0.05 则表示有显著性差异,有统计学意义,P<0.01 为极显著性差异。
2 结果
2.1 东北刺人参清除DPPH 自由基的能力
2.1.1 DPPH 标准曲线的制备
DPPH 储备液稀释后检测各浓度的吸光度值,以吸光度(A)为纵坐标,DPPH 浓度为横坐标绘制标准曲线,线性方程为y=1.023 7x-0.143 4,R2=0.999 4。结果表明 DPPH 在 0.062 5 mg/mL~0.5 mg/L 浓度范围内,吸光度与浓度范围具有良好的线性关系。
2.1.2 微板法实验参数的优化结果
以刺人参冻干粉为考察对象,供试品溶液浓度为7.5 mg/mL,根据不同反应时间与反应体积比之间的关系设定的参数优化的结果见表1。
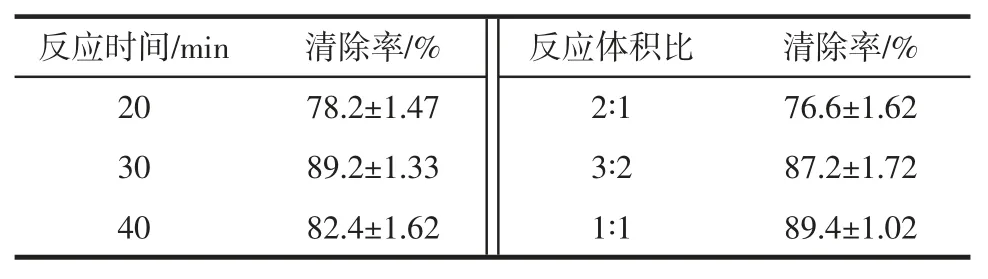
表1 不同反应时间和反应体积比的样本清除率Table 1 Sample clearance rate for different reaction times and reaction volume ratios
表1 结果表明,微板法测定DPPH 自由基参数,最佳反应时间为30 min,反应体积为1 ∶1。
2.1.3 东北刺人参的抗氧化作用
东北刺人参的抗氧化作用见表2。
刺人参水煎液冻干粉在0.625 mg/mL~10.0 mg/mL的浓度范围内,自由基清除率为42.2%~89.0%。阳性对照药 VC在 0.062 5 mg/mL~1.00 mg/mL 的浓度范围内,自由基清除率为54.8%~97.4%。根据以上实验结果计算IC50值,阳性对照VC为0.040 1 mg/mL,刺人参为0.829 mg/mL。
2.2 东北刺人参对果蝇寿命相关行为学指标考察结果
2.2.1 东北刺人参对果蝇寿命的影响
东北刺人参对果蝇寿命的影响见表3。
表2 东北刺人参的抗氧化作用(D)Table 2 Antioxidant effect of CRS supplement(D)
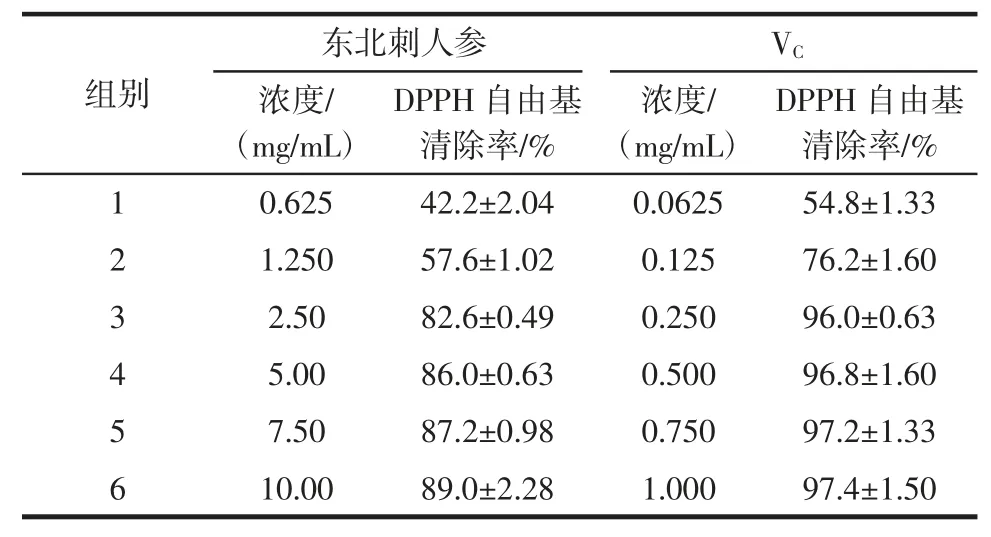
表2 东北刺人参的抗氧化作用(D)Table 2 Antioxidant effect of CRS supplement(D)
组别DPPH 自由基清除率/%1 0.625 42.2±2.04 0.0625 54.8±1.33 2 1.250 57.6±1.02 0.125 76.2±1.60 3 2.50 82.6±0.49 0.250 96.0±0.63 4 5.00 86.0±0.63 0.500 96.8±1.60 5 7.50 87.2±0.98 0.750 97.2±1.33 6 10.00 89.0±2.28 1.000 97.4±1.50东北刺人参 VC浓度/(mg/mL)DPPH 自由基清除率/%浓度/(mg/mL)
表3 东北刺人参对果蝇寿命的影响(n=100,D)Table 3 Lifespan parameters in drosophila following CRS supplement(n=100,D)
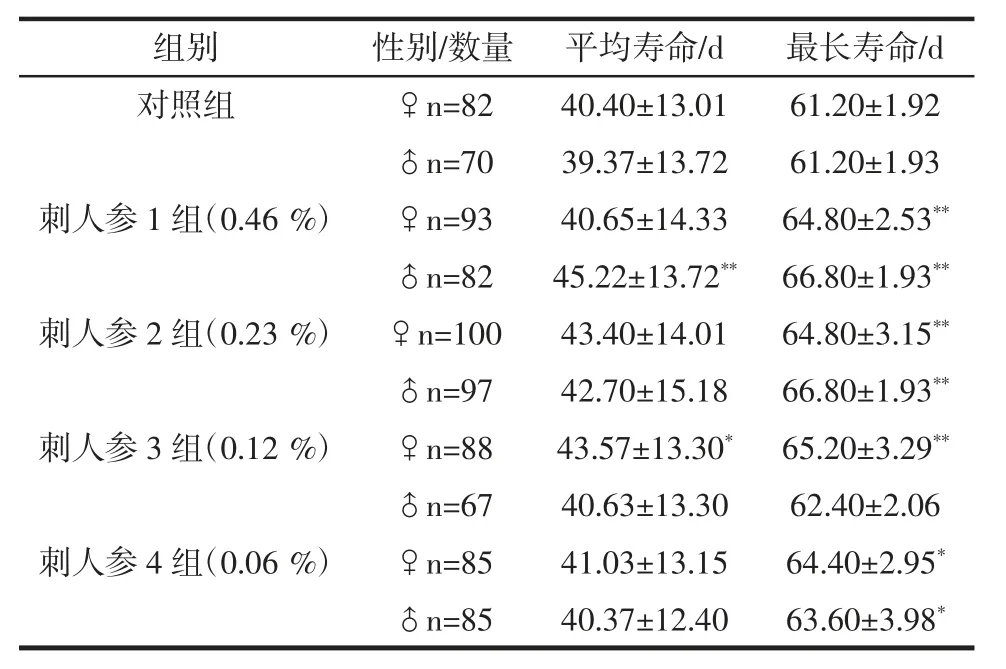
表3 东北刺人参对果蝇寿命的影响(n=100,D)Table 3 Lifespan parameters in drosophila following CRS supplement(n=100,D)
注:*P<0.05 与对照组相比差异显著,**P<0.01 与对照组相比差异极显著。
组别 性别/数量 平均寿命/d 最长寿命/d对照组 ♀n=82 40.40±13.01 61.20±1.92♂n=70 39.37±13.72 61.20±1.93刺人参 1 组(0.46 %) ♀n=93 40.65±14.33 64.80±2.53**♂n=82 45.22±13.72** 66.80±1.93**刺人参 2 组(0.23 %) ♀n=100 43.40±14.01 64.80±3.15**♂n=97 42.70±15.18 66.80±1.93**刺人参 3 组(0.12 %) ♀n=88 43.57±13.30* 65.20±3.29**♂n=67 40.63±13.30 62.40±2.06刺人参 4 组(0.06 %) ♀n=85 41.03±13.15 64.40±2.95*♂n=85 40.37±12.40 63.60±3.98*
在果蝇寿命实验中,与空白对照组相比,各给药组的果蝇平均寿命和最长寿命,均有不同程度的延长,其中,雌雄果蝇在药物浓度为0.46%和0.23%时最长寿命均呈现极显著差异(P<0.01),雌果蝇在药物浓度为0.12 %时最长寿命亦呈现极显著差异(P<0.01),药物浓度为0.06%的雌雄果蝇的最长寿命呈现显著差异(P<0.05)。
2.2.2 东北刺人参对果蝇亚急性氧化损伤实验
东北刺人参对果蝇亚急性氧化损伤实验见表4。
表4 东北刺人参对果蝇亚急性氧化损伤的作用(n=100,D)Table 4 Survival time parameters in drosophila exposed to H2O2 following CRS(n=100,D)
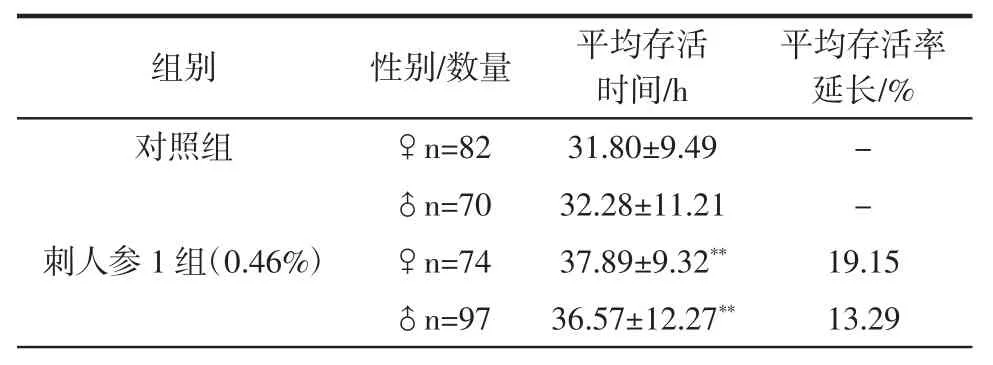
表4 东北刺人参对果蝇亚急性氧化损伤的作用(n=100,D)Table 4 Survival time parameters in drosophila exposed to H2O2 following CRS(n=100,D)
平均存活率延长/%对照组 ♀n=82 31.80±9.49 -♂n=70 32.28±11.21 -刺人参 1 组(0.46%) ♀n=74 37.89±9.32** 19.15♂n=97 36.57±12.27** 13.29组别 性别/数量 平均存活时间/h
续表4 东北刺人参对果蝇亚急性氧化损伤的作用(n=100,D)Continue table 4 Survival time parameters in drosophila exposed to H2O2 following CRS(n=100,D)
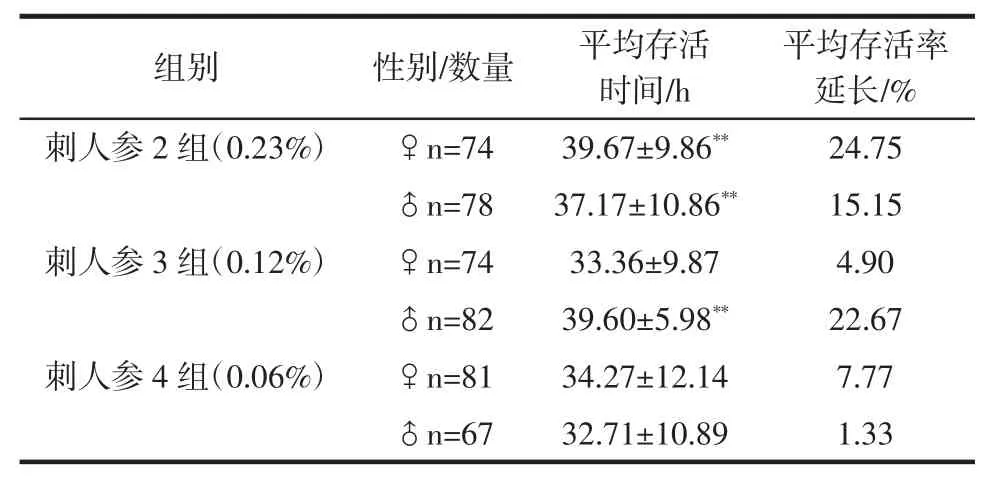
续表4 东北刺人参对果蝇亚急性氧化损伤的作用(n=100,D)Continue table 4 Survival time parameters in drosophila exposed to H2O2 following CRS(n=100,D)
注:**P<0.01 与对照组相比差异极显著;-表示无数值。
平均存活率延长/%刺人参 2 组(0.23%) ♀n=74 39.67±9.86** 24.75♂n=78 37.17±10.86** 15.15刺人参 3 组(0.12%) ♀n=74 33.36±9.87 4.90♂n=82 39.60±5.98** 22.67刺人参 4 组(0.06%) ♀n=81 34.27±12.14 7.77♂n=67 32.71±10.89 1.33组别 性别/数量 平均存活时间/h
在亚急性氧化损伤实验中,与空白对照组比较,在药物浓度为0.46%和0.23%时雌雄果蝇平均存活时间分别呈现极显著差异(P<0.01),药物浓度为的0.12 %的雄果蝇平均存活时间亦呈现极显著性差异(P<0.01)。
2.2.3 东北刺人参对不同时期果蝇的攀爬活动的影响
东北刺人参对不同时期果蝇的攀爬活动的影响见表5。
表5 东北刺人参对不同时期果蝇的攀爬活动的影响(n=5,D)Table 5 Climbing ability in drosophila following CRS supplement(n=5,D)

表5 东北刺人参对不同时期果蝇的攀爬活动的影响(n=5,D)Table 5 Climbing ability in drosophila following CRS supplement(n=5,D)
注:*P<0.05 与对照组相比差异显著。
组别 攀爬能力/只10 d 20 d 30 d对照组 ♀ 4.80±0.84 4.20±0.84 3.40±0.89♂ 4.80±0.33 4.40±0.33 2.80±0.84刺人参 1 组(0.46 %) ♀ 4.80±0.71 5.20±0.54 3.40±0.89♂ 4.80±1.30 6.00±0.71* 3.40±1.14刺人参 2 组(0.23 %) ♀ 4.60±0.54 4.80±0.84 2.80±0.84♂ 4.90±0.54 5.80±0.84* 2.80±0.84刺人参3 组(0.12 %) ♀ 4.80±1.92 4.20±0.83 2.40±0.55♂ 4.60±1.14 4.40±1.14 2.80±1.00刺人参4 组(0.06 %) ♀ 5.00±1.58 5.00±0.71 3.20±0.84♂ 4.60±1.14 4.20±0.45 2.40±0.89
由表5 可知,与空白对照组相比,东北刺人参给药浓度为0.46%和0.23%的雄果蝇攀爬能力在第20 天显著增加(P<0.05);其余各组无显著性差异。
2.2.4 东北刺人参对果蝇繁殖能力的影响
东北刺人参对果蝇繁殖能力的影响见表6。
与空白对照组相比,给药后各组7 日和15 日蝇的子代数均呈不同程度增加,其中,给药浓度为0.46%组7 日龄果蝇的子代数增加有极显著意义(P<0.01);给药浓度为0.23%组7 日龄果蝇的子代数增加有极显著意义(P<0.01);给药各组15 日龄果蝇的子代数增加均有显著性差异(P<0.05);给药浓度0.46%和0.23%组的30 天蝇的子代数增加有显著差异(P<0.05)。
表6 东北刺人参对果蝇繁殖能力的影响(n=6,D)Table 6 Reproduction parameters in Drosophila following CRS supplement(n=6,D)
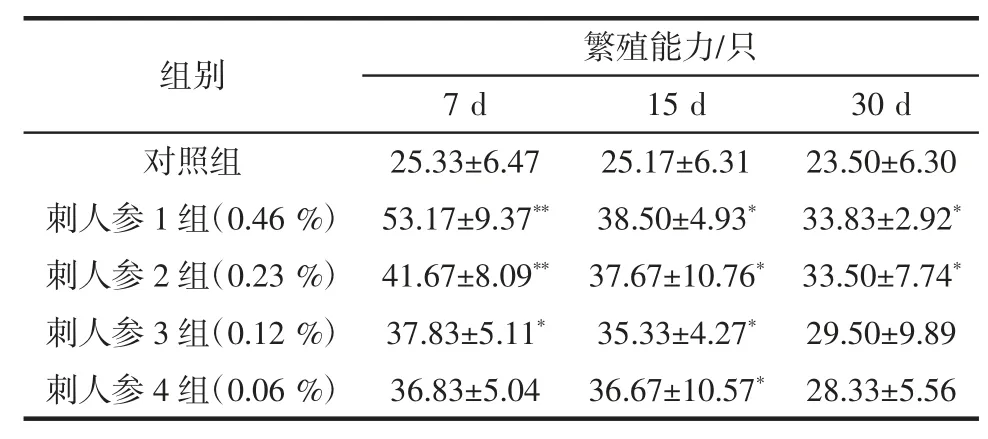
表6 东北刺人参对果蝇繁殖能力的影响(n=6,D)Table 6 Reproduction parameters in Drosophila following CRS supplement(n=6,D)
注:*P<0.05 与对照组相比差异显著,**P<0.01 与对照组相比差异极显著。
组别 繁殖能力/只7 d 15 d 30 d对照组 25.33±6.47 25.17±6.31 23.50±6.30刺人参 1 组(0.46 %) 53.17±9.37** 38.50±4.93* 33.83±2.92*刺人参 2 组(0.23 %) 41.67±8.09** 37.67±10.76* 33.50±7.74*刺人参 3 组(0.12 %) 37.83±5.11* 35.33±4.27* 29.50±9.89刺人参 4 组(0.06 %) 36.83±5.04 36.67±10.57* 28.33±5.56
2.3 刺人参对力竭游泳实验小鼠SOD含量和MDA活力的影响
刺人参对力竭游泳实验小鼠SOD 含量和MDA 活力的影响见表7。
表7 刺人参对小鼠SOD 和MDA 含量的影响(D)Table 7 Effects of Oplopanax elatus on MDA and SOD of mice(D)
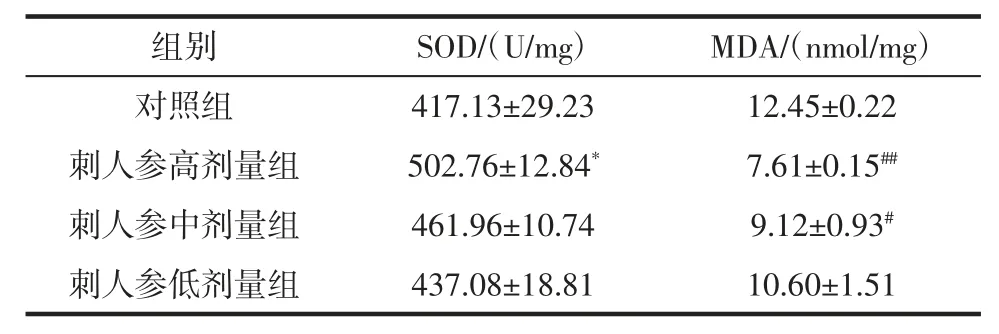
表7 刺人参对小鼠SOD 和MDA 含量的影响(D)Table 7 Effects of Oplopanax elatus on MDA and SOD of mice(D)
注:#P<0.05 与对照组相比差异显著;##P<0.01 与对照组相比差异极显著;*P<0.05 与对照组相比差异显著。
组别SOD/(U/mg)MDA/(nmol/mg)对照组 417.13±29.23 12.45±0.22刺人参高剂量组 502.76±12.84* 7.61±0.15##刺人参中剂量组 461.96±10.74 9.12±0.93#刺人参低剂量组 437.08±18.81 10.60±1.51
由表7 可知,与空白对照组相比,刺人参冻干粉高剂量组MDA 含量降低具有显著差异(P<0.01),中剂量组具有统计学意义(P<0.05)。同理,与空白对照组相比,刺人参冻干粉高剂量组SOD 活性升高有统计学意义(P<0.05),上述结果提示东北刺人参能清除在有氧条件下产生的超氧自由基,以阻止自由基被破坏,抑制过氧化物产生,具有抗氧化的作用。
3 结论
研究发现,活性氧自由基产生过多,可导致生物膜中的多种不饱和脂类发生超氧化,形成脂质过氧化物,从而引起细胞结构和功能破坏。氧化损伤不仅与多种疾病的发生有着密切相关,还会造成细胞变形、突变和死亡,是人类衰老的重要原因之一[13]。天然抗氧化剂因在疾病预防与治疗、延缓衰老过程中发挥重要作用而广为人知,欲验证这些天然抗氧化剂的生物活性,需采用体内外多种实验方法。本实验首先优化微板法测定DPPH 自由基清除率的条件,确定最佳反应时间为30 min,反应体积为1 ∶1,刺人参水煎液DPPH自由基清除率的IC50值为0.829 mg/mL,体外实验结果显示,刺人参具有显著的抗氧化活性。国内外研究发现[1,14],东北刺人参中主要含挥发油、皂苷、蒽醌、黄酮、脂肪酸、游离氨基酸等多种成分,其中酚类、多糖和皂苷类成分可能为抗氧化作用的有效成分。
果蝇作为一种真核多细胞生物,因其寿命短、繁殖力强,且其代谢、生理状况和生长发育等也同哺乳动物基本相似,是研究抗氧化及抗衰老药物的理想模型[15-16]。本实验选取果蝇为实验对象,分别考察不同浓度的东北刺人参对果蝇寿命相关行为学指标的影响。在考察寿命实验中,各给药组的果蝇平均寿命和最长寿命均有不同程度的延长,上述结果表明,长期服用东北刺人参具有延长寿命的作用,而此作用并未体现剂量依赖性。在繁殖能力实验中,给药后各组对果蝇的子代数均呈不同程度增加,由结果可知,东北刺人参具有改善果蝇生殖能力的作用,且呈现计量依赖性,而随着日龄增加果蝇子代数增加呈降低趋势,提示适量补充东北刺人参可提高果蝇的繁殖能力。已有文献报道[17-18],东北刺人参对糖代谢紊乱所致的小鼠亚急性衰老模型症状有逆转作用,与人参呈现相似的抗衰老作用。在体外抗氧化实验中,刺人参水煎液冻干粉在0.625 mg/mL~10.0 mg/mL 的浓度范围内,自由基清除率为42.2%~89.0%,生物活性和浓度成正相关,在体内亚急性氧化损伤实验中,不同浓度东北刺人参雌雄果蝇平均存活时间不同程度延长,此外,该药可降低力竭游泳实验小鼠MDA 含量,提高SOD 活力。因此,东北刺人参不仅在体外有一定的抗氧化作用,而且在动物体内也有显著的抗亚急性氧化损伤效果。
综上所述,东北刺人参可延长果蝇寿命,增加果蝇的子代数量,提高老年蝇的攀爬能力,提高老龄果蝇抗亚急性氧化损伤能力,并降低力竭游泳实验小鼠MDA 含量,提高SOD 活力,具有体内外抗氧化作用,并可改善果蝇与寿命相关的指标,上述研究结果可为东北刺人参的开发利用提供参考。

