蛹拟青霉发酵金针菇菇柄过程中主要活性物质及抗氧化活性的动态变化
朱蕴兰,陈宏伟,陈安徽,邵颖,李文,秦杰
(徐州工程学院食品(生物)工程学院,江苏省食品生物加工工程技术研究中心,江苏省食品资源开发与质量安全重点建设实验室,江苏徐州221111)
金针菇(Flammulina velutipes(Fr.)Sing)是人们熟知的一种食用菌,富含糖类、蛋白质、氨基酸、核苷酸、维生素和硒锌铁等微量元素,具有增强记忆力、促进发育、抗氧化、抗肿瘤、调节免疫、抗过敏等多种功能[1-9]。随着人们对金针菇的需求,其产量逐年递增,2016 年国内产量达到266.93 万吨,预计到2020 年将达到400万吨左右[10]。但金针菇在商品化出售之前,要做切根处理,产生的废菇柄每年可达30 万吨~35 万吨。这些废弃菇柄一般直接扔掉或被用作饲料,不但产生了环境污染问题同时还造成了资源浪费。已有研究表明金针菇菌脚蛋白质含量为17.02 g/100 g DW,氨基酸种类齐全,含有人体必需的18 种氨基酸,其氨基酸含量为59.81%,必需氨基酸含量占总氨基酸含量的40.27%[11],金针菇废菇柄多糖提取率可达11.09%[12],核苷酸提取率可达1.47%[13]。但目前对其深加工和商品化处理方面还未得到充分重视,目前对金针菇废菇柄的研究主要集中在活性物质蛋白质、膳食纤维、多糖、氨基酸和核苷酸等的提取方面[11,13-17],而利用废菇柄进行深加工的研究尚少[18],如何充分利用金针菇废菇柄资源和提高其科技含量增加其附加值,开发金针菇废菇柄产品具有重要的经济意义和深远的现实意义。
蛹拟青霉 (Paecilomyces militaris) 是蛹虫 草[Cordyceps militarise(L.)Link]的无性型,其菌丝体和发酵产物含有与蛹虫草相似的虫草多糖、虫草素、虫草酸等成分,具有增强免疫力、抗衰老、抗疲劳、降血脂、防止血栓形成,抗病毒、抗菌、护肝等作用[19-20]。蛹拟青霉具有较强的生物转化能力,利用其生理活动将发酵基质中的有效成分进行转化,产生新的成分,从而产生新的性质和功能,即双向固体发酵[21-22]。闫梅霞等[23]研究了蛹虫草固态发酵人参产物的有效成分含量,发现发酵人参须的多糖、蛋白质、总皂苷含量均高于发酵前。贺晓玉[24]研究了蛹虫草菌固体发酵五味子药渣工艺的优化及其产物对断奶仔猪,试验表明,发酵条件优化后的发酵产物中虫草素含量高达5.12 mg/g;多糖含量为2.87%,相比发酵前五味子药渣中多糖含量提高24.96%。彭志妮等[25]利用蛹虫草对大豆进行了固体发酵,研究了发酵菌质的抗氧化性变化,结果表明,发酵菌质在22 d 抗氧化性能达到最大,ABTS+自由基清除率比发酵初期提高近3 倍,亚铁还原能力(Ferric Reducing Ability of Plasma,FRAP)值提高近 2 倍。本研究以金针菇废菇柄为发酵基质,利用蛹拟青霉为发酵菌种,对金针菇菇柄进行转化,研究发酵菌质多糖、虫草素、虫草酸、蛋白质、氨基酸等活性物质及总还原力和发酵菌质对自由基的清除能力随发酵时间的变化情况,为进一步高值化综合利用蛹虫草和金针菇废菇柄,研发相关高附加值产品,减少环境污染提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
蛹拟青霉菌种:江苏省食品资源开发与质量安全重点建设实验室保藏;金针菇废菇柄:徐州康盛食用菌有限公司提供。
1.1.2 试剂
DL-丙氨酸、L-鼠李糖、醋酸铵、苯酚、蛋白胨、甘露醇、高碘酸钠、甲基红、磷酸二氢钾、磷酸氢二钠、硫酸钾、硫酸镁、硫酸铜、浓硫酸、硼酸、葡萄糖、氢氧化钠、无水乙醇、盐酸、乙醇(95%)、茚三酮、氯仿、正丁醇、虫草素、虫草酸、乙酸、三氯乙酸(均为分析纯):国药集团化学试剂有限公司;维生素B1、乙酰丙酮、蛋白胨、酵母浸出汁、琼脂粉(均为生物试剂):国药集团化学试剂有限公司。
NaIO4溶液:0.32 g NaIO4溶于 0.12 mol/L 的 HCl溶液中,定容至100 mL。
Nash 试剂:75 g 醋酸铵蒸馏水溶解,加1 mL 冰乙酸,1 mL 乙酰丙酮,定容至500 mL。
75 μmol/L 的 DPPH 溶液:称取 3 mg DPPH 用100 mL 乙醇溶解即可。
1.2 仪器与设备
CW-2000 型超声波微波协同萃取仪:新拓微波溶洋测试技术有限公司;TU-1810 型紫外可见分光光度计:北京普析通用仪器有限公司;HYGⅡ型回转式恒温调速摇瓶柜:上海欣蕊自动化有限公司;HH.BII.600型电热恒温培养箱:上海跃进医疗器械有限公司;101-0E 型电热恒温干燥箱:北京市永光明医疗仪器;HH-2 型数显恒温水浴锅、80-2 型台式电动离心机:常州国华电器有限公司;SW-CJ-2FD 型双人单面垂直净化工作台:上海博讯实业有限公司医疗设备厂;FW80型高速万能粉碎机:天津泰斯特仪器有限公司;FA2104N 型电子分析天平:上海精密仪器有限公司;SH220 石墨消解仪:海能仪器;LJG-18A 型冷冻干燥机:北京四环科学仪器厂;SHZ-D(III)循环水式真空泵:上海东玺制冷仪器设备有限公司;Heating Bath:SENCO Technology Co.,Ltd。
1.3 方法
1.3.1 培养基
1)斜面培养基——萨氏培养基(Sabouraud dextrose agar with yeast extract,SDAY):4%葡萄糖,1 %蛋白胨,1%酵母浸膏,2%琼脂。
2)液体种子培养基:葡萄糖2%,酵母膏0.5%,蛋白胨0.5 %,KH2PO40.2 %,硫酸镁0.1 %,维生素B110 mg/L,蒸馏水 1 000 mL,pH6.8。
3)发酵培养基:金针菇废菇柄段95 g,蛋白胨0.5 g,水 5%,pH 6.8;
1.3.2 菌种活化与种子液制备
将蛹拟青霉菌种接种到SDAY 斜面培养基上,置于22 ℃恒温箱中培养3 d~5 d,待菌丝长满试管即可。
种子液制备:在500 mL 三角瓶中装200 mL 液体种子培养基,经灭菌后接入经活化后的蛹拟青霉斜面菌块 3 块~5 块,每块大小为 3 mm2~5 mm2,22 ℃,120 r/min 恒温摇瓶培养 3 d~6 d 即可。
1.3.3 固态发酵
料液比 1 ∶1.5(g/mL);料层厚度 2 cm;接种量15 %;发酵温度22 ℃;新鲜金针菇废菇柄切成0.5 cm段,并按试验设计添加其它成分,灭菌后接入发酵菌种,置于恒温箱中培养,定时取样,冷冻干燥后粉碎,过40 目筛子后备用。
空白对照处理:取切成0.5 cm 段的新鲜金针菇废菇柄,加质量分数为0.5%的蛋白胨,料液比1∶1.5(g/mL),料层厚度2 cm,pH 6.8,灭菌后不接种,置于22 ℃培养箱中培养,按样品处理方法进行处理并测定。
1.3.4 多糖的测定
1.3.4.1 多糖的提取
采用超声-微波协同辅助提取方法,按文献[26]进行。精密称取0.5 g 样品粉末,加50 mL 水,混匀,用超声波微波协同萃取仪提取20 min,然后4 000 r/min 离心10 min,取上清液,沉淀加水按上述方法重复提取3 次,合并上清液,将上清液浓缩至1/3。向浓缩过的上清液中加入等体积的氯仿-正丁醇4 ∶1(体积比)混合液,震动摇晃20 min~30 min,静置后去掉沉淀,重复3次,留取上层水相。向留取水相中加入3 倍95%乙醇,放入 4 ℃冰箱静置 12 h,4 000 r/min 离心 10 min,得到沉淀,然后再将沉淀加入100 mL 的蒸馏水复溶,取1 mL 复溶的多糖溶液于50 mL 容量瓶中定容,备用。
1.3.4.2 多糖的测定
采用苯酚-硫酸法测定。
1)标准曲线制作
取不同浓度的葡萄糖标准液各2 mL,分别加入6 %的苯酚溶液1.0 mL,摇匀,迅速加入5.0 mL 浓硫酸,摇匀,静置5 min。置沸水浴中加热15 min,取出冷却至室温,用紫外可见分光光度计在490 nm 下测定其吸光度。
用葡萄糖浓度作为横坐标,A490nm作为纵坐标,绘制葡萄糖标准曲线,并建立回归方程。
2)样品多糖含量的测定
精密吸取样品处理液1 mL,置于试管中,加蒸馏水至2 mL。按标准曲线制作步骤进行处理,用紫外可见分光光度计在490 nm 下测定其吸光度,以空白校正零点。
1.3.4.3 多糖含量计算

1.3.5 虫草素含量测定
采用高压液相色谱法,按文献[27]方法测定。色谱柱:Waters C18(4.6 mm× 150 mm,5 μm);流动相:15%甲醇+水;流速 1 mL/min;柱温:20 ℃;紫外检测波长260 nm,10 μL 进样。
标曲制作:精密称取虫草素标准品1 mg,用纯水定容于5 mL 容量瓶中,配制成0.2 mg/mL 的虫草素标准品溶液,作为母液进行所需浓度的标准品配置。釆用逐级稀释法,依次吸取一定量浓度的标准品溶液按要求稀释到EP 管中,使虫草素浓度分别为150、100、50、25、0 μg/mL。分别吸取上述溶液,在上述色谱条件下进行测定,记录12.439 min 时色谱波峰呈现的峰面积。并求虫草素浓度和峰面积标准曲线和回归方程。
样品测定:精确称取1 g 冻干发酵菌质粉溶于100 mL 50%的乙醇,选用微波-超声波协同萃取仪提取虫草素。微波时间为60 s,功率为200 W,提取后离心,用 0.2 μm 水相微孔滤膜压滤,取过滤液 10 μL 进样分析,以标准品的保留时间定性、外标法定样,根据回归方程计算提取液的虫草素含量(μg/mL),并按公式计算得出样品中的虫草素含量。

1.3.6 虫草酸含量测定
采用比色法测定。按文献[28]进行。
样品虫草酸提取:精密称取0.5 g 样品粉末,加50 mL 70%乙醇,混匀,用微波-超声波协同萃取仪常温下微波萃取80 s,然后离心取上清液,重复提取2 次,合并提取液,混匀,提取液用蒸馏水定溶至100 mL,待测。
标准曲线制作:取浓度为0.05 mg/mL 的甘露醇标准溶液 0、0.2、0.4、0.6、0.8、1.0 mL,分别用蒸馏水补充至1 mL,然后分别加入1 mL NaIO4溶液,混匀后,静止10 min,再加入2 mL 1.0 g/L L-鼠李糖溶液,充分混匀后加入Nash 试剂4 mL,50 ℃水浴保温15 min,取出后快速冷却至室温,用10 mm 光程的比色皿,在412 nm波长下测量吸光度,以虫草酸标准品浓度为横坐标,以吸光值为纵坐标绘制标准曲线,并计算回归方程。
样品测定:精密量取待测样品溶液0.03 mL,加入10 mL 刻度试管中,补水至1 mL,空白对照管加蒸馏水1 mL,然后按标准曲线制作方法进行,测定其吸光度。虫草酸含量按公式计算。

1.3.7 蛋白质含量测定
采用凯氏定氮法测定,按文献[27]方法进行。
蛋白质含量(g)=[总氮含量(g)-非蛋白氮含量(g)]×6.25
总氮含量计算:

式中:x 为样品中氮含量,g/100 g;V1为样品滴定消耗盐酸标准溶液体积,mL;V2为空白滴定消耗盐酸标准溶液体积,mL;V3为测定样品时消化液的体积,mL;c 为盐酸标准滴定溶液浓度,mol/L;14.008 为每摩尔氮原子质量,g/mol;m 为样品的质量,g。
非蛋白氮含量测定:采用三氯乙酸法测定非蛋白氮。按文献[27]方法进行。
1.3.8 氨基酸含量测定
采用茚三酮比色法,按文献[27]方法进行测定。
氨基酸含量的计算:

1.3.9 总还原力测定
按文献[29]方法进行。
发酵菌质预处理:取发酵菌质粉末5 g 加入三角瓶中,加水50 mL,超声波提取30 min,4 000 r/min 离心10 min,取上清液,定容至50 mL,备用。
还原力测定方法:采用铁氰化钾法测总还原力。向试管中依次加入2.5 mL pH 6.6 的磷酸盐缓冲液,待测样品0.5 mL,1%铁氰化钾溶液2.5 mL,混合后50 ℃水浴30 min,迅速冷却后加入10%三氯乙酸2.5 mL,混匀后3 000 r/min 离心10 min,取上清液2.5 mL 加入蒸馏水2.5 mL 和FeCl30.1%溶液0.5 mL,静止10 min,在波长为700 nm 下测定溶液吸光值,用吸光值表示还原力,吸光值越大还原力越强。

式中:A样品是样品反应液的吸光值;A空白是以去离子水代替样品的溶液的吸光值。
1.3.10 DPPH 自由基清除能力测定
DPPH 自由基清除能力测定按文献[30]方法进行。精确称取1 g 冻干菌质粉溶于100 mL 50 %的乙醇,用微波-超声波协同萃取仪微波提取60 s,功率为200 W,4 000 r/min 离心5 min 后取上清液,定容至100 mL,然后取1 mL 定容到10 mL 容量瓶中,待测。
取待测样品0.3 mL 于10 mL 试管中,加入0.2 mL的乙醇溶液,2.5 mL 的DPPH 溶液混合,置于暗处30 min,在517 nm 波长下测定吸光度,根据下列公式计算各样品溶液对DPPH 自由基的清除率:

式中:A 为加样品溶液与DPPH 溶液的吸光度;A0为不加样品溶液的DPPH 溶液的吸光度;B 为不加DPPH 溶液的样品溶液。
1.4 数据处理
试验数据均为3 次重复试验所得的平均值,结果表示为平均值±标准偏差。用Design-Expert 8.0.6.1 软件进行数据统计分析。
2 结果与分析
2.1 发酵菌质多糖含量的动态变化
根据测定葡萄糖含量标准曲线回归方程为:y =0.067x-0.043,R2=0.992,y 为 490 nm 下吸光度值,x 为葡萄糖浓度(mg/mL)。
经测定和计算得发酵菌质中多糖含量随发酵时间的变化情况如图1 所示。

图1 不同时间发酵菌质中多糖含量Fig.1 The contents of polysaccharide in fermentation mycoplasm at different times
从图1 可以看出,蛹拟青霉与金针菇废菇柄进行固体发酵过程中,发酵菌质多糖含量出现先降低然后升高最后平稳降低的趋势,这与其发酵过程中多糖的先期被降解利用有关,在发酵初期多糖被分解成小分子物质,以便合成蛹拟青霉菌体生长所需的物质,中期由于蛹拟青霉自身的合成作用使多糖含量增加,后期由于菌体生长缓慢或到达衰亡期,使多糖不能继续合成,而使多糖含量有所减少。当发酵28 d 时,发酵菌质中多糖含量达到最高为717.68 mg/g,此时发酵菌质多糖含量是对照组多糖含量的1.92 倍。试验组与对照组比较可知,对照组多糖基本没有发生变化,且含量较低,经方差分析,试验组和对照组多糖的含量变化具有显著差异(p<0.01)。
2.2 发酵菌质虫草素含量的动态变化
根据测定虫草素含量标准曲线回归方程为:y =41.42x+92.33,R2=0.997,y 为 260 nm 下 12.439 min 峰面积,x 为虫草素浓度(μg/mL)。
经测定和计算得发酵菌质中虫草素含量随发酵时间的变化情况如图2 所示。

图2 不同时间发酵菌质中虫草素含量Fig.2 The contents of cordycepin in fermentation mycoplasm at different times
从图2 可以看出发酵菌质中试验组的虫草素含量随发酵时间增加不断增加,当发酵时间为28 d 时,虫草素含量达到最大为90.9 μg/g,之后开始下降,而对照组无虫草素产生。方差分析表明试与对照组存在显著差异(p<0.01)。试验表明虫草素含量的变化与发酵菌质中蛹拟青霉菌体的生长量相关,随着培养时间的延长,菌体数量不断增加,当到达最大生长点后,开始下降,符合蛹拟青霉菌体的生长规律,其产生的虫草素也是与蛹拟青霉菌体量分不开的,虫草素的产生必定伴随着蛹虫草菌体代谢量的增多,后期含量减少可能是由于虫草素不稳定,产生分解所致。
2.3 发酵菌质虫草酸含量的动态变化
经测定虫草酸含量标准曲线的回归方程为:y=0.009 8x+0.015 3,R2=0.995 3,y 为 412 nm 下吸光度值,x 为虫草酸浓度(μg/mL)。
经测定和计算得发酵菌质中虫草酸含量如图3 所示。

图3 不同时间发酵菌质中虫草酸含量Fig.3 The contents of cordycepic acid in fermentation mycoplasm at different times
从图3 可知,试验组发酵菌质中虫草酸含量随发酵时间增加而增加,然后开始下降,当发酵28 d 时,虫草酸含量达到最大为25.6 mg/g,是对照组虫草酸含量的2.34 倍,对照组虫草酸含量基本保持不变,经方差分析两者具有显著差异(p<0.01)。虫草酸含量随发酵时间的变化情况与蛹拟青霉菌体生长规律相似,表明了虫草酸的产生与蛹拟青霉菌体的代谢有关,后期含量减少可能是由于菌体代谢物质不足,而将其分解作为代谢物质进行利用所致。
2.4 发酵菌质蛋白质含量的动态变化
经测定和计算得发酵菌质中蛋白质含量随时间变化情况如图4。

图4 不同时间发酵菌质中蛋白质含量Fig.4 The contents of protein in fermentation mycoplasm at different times
从图4 可知,试验组发酵菌质的蛋白质含量变化较大,蛋白质含量出现先降低再升高,然后下降,最后平稳的走势,组间具有显著差异(p<0.01),而对照组蛋白质含量变化不明显(p>0.01)。试验组与对照组间具有明显著差异(p<0.01)。当发酵21 d 时试验组蛋白质含量达到最高396.6 mg/g,是对照组的2.39 倍。试验组出现蛋白质含量的先期下降,然后升高,接着出现下降至平稳的趋势,表明培养初期蛋白质被分解,以便蛹拟青霉菌体的生长,出现蛋白质含量下降的走势,但随着时间的增加,蛹拟青霉菌体开始生长,蛋白合成能力增加,使发酵菌质蛋白含量增加,当达到菌体稳定期时,蛋白达到最高,然后菌体进入衰亡期,使自身蛋白分解,表现出蛋白含量逐渐降低的趋势。
2.5 发酵菌质氨基酸含量的动态变化
经试验测得氨基酸的标准曲线如图5,其回归方程为:y=0.060 4x+0.060 5,R2=0.991 3。y 为吸光度值,x为氨基酸浓度(μg/mL)。
发酵菌质中氨基酸含量如图5 所示。
从图5 可知,试验组氨基酸含量在发酵24 d 时达到最高为230.88 mg/g,是对照组的4.52 倍。试验组氨基酸含量出现随发酵时间增加而增加,然后达到最高点后开始降低,而对照组的氨基酸含量基本保持不变。试验组氨基酸含量从培养初期就逐渐开始增加,表明蛹拟青霉菌体代谢分解了金针菇菇柄的组成蛋白质产生了氨基酸用于自身的合成代谢,当金针菇菇柄成分被分解完后达到平衡,后期由于蛹拟青霉的合成代谢活动使氨基酸含量不断减少。
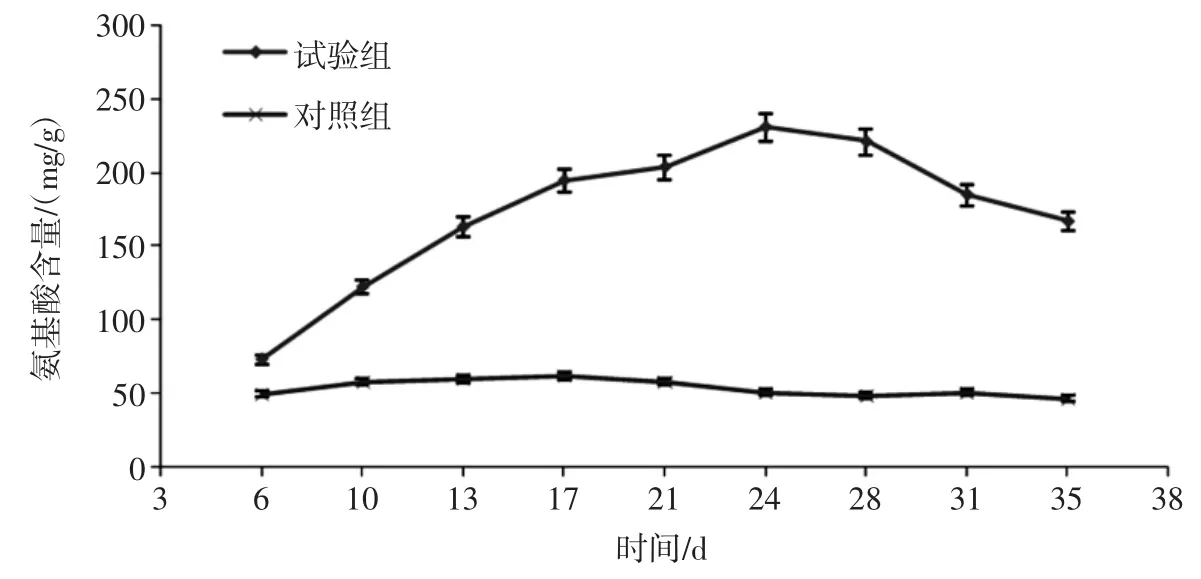
图5 不同时间发酵菌质中氨基酸含量Fig.5 The contents of amino acid in fermentation mycoplasm at different times
2.6 发酵菌质总还原力的动态变化
在不同发酵时间发酵菌质还原力变化情况如图6。

图6 不同时间发酵菌质还原力Fig.6 The reducing ability of fermentation mycoplasm in different time
从图6 分析可知,不同时间的发酵菌质还原力有显著变化(p<0.01),在开始阶段比较低,然后逐渐升高,在21 d 到28 d 期间达到最高,然后随着发酵时间的延长还原力出现了缓慢降低。而对照组的还原力没有发生显著变化(p>0.05)。试验组还原力大小出现的变化情况,与多糖和虫草素含量的变化情况基本一致,可以认定还原力主要是由多糖和虫草素产生的。
2.7 发酵菌质对DPPH自由基清除能力的变化
发酵菌质在不同发酵时间对DPPH 自由基清除能力的变化情况如图7。

图7 发酵菌质对DPPH 自由基的清除能力Fig.7 The capacity to scavenging DPPH free radical
从图7 可以看出,金针菇菇柄发酵菌质对DPPH自由基的清除能力表现为发酵初期有所降低,中期逐步增强,后期略有降低的趋势(p<0.01),而对照组基本保持平稳(p>0.05)。对DPPH 自由基的清除能力在发酵28 d 最高达到72.37%,比未发酵菌质清除DPPH自由基的能力提高了59.5%,方差分析表明两者有极显著差异(p<0.01)。对DPPH 自由基有清除能力的物质主要是多糖和虫草素,从发酵菌质多糖和虫草素的含量来看,在28 d 也是达到了最高,清除自由基能力与虫草素和多糖含量有关。
3 结论
通过对蛹拟青霉对金针菇废菇柄进行固体发酵过程中发酵菌质的活性物质在不同培养时间的动态变化研究表明,发酵菌质中活性物质出现了峰谷变化,在发酵中期随着时间的增加物质含量逐渐增加,与未发酵的金针菇菌质相比,主要成分和抗氧化能力均有大幅度增加,两者具有显著差异。各种活性物质达到最大的发酵时间略有不同,多糖、虫草素、虫草酸的含量均在28 d 达到最高,蛋白质和氨基酸含量最高的发酵时间分别是21 d 和24 d。发酵菌质的抗氧化能力在21 d~28 d 之间达到最高,对DPPH 的清除能力在28 d 达到最高,发酵菌质的活性物质变化与蛹拟青霉的菌体生长量有相关性。发酵菌质的抗氧化能力变化与活性物质含量变化有关。本研究为进一步探讨蛹拟青霉对金针菇废菇柄的发酵规律和进一步研究开发高值化蛹拟青霉及金针菇菇柄产品提供了理论依据。

