嗜热酸性普鲁兰水解酶Ⅲ的高效分泌表达及其酶学性质
曾 静,郭建军,袁 林
(江西省科学院微生物研究所,江西南昌 330096)
淀粉是自然界含量丰富的高分子聚糖,是各种生物的重要能量来源,也是一种重要的工业原材料[1-2]。在淀粉酶法制糖工业中,淀粉首先经过α-淀粉酶水解,淀粉内部的α-1,4-糖苷键被随机切断,淀粉由高聚糖水解为低聚糖,该过程称为液化步骤[3-4]。液化步骤产生的低聚糖随后在β-淀粉酶、葡萄糖淀粉酶和异淀粉酶以及普鲁兰酶的作用下,残留的支链α-1,6-糖苷键和直链α-1,4-糖苷键被进一步水解,最终形成葡萄糖浆,该过程称为糖化步骤[5-6]。淀粉的液化步骤在95~105 ℃、pH6.0下进行,糖化步骤条件则通常为60 ℃、pH4.5~5.5,由液化转入糖化时需要降低温度并加酸降低糖浆的pH,并且糖化过程中使用了多种水解酶[7-9]。这些因素使得淀粉制糖的生产成本增加,同时降低了生产效率。若某种淀粉酶在液化条件下可以同时进行糖化,则既可以省去加酸碱调节pH的过程以简化工艺、降低成本,又可以有效地防止微生物污染,并且在液化的高温下,还可以获得较高的反应速率。因此,人们希望将液化过程和糖化过程合并,能够获得一种在液化条件下具有较强的水解α-1,4-糖苷键和α-1,6-糖苷键能力的淀粉酶。
来源于极端嗜热古生菌Thermococcuskodakarensis的嗜热酸性普鲁兰水解酶Ⅲ Tk-PUL是同时具有α-淀粉酶活性和普鲁兰酶活性的双功能酶[10-13]。Tk-PUL是目前报道的水解活性最高的普鲁兰水解酶Ⅲ,并且Tk-PUL的酶学性质(如热稳定、低pH、不依赖于Ca2+)使得其适用于淀粉酶法制糖工业[14]。Tk-PUL可同时水解α-1,4-糖苷键和α-1,6-糖苷键,能够在高温的液化条件下进行糖化作用,可使淀粉制糖的糖化过程和液化过程合二为一,大大降低淀粉酶法制糖工业的生产成本,并提高生产效率。因此,嗜热酸性普鲁兰水解酶Ⅲ Tk-PUL在淀粉酶法制糖工业中具有巨大的应用潜力。目前Tk-PUL已在大肠杆菌表达系统中进行表达,重组Tk-PUL主要位于胞内可溶成分中,从重组大肠杆菌中获取Tk-PUL的纯化过程复杂。另外大肠杆菌属于革兰氏阴性菌,其外膜成分中含有脂多糖。脂多糖会对人和动物的健康产生不利影响,食品和制药工业的最终产品中不能含有脂多糖,而去除脂多糖使得下游纯化过程变得复杂,同时也增加了重组酶的生产成本。因此,为利于Tk-PUL在制糖工业中的应用,需选用其他合适的表达系统来获取重组Tk-PUL。枯草芽孢杆菌作为传统的工业生产菌株,具有分泌表达能力强、培养条件和基因操作简单、发酵工艺成熟等优点,被认为是理想的外源蛋白质的分泌表达宿主菌[15-17]。利用枯草芽孢杆菌表达系统的优越性,同时结合其自身信号肽,构建分泌表达系统,可以实现外源蛋白质的分泌表达。
本研究通过构建Tk-PUL在枯草芽孢杆菌表达系统中的信号肽筛选库,并结合高通量筛选方法,实现Tk-PUL在枯草芽孢杆菌表达系统中的高效分泌表达。在此基础上,对Tk-PUL的酶学性质进行初步研究,为其在淀粉酶法制糖工业中的应用奠定基础。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌BacillussubtilisRIK1285、重组质粒pET26b-tkpul 由本实验室保存;LB培养基:蛋白胨10.0 g、酵母粉5.0 g、NaCl 5.0 g、蒸馏水1 L 环凯生物科技有限公司;KOD-Plus-neo DNA聚合酶 日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、蛋白质Marker 美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 美国Omega Bio-tek公司;BacillussubtilisSecretory Protein Expression System Cat.#3380(枯草芽孢杆菌蛋白质分泌表达试剂盒Cat.#3380)、In-Fusion® HD Cloning kit(In-Fusion® HD克隆试剂盒) 日本Takara公司;Chelating SepharoseTMFast Flow、Chelating SepharoseTMFast Flow 美国GE Healthcare公司;Bradford法蛋白浓度测定试剂盒 上海生工生物工程股份有限公司;实验所用试剂(均为分析纯) 国药集团化学试剂有限公司。
Mastercycler gradient PCR仪 美国Eppendorf公司;TY04S-3C凝胶成像系统 北京君意东方电泳设备有限公司;SCIENTZ-ⅡD超声波细胞破碎仪 宁波新芝生物科技股份有限公司;SP-752PC紫外可见分光光度计 上海光谱仪器有限公司;Agilent 7500ce 美国Agilent公司;iMark 酶标仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 分子克隆技术和表达产物的聚丙烯酰胺凝胶电泳(Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分析 分子克隆技术和表达产物的SDS-PAGE分析参照文献[18]进行。
1.2.2 Tk-PUL分泌表达信号肽筛选库的构建 基于tkpul的碱基序列,设计引物P1和P2(表1),以重组质粒pET26b-tkpul为模板,扩增基因tkpul中不含信号肽的结构基因tkpulds。PCR扩增条件为:98 ℃变性5 min;98 ℃变性20 s,60 ℃退火20 s,74 ℃延伸2 min,30个循环;74 ℃延伸10 min。扩增产物经NdeI和XbaI双酶切,连接至载体pBE-S,构建重组质粒pBE-S-tkpulds。按照BacillussubtilisSecretory Protein Expression System Cat.#3380(枯草芽孢杆菌蛋白质分泌表达试剂盒Cat.#3380)的说明书设计引物M1和E1(表1),以重组质粒pBE-S-tkpulds为模板,进行PCR扩增,实现重组质粒pBE-S-tkpulds的线性化。采用In-Fusion® HD Cloning kit(In-Fusion® HD克隆试剂盒)连接线性化DNA和枯草芽孢杆菌蛋白质分泌表达试剂盒中SP DNA混合物,并将连接产物转化枯草芽孢杆菌蛋白质分泌表达试剂盒中StellarTM感受态细胞,将转化产物全部涂布于含100 μg/mL氨苄青霉素的LB固体平板上,于37 ℃过夜培养。收集LB固体平板上所有转化子,提取其中所含重组质粒。将所获得的重组质粒转化BacillussubtilisRIK1285,BacillussubtilisRIK1285感受态细胞的制备和转化采用改进的Spizizen法[19]进行。将转化子涂布于含10 μg/mL卡那霉素的LB固体平板上,于37 ℃过夜培养,即获得Tk-PUL分泌表达信号肽筛选库。

表1 构建重组质粒所用引物Table 1 Primer sequences for the construction of recombinant plasmids
注:下划线标注的部分为限制性酶切割位点。
1.2.3 Tk-PUL分泌表达信号肽筛选库的高通量培养 取灭菌、烘干的96孔深孔板,每孔加入LB培养基500 μL。用10 μL移液枪扎取枪头后挑取单菌落,转移到培养孔中轻轻洗吹几次,弃掉枪头,依次反复直至挑选结束。盖上盖子,于摇床中37 ℃、230 r/min过夜活化。用 8通道移液器按照顺序将活化后的种子液转接至48 孔深孔板中,接种量为3%。盖上盖子,摇床中37 ℃、230 r/min开始发酵,培养时间为30 h。
1.2.4α-淀粉酶活性和普鲁兰酶活性的高通量检测 将发酵后的48 孔深孔板于4 ℃下4000 r/min离心10 min,离心后的上清用于α-淀粉酶活性和普鲁兰酶活性的高通量检测。取灭菌、烘干的96孔深孔板,每孔加入100 μL发酵液上清,然后加入100 μL反应底物(1%可溶性淀粉或1%普鲁兰糖),于100 ℃反应10 min后,向其中补加300 μL DNS[20]并沸水浴反应10 min后,转移至冰水浴中快速冷却。取洁净的酶标板加入150 μL无菌水和50 μL反应液并混匀,用酶标仪测定540 nm下的吸光值[10]。吸光值的大小反映胞外Tk-PUL分泌量的多少。
1.2.5 Tk-PUL分泌表达信号肽的鉴定 选取Tk-PUL分泌表达信号肽,筛选库中α-淀粉酶活性和普鲁兰酶活性均较高的克隆子,设计引物P3和P4(表1)进行菌落PCR,并将获得的DNA片段送至上海生工生物工程股份有限公司进行测序,将测序结果在NCBI网站上进行Blast搜索,确定每个克隆子所对应的信号肽名称。
1.2.6 Tk-PUL在枯草芽孢杆菌表达系统中的分泌表达和纯化 接种重组枯草芽孢杆菌单克隆到LB液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为20 mL,培养温度为37 ℃,转速为200 r/min,培养时间为10 h。然后转接该培养物于新鲜LB液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为25 mL,接种量为3%,培养温度为37 ℃,转速为200 r/min,培养时间为30 h。
采用Ni2+亲和层析柱对发酵上清液中目的蛋白质进行纯化,用250 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的重组酶。利用SDS-PAGE检测重组酶的纯度,采用活性印记分析[21]检测重组酶的α-淀粉酶酶活和普鲁兰酶酶活,并采用Bradford法[22]测定重组酶的浓度。
1.2.7 Tk-PUL的酶学性质分析
1.2.7.1α-淀粉酶活性测定和普鲁兰酶活性测定 将10 μL纯化后酶液与190 μL 含1%(W/V)可溶性淀粉或普鲁兰糖的50 mmol/L MES-NaOH,pH4.5缓冲液混合,于100 ℃反应10 min后,用3,5-二硝基水杨酸(DNS)法测定反应体系中还原糖量。酶活力单位(U)定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个U。
1.2.7.2 酶的最适反应pH测定 将酶液与不同pH的底物混合,于100 ℃下测定不同pH下α-淀粉酶酶活和普鲁兰酶酶活。将所测得的最高酶活定义为100%,并以相对酶活的百分比对pH作图,确定其最适反应pH。采用不同缓冲液配制不同pH的底物:50 mmol/L MES(pH3.0~7.0)、50 mmol/L MOPS(pH7.0~9.0)。
1.2.7.3 酶的最适反应温度测定 按照上述反应体系混合酶液和底物,分别于40~110 ℃反应10 min,测定不同温度下α-淀粉酶酶活和普鲁兰酶酶活,并以对比酶活力温度作图,确定其最适反应温度。其中,40~95 ℃范围内的反应于水浴中进行,100~110 ℃范围内的反应于甘油浴中进行。高温条件下测定酶活性时,反应样品置于O型环螺旋盖密封管内,以防止水分蒸发。
1.2.7.4 酶的热稳定性测定 在50 mmol/L MES-NaOH,pH4.5缓冲液中,酶液于100 ℃保温,分时间梯度取出部分样品,根据如上反应体系测定α-淀粉酶活性和普鲁兰酶活性。将未处理的酶液的酶活定义为100%,并以相对酶活的百分比对时间作图,评价酶的热稳定性。
1.2.7.5 酶的动力学常数测定 用50 mmol/L MES-NaOH,pH4.5缓冲液配制不同浓度的底物,分别向不同浓度底物中加入等量的酶液,按照如上反应体系测定酶活。根据双倒数作图法以底物浓度的倒数为横坐标,以比酶活力的倒数为纵坐标作图,直线的斜率为Km/Vmax,截距为1/Vmax,计算以可溶性淀粉为底物时的米氏常数Km、最大反应速度Vmax和反应常数kcat。可溶性淀粉的浓度梯度设定为5.0、10.0、15.0、20.0、30.0、35.0 mg/mL;普鲁兰糖的浓度梯度设定为1.6、3.2、6.4、12.8、16.0、20.0 mg/mL。
1.3 数据处理

2 结果与分析
2.1 Tk-PUL分泌表达信号肽筛选库的高通量筛选
枯草芽孢杆菌是理想的外源蛋白质的分泌表达宿主菌[16],外源蛋白质在枯草芽孢杆菌表达系统中的分泌表达依赖于枯草芽孢杆菌信号肽的引导,并且信号肽与外源蛋白质之间存在适配性。因此针对特定的蛋白质需要选择合适的信号肽来实现有效地分泌表达[23-25]。目前尚无法预测哪种信号肽能够高效引导目的蛋白质分泌到胞外,只能通过实验手段从大量信号肽中筛选得到高效引导目的蛋白质分泌到胞外的信号肽。
本研究基于以下三点探索了Tk-PUL在枯草芽孢杆菌中高效分泌表达的条件:首先构建了引导Tk-PUL分泌表达的信号肽筛选库;其次将摇瓶的发酵参数引入至深孔板水平,建立了基于深孔板的高通量培养技术;再次将常规的α-淀粉酶活性和普鲁兰酶活性测定方法移植于96孔深孔板中,建立了α-淀粉酶活性和普鲁兰酶活性的高通量检测方法,并与高通量培养技术偶联建立了信号肽筛选库的高通量筛选方法。
本研究构建Tk-PUL在枯草芽孢杆菌表达系统中分泌表达的信号肽筛选库,共获得475个克隆子,对这475个克隆子进行胞外上清液的α-淀粉酶活性和普鲁兰酶活性检测,实现信号肽筛选库的初筛。从以上475克隆子选取其中酶活较高的50个克隆子,并对其进行复筛,这50个克隆子的α-淀粉酶活性和普鲁兰酶活性检测结果如图1~图5所示。对于1~50号克隆子,其α-淀粉酶活性和普鲁兰酶活性之间存在一定的倍数关系,普鲁兰酶活性约为α-淀粉酶活性的2倍。此外,30号克隆子具有最高的α-淀粉酶活性和普鲁兰酶活性,这表明30号克隆子的胞外重组酶分泌量最高。选取胞外上清液α-淀粉酶活性和普鲁兰酶活性较高的克隆子进行信号肽的进一步鉴定。
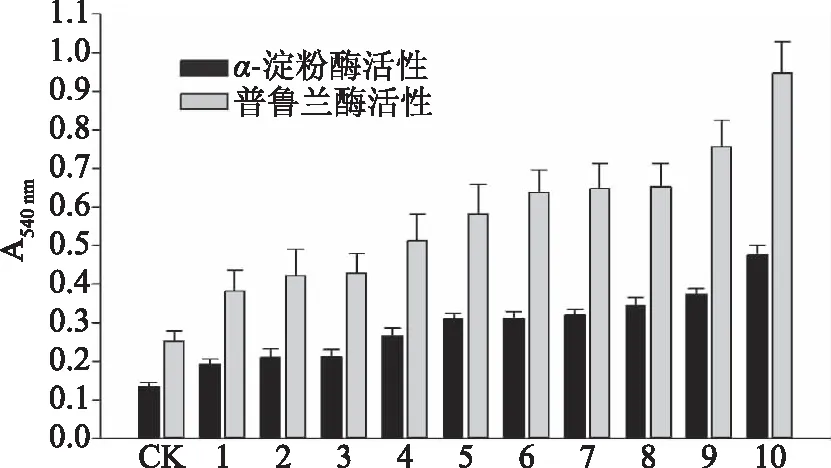
图1 Tk-PUL分泌表达信号肽筛选克隆子的 酶活检测结果(1~10号克隆子)Fig.1 Enzyme activity detection results of secretory expression signal peptide screening clones of Tk-PUL(clones number 1~10)

图2 Tk-PUL分泌表达信号肽筛选克隆子的 酶活检测结果(11~20号克隆子)Fig.2 Enzyme activity detection results of secretory expression signal peptide screening clones of Tk-PUL(clones number 11~20)

图3 Tk-PUL分泌表达信号肽筛选克隆子的 酶活检测结果(21~30号克隆子)Fig.3 Enzyme activity detection results of secretory expression signal peptide screening clones of Tk-PUL(clones number 21~30)

图4 Tk-PUL分泌表达信号肽筛选克隆子的 酶活检测结果(31~40号克隆子)Fig.4 Enzyme activity detection results of secretory expression signal peptide screening clones of Tk-PUL(clones number 31~40)

图5 Tk-PUL分泌表达信号肽筛选克隆子的 酶活检测结果(41~50号克隆子)Fig.5 Enzyme activity detection results of secretory expression signal peptide screening clones of Tk-PUL(clones number 41~50)
2.2 Tk-PUL分泌表达信号肽的鉴定
从Tk-PUL分泌表达信号肽筛选库中选取酶活高的10个克隆子(9号、10号、20号、29号、30号、39号、40号、48号、49号、50号),采用引物P3和P4进行菌落PCR,并将获得的DNA片段(如图6所示)送至上海生工生物工程股份有限公司进行测序,将测序结果在NCBI网站上进行Blast搜索,确定每个克隆子所对应的信号肽名称。其中9号克隆子对应的信号肽为BglC,10号和30号克隆子对应的信号肽为AmyE,20号、39号和48号克隆子对应的信号肽为Mpr,29号克隆子对应的信号肽为NprE,40号、49号和50号克隆子对应的信号肽为Bpr。结合以上克隆子的胞外α-淀粉酶活性和普鲁兰酶活性检测结果,即30号克隆子具有最高的α-淀粉酶活性和普鲁兰酶活性,10号克隆子次之,可以得出以下结论:针对于Tk-PUL,信号肽AmyE的引导分泌效率最高。

图6 信号肽筛选克隆子的PCR鉴定Fig.6 PCR identification of signal peptide screening clones
注:M. DL2000 ladder;1.9号克隆子;2.10号克隆子;3.20号克隆子;4.29号克隆子;5.30号克隆子;6.39号克隆子;6.40号克隆子;8.48号克隆子;9.49号克隆子;10. 50号克隆子;11.转化重组质粒pBE-S-tkpulds的重组枯草芽孢杆菌。
2.3 重组Tk-PUL的分泌表达与纯化
接种30号克隆子的单克隆到LB液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为20 mL,培养温度为37 ℃,转速为230 r/min,培养时间为10 h。然后转接该培养物于新鲜LB液体培养基中,用250 mL三角瓶进行培养,发酵培养时间为30 h。待发酵结束后,对发酵上清液进行α-淀粉酶活性和普鲁兰酶活性检测。酶活测定结果显示,重组枯草芽孢杆菌的胞外α-淀粉酶活力为29.1 U/mL,胞外普鲁兰酶活力为53.5 U/mL。
采用Ni2+亲和层析柱对发酵上清液中目的蛋白质进行纯化,用200 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的重组酶。利用SDS-PAGE检测重组酶的纯度,并采用活性印记分析检测重组酶的α-淀粉酶活性和普鲁兰酶活性,结果如图7所示。Tk-PUL的分子量约为86 kDa,并且活性印记分析结果显示Tk-PUL能够降解可溶性淀粉和普鲁兰糖,即Tk-PUL同时具有α-淀粉酶活性和普鲁兰酶活性。

图7 Tk-PUL的SDS-PAGE检测以及活性印记分析Fig.7 SDS-PAGE and activity staining analysis of Tk-PUL
注:M:蛋白质Marker;1:Tk-PUL的SDS-PAGE检测;2:Tk-PULα-淀粉酶活性的活性印记分析;3:Tk-PUL普鲁兰酶活性的活性印记分析。
2.4 重组Tk-PUL的酶学性质研究
2.4.1 pH对重组Tk-PUL相对酶活的影响 将酶液与不同pH(3.0~9.0)的1%(W/V)可溶性淀粉溶液或普鲁兰糖溶液混合,于100 ℃下测定重组Tk-PUL的相对α-淀粉酶活性或普鲁兰酶活性,结果如图8所示。以可溶性淀粉或普鲁兰糖为底物时,Tk-PUL的最适反应pH均为4.5,并且在pH3.5~8.0范围内均具有50%以上相对酶活。
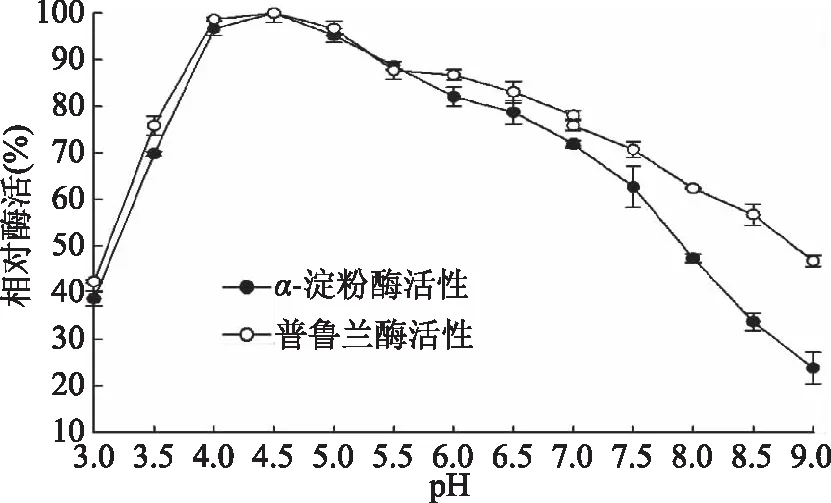
图8 pH对酶活的影响Fig.8 Effect of pH on enzyme activity
2.4.2 温度对重组Tk-PUL的α-淀粉酶比活力和普鲁兰酶比活力的影响 以1%可溶性淀粉或1%普鲁兰糖为底物,于不同温度条件下(40~110 ℃)测定重组Tk-PUL的α-淀粉酶比活力和普鲁兰酶比活力,结果如图9所示。以可溶性淀粉或普鲁兰糖为底物时,重组Tk-PUL的最适反应温度均为100 ℃。在40~110 ℃间Tk-PUL的普鲁兰酶比活力均明显高于α-淀粉酶比活力。其中,在100 ℃条件下,Tk-PUL的α-淀粉酶比活力为54.08 U/mg,普鲁兰酶比活力比活力为110.39 U/mg。

图9 温度对酶活的影响Fig.9 Effect of temperature on enzyme activity
2.4.3 重组Tk-PUL的热稳定性 重组Tk-PUL于100 ℃下的热稳定性测定结果如图10所示。以可溶性淀粉或普鲁兰糖为底物时,重组Tk-PUL于100 ℃、pH4.5的半衰期均约为2 h。即Tk-PUL的α-淀粉酶活性和普鲁兰酶活性于100 ℃的半衰期均约为2 h。
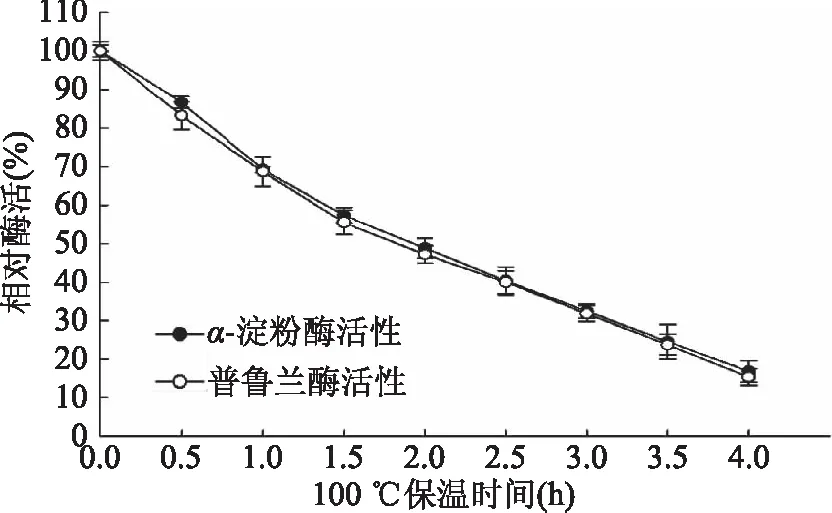
图10 100 ℃重组Tk-PUL的热稳定性Fig.10 Thermal stability of recombinant Tk-PUL at 100 ℃
2.4.4 重组Tk-PUL的动力学参数 重组Tk-PUL以可溶性淀粉或普鲁兰糖为底物时的米氏常数Km和反应常数kcat如表2所示。以可溶性淀粉为底物时,Tk-PUL的Km值为1.86 mg/mL,kcat值为80.9 s-1;以普鲁兰糖为底物时,Tk-PUL的Km值为2.07 mg/mL,kcat值为157.8 s-1。Tk-PUL对可溶性淀粉和普鲁兰糖的Km值相近,即Tk-PUL对可溶性淀粉和普鲁兰糖的结合能力基本一致;Tk-PUL对普鲁兰糖的kcat值约为其对可溶性淀粉的kcat值的2倍,即Tk-PUL以普鲁兰糖为底物时的反应速率明显高于以可溶性淀粉为底物时的反应速率。

表2 100 ℃重组Tk-PUL的动力学参数Table 2 Kinetic parameters of recombinant Tk-PUL at 100 ℃
3 结论
本研究通过构建Tk-PUL在枯草芽孢杆菌表达系统中分泌表达的信号肽筛选库并结合高通量筛选技术,确定引导Tk-PUL在枯草芽孢杆菌中高效分泌表达的信号肽为AmyE。在信号肽AmyE的引导下,重组Tk-PUL在重组枯草芽孢杆菌中高效分泌表达,重组枯草芽孢杆菌的胞外α-淀粉酶活力为29.1 U/mL,胞外普鲁兰酶活力为53.5 U/mL。并且枯草芽孢杆菌表达系统中分泌表达获得的重组Tk-PUL的酶学性质与大肠表达系统中胞内表达获得的重组Tk-PUL的酶学性质[9-10]基本一致。以可溶性淀粉为底物时,重组Tk-PUL的最适反应pH为4.5,最适反应温度为100 ℃,对应的绝对酶活为54.08 U/mg,动力学常数Km值为1.86 mg/mL,kcat值为80.9 s-1,于100 ℃、pH4.5的半衰期约为2 h。以普鲁兰糖为底物时,重组Tk-PUL的最适反应pH为4.5,最适反应温度为100 ℃,对应的绝对酶活为110.39 U/mg,动力学常数Km值为2.07 mg/mL,kcat值为157.8 s-1,于100 ℃、pH4.5的半衰期约为2 h。本研究结果表明,在信号肽AmyE的引导下,嗜热酸性普鲁兰水解酶Ⅲ Tk-PUL可在枯草芽孢杆菌表达系统中高效分泌表达,这为Tk-PUL在淀粉酶法制糖工业中的应用奠定了基础。此外,由Tk-PUL的α-淀粉酶活性和普鲁兰酶活性具有相似的最适反应温度、最适反应pH及热稳定性可以推断,Tk-PUL的这两种酶活性是由同一活性中心催化的。即Tk-PUL属于单结构域双功能酶,为探索双功能酶结构与功能之间的关系提供了很好的研究素材。

