不同养殖环境、不同部位鳄鱼肉的营养品质和加工特性
吴颖峰,张仁康,董合磊,刘 佳,刘 梅,肖红梅
(南京农业大学食品与科技学院,江苏南京 210095)
近些年来,随着国家政策的鼓励和鳄鱼人工养殖技术的发展成熟,鳄鱼作为一种新兴的食材,逐渐走入人们的生活[1]。据悉,国内鳄鱼养殖业飞速发展,主要集中在我国南方地区,总养殖量逐年递增[2]。但鳄鱼产品的利用主要以皮革制品为主,对鳄鱼其他部分的利用不足,造成一定资源浪费。人们发现鳄鱼肉中,粗蛋白含量约为18%,高于其他肉类,而根据已有研究表明,鳄鱼肉可以提供所有必需氨基酸,且必需氨基酸与总氨基酸比例高于41%,总必需氨基酸与总非必需氨基酸比例接近73%,均符合营养学中FAO/WHO的理想模式结果[3],另外鳄鱼肉中含有脂肪酸种类约有30种,其中多不饱和脂肪酸比例在30%左右,并且富含DHA和EPA,鳄鱼肉在脂肪酸含量和组成方面与深海鱼结果接近,具有极高的营养保健价值[4]。同样,鳄鱼肉中还有丰富的维生素和矿物元素,口感好,是良好的肉类食材[5]。鳄鱼肉还具有诸多保健功能,将鳄鱼肉冻干磨碎后对人体有抗脂质氧化作用,并可改善缺氧引起的症状[6]。同样,鳄鱼肉可以清除自由基,具有抗衰老的功效[7]。食用定量的鳄鱼肉,对于机体免疫力提高具有显著作用[8]。另外,体外抗氧化实验表明,鳄鱼肉提取物具有很好的抗氧化能力[9-10]。但是肉的营养特性与加工特性受到诸多因素的影响如遗传因素、营养因素、环境因素等[11]。
目前我国鳄鱼养殖主要分为室外养殖和室内养殖,不同养殖环境可能对鳄鱼肉品质有一定的影响,同时不同部位的鳄鱼肉营养成分与加工特性也各不相同,可能会对鳄鱼肉深加工有一定的影响。因此,本文通过研究比较不同养殖环境和不同部位对鳄鱼肉营养品质和加工的影响,得到最适合进行鳄鱼肉深加工的养殖类型与部位,从而为鳄鱼肉的深加工及商业化提供参考。
1.1 材料与仪器
暹罗鳄:1.5~2年鳄鱼,平均体重(20±1.8) kg,共8条 分别购于江苏苏州市奥新鳄鱼开发有限公司泰兴分公司;室内养殖鳄鱼 广西东兴河州养殖场室外养殖鳄鱼,每地各4条;氯化钠、三聚磷酸钠、磺基水杨酸、正己烷 均为分析纯,国药集团化学试剂上海有限公司。
K-375型自动凯氏定氮仪 瑞士BUCHI有限公司;SCT-02型索氏抽提仪 杭州汇尔仪器设备有限公司;CR400型便携色差仪 日本Minolta公司;便携式pH计 美国Orion公司;绞肉机 山东嘉信公司;GM200型小型混合斩切仪 德国Retsch公司;TA-XT2i型质构仪 英国Stable Micro Systems公司;Avanti J-E型高速冷冻离心机 美国Beckman Counter公司;MCR-301型流变仪奥地利 Anton Paar公司;恒温水浴锅 南京科尔仪器设备有限公司;L8900型全自动氨基酸分析仪 日本Hitachi公司。
1.2 实验方法
1.2.1 材料预处理 将鳄鱼屠宰,屠宰程序为:后颈部放血、脱皮、掏膛、预冷、分割后运回实验室去骨去脂肪后按照室外养殖和室内养殖两个养殖环境、躯干、腿部和尾部三个部位将材料分成6组[4],剔除脂肪、筋膜和杂质4 ℃储藏,用于鳄鱼肉pH、蒸煮损失率、持水力、色差以及营养品质的测定。
1.2.2 鳄鱼肉营养品质测定 水分:采用GB/T 5009.3-2016《食品中水分的测定》;灰分:采用GB/T 5009.4-2016《食品中灰分的测定》;蛋白质:采用GB/T 5009.5-2016《食品中蛋白质的测定》;脂肪:采用GB/T 5009.6-2016《食品中粗脂肪的测定》。
1.2.3 鳄鱼肉氨基酸测定 参考Kim[12]的方法,并略作修改。称取4 g鳄鱼肉样品切碎,加入20 mL 3 g/100 mL的磺基水杨酸溶液,高速均质(10000 r/min,10 s,均质三次),冷冻离心(4 ℃,10000 r/min,15 min),取上清液加入2 mL正己烷,摇匀后过0.22 μm膜,使用配备有BioBasicSCX阳离子交换柱(4.6 mm×60 mm,5 μm)的氨基酸分析仪进行检测。
1.2.4 鳄鱼肉糜凝胶制备 参考Zheng[13]等的方法,并适当修改。鳄鱼肉使用6 mm孔径的绞肉机绞碎成肉糜,添加2%食盐和0.2%三聚磷酸钠,混匀后4 ℃冷库干腌24 h。将干腌后的鳄鱼肉糜用小型混合斩切仪进行斩切,添加鳄鱼肉糜质量20%的冰水,3500 r·min-1,4 s×5次。分别称取30 g鳄鱼肉糜m0放入50 mL离心管中,低温低速离心(温度4 ℃,转速500 r·min-1,时间6 min)压实肉糜。离心后将离心管放置于80 ℃恒温水浴锅中,待肉糜中心温度达到72 ℃后,保温4 min之后,用冷却的流动水降温至中心温度20 ℃,制成30 g的肉糜凝胶块用于测定鳄鱼肉糜凝胶的pH、蒸煮损失率、持水力、色差、质构和流变特性。
1.2.5 加工特性
1.2.5.1 pH测定 使用便携式pH计直接插入鳄鱼肉(肉糜凝胶块)进行测量。校准后,在4 ℃条件下,插入电极至2 cm左右,各个样品测定5次取平均值[14]。
1.2.5.2 蒸煮损失率测定 鳄鱼肉蒸煮前称重,记为m0,于80 ℃水浴锅内煮至肌肉中心温度达到72 ℃,流水冷却至常温,将蒸煮后的样品用吸水纸擦去表面水分,称重,记为m1,蒸煮损失率(%)=(m0-m1)/m0×100[15]。
1.2.5.3 持水力测定 根据Han的方法[16],取鳄鱼肉(肉糜凝胶块)约10 g质量记为m2精确(0.001 g),置于50 mL 离心管中,离心条件:1500×g,30 min,离心后吸水纸擦去表面水分,称重记为m3,计算公式如下:WHC(%)=(1-(m2-m3)/m2)×100。
1.2.5.4 亮度测定 使用CR-400色差仪测定鳄鱼肉(肉糜凝胶块)色差,使用前用色差仪配套白板进行校准,随后测定6个随机区域的色差值,以平均值作为结果。另外依据测定鳄鱼肉糜凝胶的色差值,通过如下公式[5]计算鳄鱼肉糜凝胶的白度W。
1.2.5.5 质构测定 根据陈建良等的方法[17-18],取鳄鱼肉糜凝胶块,用吸水纸擦去表面水分后,用双面刀切成约1 cm×2 cm×2 cm的肉块,质构仪选取直径5 cm的圆柱形探头。参数设定:压缩比50%,测前速度1.0 mm·s-1,测中速度2.0 mm·s-1,测后速度5.0 mm·s-1,触发力5 g,时间间隔6 s。每个处理组测试5次。
1.2.5.6 流变特性测定 使用50 mm圆形平板探头,平板间隔1.00 mm,加入5 g鳄鱼肉糜凝胶后用液体石蜡封住边缘。流变仪参数设置:首先进行动态温度扫描,样品于20 ℃平衡10 min;升温程序:20 ℃到 72 ℃,变温速率为2 ℃·min-1,于72 ℃保温10 min;降温程序:从72 ℃到20 ℃,变温速率为2 ℃·min-1。温度扫描结束后进行动态扫描,频率为0.1 Hz,记录动态扫描期间储能模量G′的变化[19]。
1.3 数据处理
每组实验5个平行,3次重复,数值标记为:平均值±标准差。采用SAS 9.1.3进行单因素方差分析,使用Duncan多重检验进行显著性分析,显著水平P<0.05。使用Origin 8.0作图。
2 结果与分析
2.1 不同养殖环境、不同部位鳄鱼肉的一般营养品质
根据表1,鳄鱼肉不同部位间水分、灰分、蛋白质和脂肪含量均存在差异,室外养殖环境下蛋白质含量显著高于室内养殖(P<0.05)。两种养殖环境下鳄鱼肉腿部水分含量均超过75%,显著高于躯干和尾部(P<0.05)。灰分含量最高的是室外养殖鳄鱼的躯干部位为0.12%,最低的是室内养殖的腿部为0.08%。蛋白质方面,由于室外养殖整体更接近自然环境且鳄鱼的运动量更大,导致室外养殖环境下鳄鱼三个部位的蛋白质含量均高于18%,显著高于室内养殖鳄鱼的对应部位(P<0.05)。两种养殖环境鳄鱼腿的脂肪含量分别为0.88%、0.92%,均显著低于其他部位(P<0.05),这主要是因为尾部和背部为鳄鱼主要储存脂肪的部位而腿部则是运动部位。

表1 不同养殖环境不同部位鳄鱼肉一般营养品质Table 1 Basic nutritional of different breeding environments and parts of crocodile
注:同行不同字母表示差异显著(P<0.05);表2~表5同。
2.2 不同养殖环境、不同部位鳄鱼肉的氨基酸含量
不同养殖环境不同部位肉的氨基酸共检测出17种,其中谷氨酸含量最高,而胱氨酸最低。检测出的必需氨基酸含量最高的是赖氨酸,其次是亮氨酸和异亮氨酸。对于总氨基酸(TAA)来说,不同部位含量差异显著(P<0.05),表现为腿部>尾部>躯干,而不同养殖环境下躯干的总氨基酸差异显著而其他两个部位差异不明显;总必需氨基酸(TEAA)含量,躯干含量显著低于其他两个部位(P<0.05)。总非必需氨基酸(TNEAA)含量方面,以室外鳄鱼为例,躯干、腿部、尾部分别为32.42、36.00、35.92 mg/100 g,不同部位含量差异显著(P<0.05)。根据营养学氨基酸评价方式计算TEAA/TAA和TEAA/TNEAA发现,两种养殖环境尾部的该比例均在40%和70%以上,符合营养学中对于理想氨基酸比例的标准。氨基酸分析结果表明,采肉部位对于氨基酸含量影响较大,而养殖环境造成影响不明显。
2.3 不同养殖环境、不同部位鳄鱼肉加工特性
不同养殖环境不同部位鳄鱼肉加工特性(pH、蒸煮损失率、持水力及亮度)如表3所示。不同部位鳄鱼肉之间4项加工特性指标均存在显著差异(P<0.05),而不同养殖环境下的鳄鱼肉之间蒸煮损失率、持水力和亮度存在差异(P<0.05)。两个养殖环境下鳄鱼腿部肉pH均显著高于其他两个部位,而尾部肉的pH最低(P<0.05)。肌肉的亮度和pH主要受主体养殖环境、饲喂情况和宰后贮藏条件等影响[20-21],人工养殖鳄鱼日常主要以爬行为主,尾部活动较少。因此,腿部中铁元素结合血液中的蛋白可以为其正常的活动提供能量,由于铁元素氧化的变色反应导致腿部亮度值明显区别于另外两个部位[22],另外有研究表明宰前肌肉中蛋白质含量的不同,糖原含量也会有所区别,宰后糖类无氧代谢产生乳酸,留在肌肉中,进而导致了pH不同[23]。
2.4 不同养殖环境、不同部位鳄鱼肉糜凝胶品质
将6个处理组肉绞碎后,制得的肉糜凝胶基本品质如表4所示。不同部位的室内养殖鳄鱼肉糜凝胶之间3项指标均存在显著差异(P<0.05),但不同养殖环境pH差异不显著(P>0.05)。其中腿部肉凝胶的pH最高,尾部持水力最高显著高于其他部位(P<0.05)。尾部蛋白质含量更高,形成凝胶的强度更大,高强度的凝胶网状结构可以结合更多水分[24]。其次,在pH较高的环境下,蛋白质的溶解度会有所增加,提高凝胶的网状强度[25],

表2 不同养殖环境不同部位鳄鱼肉氨基酸(mg/100 g)Table 2 Amino acid of different breeding environments and parts of crocodile(mg/100 g)
注:*代表必需氨基酸。
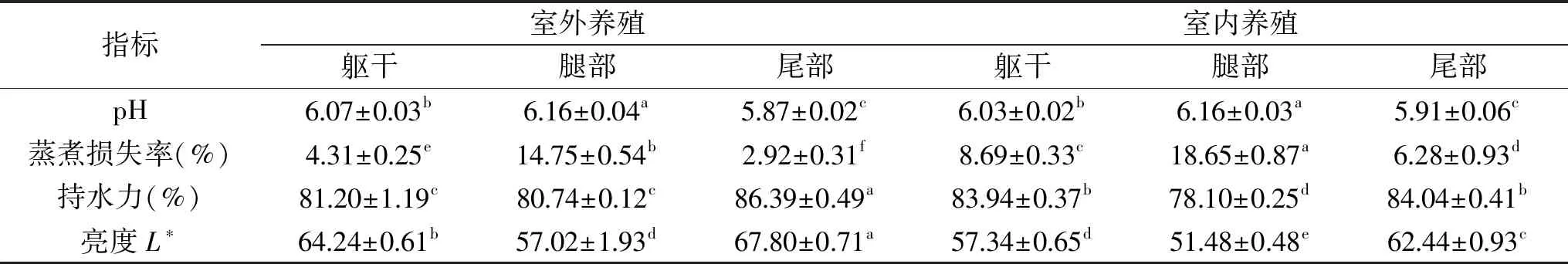
表3 不同养殖环境不同部位鳄鱼肉加工特性Table 3 Processing characteristics of different breeding environments and parts of crocodile meat

表4 不同养殖环境不同部位鳄鱼肉糜凝胶品质特性Table 4 Gel quality of different breeding model and parts of crocodile meat
而腿部由于本身蛋白质含量较低,影响蛋白质溶出,因此凝胶网状强度较低,从而在加工过程中损失了较多水分。对比6个部位肉发现不同养殖环境下躯干的持水力差异并不显著,这可能是由于离心过程使得样品中的自由流动水几乎全部损失。
2.5 不同养殖环境、不同部位鳄鱼凝胶质构特性
不同养殖环境不同部位鳄鱼凝胶质构特性如表5所示。从不同养殖环境来看,室外养殖的鳄鱼肉凝胶硬度、咀嚼性显著高于室内(P<0.05),说明室外的养殖环境能够形成更好的肌原纤维并保护肌肉中蛋白质结构的稳定性。从不同部位来看,尾部肉糜凝胶咀嚼性和硬度均高于另外两个部位,因此,尾部肉糜凝胶在质构方面相对优于躯干和腿部,这表明尾部肉更高的蛋白质含量使得尾部肉糜凝胶具有更大的硬度和咀嚼性。此外不同部位肉中的钙离子浓度存在差异,而钙离子能通过激活TGase改变凝胶的质构特性[26]。

表5 不同养殖环境不同部位鳄鱼肉凝胶质构测定Table 5 Textural properties of different breeding environments and parts of crocodile meat
2.6 不同养殖环境、不同部位鳄鱼肉糜凝胶流变特性
根据图1(a),鳄鱼肉糜在加热过程中储能模量G′呈现上升的趋势。6个处理组在44 ℃达到第一阶段的最大值,随后在44~50 ℃有缓慢的下降趋势,50 ℃之后,6个处理组储能模量G′迅速增加,不同于另外4个处理组,室内养殖鳄鱼躯干、尾部肉糜以及室外养殖鳄鱼躯干肉糜在升温终点72 ℃后仍有上升趋势,其他3组则出现下降趋势。根据图1(b),6个处理组相位角正切呈现先升高后降低的趋势,即样品从黏性特征明显逐渐变为弹性特征明显,两个养殖环境尾部肉糜率先出现拐点并迅速下降,体现了较好的弹性特征。
降温过程后分别对于上述样品进行频率扫描,如图1(c),该过程以递增的频率对形成的凝胶体进行振荡,目的是检测凝胶的形成强度,并通过储能模量定量展现。结果显示,6个处理组均呈现上升趋势,但两养殖环境尾部在频率扫描过程后,储能模量明显增加,室外养殖鳄鱼尾部和室内养殖鳄鱼尾部凝胶储能模量G′分别达到85628和60237,明显高于其他4个部位。

图1 不同养殖环境不同部位鳄鱼肉凝胶流变测定Fig.1 Rheological properties of different breeding environments and parts of crocodile meat
3 讨论
肌肉的纤维类型会影响肌肉的保水性。Qiao等[27]指出宰后肌肉纤维的不同导致蛋白质发生不同程度的降解,这导致了肌肉中水分的存在形态发生变化,通常由结合水变为自由水,进而影响肌肉中水分含量。鳄鱼肉脂肪含量均为1%左右,远低于鸡(10.6%)和猪(9.9%)[28]。鳄鱼肉蛋白质占干重的比例达88%以上,远高于常见的畜禽类肉,营养学中常将鸡蛋作为理想蛋白质的代表,而鸡蛋中蛋白质干重百分比仅有46%左右,因此,鳄鱼肉是一类高蛋白质肉类,具有很高的营养价值。
氨基酸是蛋白质的基本组成成分,氨基酸的种类、含量和比例是评价肉类蛋白质营养的重要指标。总游离氨基酸含量可以作为评定肉品的氨基酸营养等级,即营养价值与肌肉中总游离氨基酸含量呈正相关,同时游离氨基酸中的风味氨基酸含量对于肉类香气的改善有着重要作用。FAO/WHO给出评价氨基酸组成的标准模式,TEAA/TAA比值在40%以上,TEAA/TNEAA比值在60%以上为优等。根据测定的结果无论是室外还是室内养殖鳄鱼,尾部比例均在40%和70%左右,同时其余部位也接近该比例,这表明人工养殖鳄鱼氨基酸组成是一种非常良好的氨基酸供应体。该比例高于常见的畜禽肉如猪肉(39.58%、65.57%)和鸭肉(39.47%、64.75%),这表明,鳄鱼肉在氨基酸组成和含量方面优于普通肉类。同时对比不同养殖环境和不同部位发现,鳄鱼不同部位TAA、TEAA和TNEAA差异显著(P<0.05),说明不同部位的营养品质存在不同,但不同养殖环境间差异不明显,表明养殖环境的差异对于鳄鱼氨基酸组成方面影响不大。同时本研究发现,鳄鱼肉中谷氨酸、天冬氨酸、苯丙氨酸、丙氨酸、甘氨酸和酪氨酸含量相对较高,从而使其具有鳄鱼肉独特风味,可用于加工多类鳄鱼肉制品。
此外,两个养殖环境尾部肉糜的相位角正切值明显低于其他部位,并在较低的温度达到最大值,有研究关于鸡胸和鸭胸肉糜的流变特性得到了类似结果[29]。该过程表明,尾部肉糜在较低的温度下弹性特征增加趋势优于黏性趋势,实现肉糜体系由溶胶向凝胶的过渡。同时,相位角正切值在加热过程中始终小于1,表明体系一直以弹性特征为主,属于具有黏性特征的弹性凝胶,是一种较为理想的状态[30]。静态流变学结果显示,随着振荡频率的升高,尾部体系的弹性特征提升幅度较高,这是由于尾部肉糜中水和蛋白质分子更多,在受到外力时,原有的连接结构解开,顺着振荡的方向呈现出规则的序列,使得分子结构韧性更强,进而使体系的弹性增强,并且该序列的规则程度取决于剪切的频率,二者表现为正相关[31]
4 结论
鳄鱼尾部肉较其他两个部位具有相对较高的营养价值和更优的加工特性。与腿部和躯干相比,尾部肉含有更多的蛋白质,更少的脂肪,同时蒸煮损失率低,持水力高,极大程度保留了鳄鱼肉本身的嫩度品质。尾部肉糜制品,在色泽、质构和流变特性明显优于另外两个部位,加工特性优良。同时,相对于室内养殖鳄鱼,室外养殖鳄鱼具有相对较高的蛋白质含量和加工特性,加工后形成的凝胶品质更优。因此,室外养殖环境鳄鱼肉品质优于室内养殖鳄鱼肉,今后鳄鱼肉深加工时可选择合适部位的肉如以尾肉为主的制品或选择不同部位合适的配比来提高鳄鱼肉加工制品的品质。

