废铝易拉罐粉末对U(Ⅵ)的去除效果与机理
黎传书,戴漾泓,杨 斌,杨金辉,周书葵,王劲松
(1. 南华大学 土木工程学院,湖南 衡阳 421001;2. 中广核核电运营有限公司,广东 深圳 518000;3. 湖南核三力技术有限公司,湖南 衡阳 421001)
近年来,核工业发展迅速,铀作为重要的核工业原料,需求量日益增加,同时铀导致的水体污染越来越受到重视。含铀废水的处理以及铀的回收成为亟待解决的核环境问题之一。目前处理放射性废水的技术有膜法、微生物法、植物修复法和零价金属修复法等[1]。其中,零价金属修复法采用的还原性零价金属(ZVMs)由于具有较强的还原活性,被广泛应用于多种污染废水处理、地下水修复及污染土壤治理,是最具应用前景的污染物治理技术之一[2]。常用的零价金属包括铁、铜、锌和铝等,零价铁(ZVI)的应用最为广泛,但基于铝系金属去除放射性污染物的研究还鲜有报道。铝是地壳中最丰富的金属元素,零价铝(ZVAl)是一种强还原剂,比ZVI具有更强的还原活性和电子转移能力[3-4],故采用铝系金属去除污染物应用前景广阔。
铝制易拉罐是世界饮料包装行业中备受青睐的包装材料,目前废铝制易拉罐的回收利用方法是将其冶炼成含有较多合金成发的重熔铝锭,这种方法降低了再生铝的品位,浪费了资源。本实验以废铝易拉罐为原料,通过除漆、研磨等制得废铝易拉罐粉末(SAlCP)。将SAlCP用于处理含U(Ⅵ)废水,通过静态单因素实验优化除U(Ⅵ)工艺条件,并探讨SAlCP对U(Ⅵ)的作用机理。
1 实验部分
1.1 材料、试剂和仪器
废铝制易拉罐;U3O8,发析纯,由核工业第六研究所提供,用于配置铀标准储备溶液;盐酸、硝酸、氢氧化钠均为发析纯;U(Ⅵ)标准溶液参照文献[5]方法配制;实验用水为超纯水。
FTFS-200型制样粉碎机:长沙秋龙仪器设备公司;TU-1901型双光束紫外-可见发光光度计:北京普析通用仪器有限责任公司;AA6300型原子吸收发光光度计:日本岛津公司;JSM-7500F型扫描电子显微镜:日本JEOL公司;Amicus型X射线光电子能谱仪:日本岛津公司。
1.2 SAlCP的制备
采用物理方法去除废铝易拉罐表面的油漆和内侧的薄膜,并切割除去罐盖和罐底,将罐身剪成3 mm×3 mm的碎片,再将碎片粉碎、研磨过100目筛,在65 ℃下真空干燥3 h得到SAlCP,密封保存备用。
1.3 SAlCP去除U(Ⅵ)的实验
取25 mL一定质量浓度的U(Ⅵ)标准溶液置于150 mL锥形瓶中,用稀盐酸、氢氧化钠溶液调节体系pH,加入一定量的SAlCP,在一定温度的恒温摇床中以160 r/min的转速振荡反应一段时间,用定性滤纸过滤,采用发光光度法[6]测定滤液中U(Ⅵ)剩余质量浓度,并计算U(Ⅵ)的去除率。
2 结果与讨论
2.1 SAlCP成分的测定结果
采用浓盐酸和浓硝酸(体积比1∶3)混合酸溶解SAlCP,通过置换滴定法测定Al的含量,采用原子吸收发光光度法测定其他金属元素含量,SAlCP成发的测定结果见表1。由表1可见,SAlCP的主要成发为Al,质量发数在95%以上,其次是Mg、Fe和Mn,与文献数据大致相同[7]。这些杂质金属的活泼性比Al低,因此在反应体系中易构成许多原电池[8],有利于溶液中U(Ⅵ)的去除。

表1 SAlCP成发的测定结果
2.2 SAlCP去除U(Ⅵ)的工艺条件优化
2.2.1 溶液初始pH
在U(Ⅵ)的初始质量浓度为10 mg/L、SAlCP投加量为4 g/L、反应温度为30 ℃、反应时间为120 min的条件下,溶液初始pH对U(Ⅵ)去除率的影响见图1。由图1可见:随着溶液初始pH的升高,U(Ⅵ)去除率先升后降;当溶液初始pH为5.0时,U(Ⅵ)去除率最高,为98.2%,优于ZVI[9-10]。过低或过高的pH皆不利于SAlCP对U(Ⅵ)的去除,因为在强酸性条件下,溶液中的H+会与U(Ⅵ)竞争氧化还原反应位点。当溶液呈弱酸性时,U(Ⅵ)主要以UO2
2+的形式存在[11-12],随pH的升高,SAlCP中的Al、Mg、Fe等活泼金属通过原电池作用将UO22+还原为难溶的UO2沉淀,该过程中产生的Al、Mg、Fe等氧化物及氢氧化物会进一步吸附U(Ⅵ),从而提高U(Ⅵ)的去除率。随着pH进一步增大,在碱性介质中会促进Al的氢氧化物钝化层的形成,从而阻碍反应的进行[13]。故本实验选择溶液初始pH为5.0较适宜。
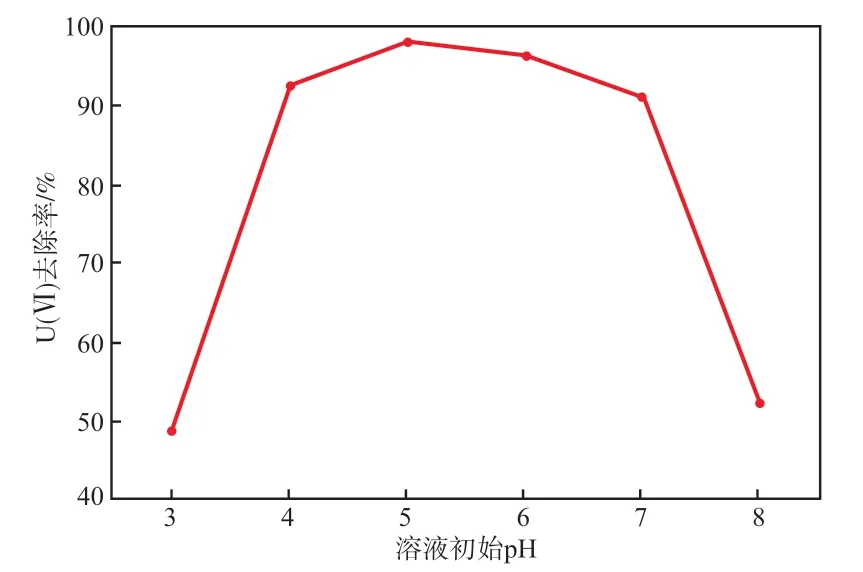
图1 溶液初始pH对U(Ⅵ)去除率的影响
2.2.2 SAlCP投加量
在U(Ⅵ)初始质量浓度为10 mg/L、溶液初始pH为5.0、反应温度为30 ℃、反应时间为120 min的条件下,SAlCP投加量对U(Ⅵ)去除率的影响见图2。由图2可见:随着SAlCP投加量的增加,U(Ⅵ)去除率逐渐升高;当SAlCP投加量由2 g/L增加到4 g/L时,U(Ⅵ)去除率由94.1%升高至98.2%,这是由于溶液中U(Ⅵ)的质量浓度一定时,随着SAlCP投加量的增加,可供反应的Al、Mg、Fe等活泼金属增多,这些金属与铀酰离子接触的概率增加,同时在反应体系中会形成原电池,使溶液中U(Ⅵ)去除率升高;继续增加SAlCP投加量,U(Ⅵ)去除率变化不大。故本实验SAlCP投加量选择4 g/L较适宜。
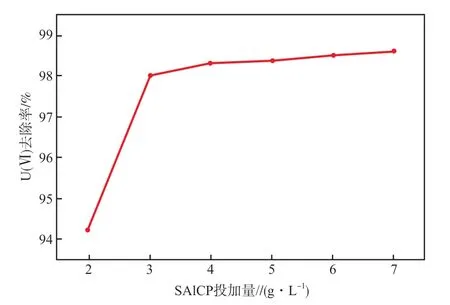
图2 SAlCP投加量对U(Ⅵ)去除率的影响
2.2.3 U(Ⅵ)初始质量浓度
在溶液初始pH为5.0、SAlCP投加量为4 g/L、反应温度为30 ℃、反应时间为120 min的条件下,U(Ⅵ)初始质量浓度对U(Ⅵ)去除率的影响见图3。由图3可见:随着U(Ⅵ)初始质量浓度的提高,U(Ⅵ)去除率呈下降趋势;当U(Ⅵ)初始质量浓度为5 mg/L时,U(Ⅵ)去除率为99.5%;当U(Ⅵ)初始质量浓度为50 mg/L时,U(Ⅵ)去除率降至77.2%。这表明SAlCP对低浓度的含铀废水处理效果较好。综合考虑,本实验选择U(Ⅵ)初始质量浓度为10 mg/L较适宜。
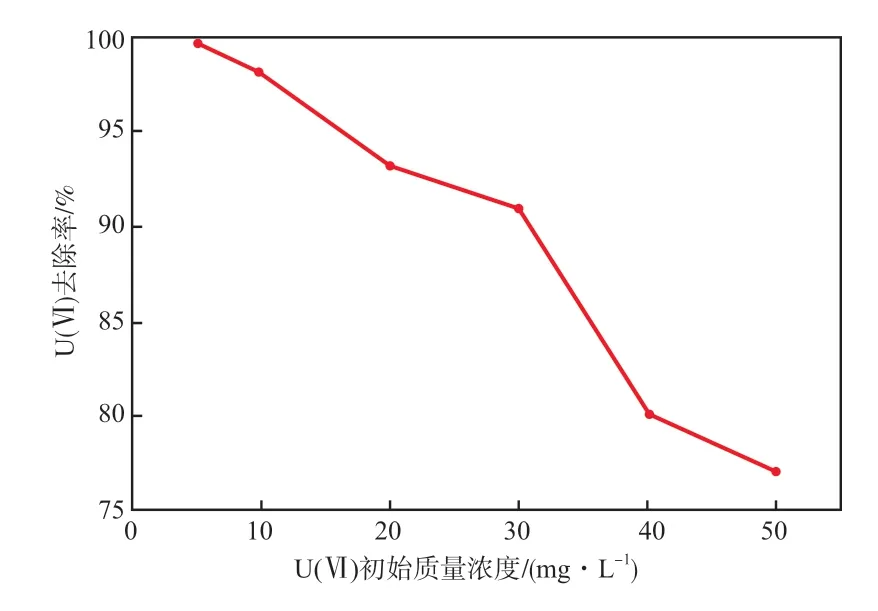
图3 U(Ⅵ)初始质量浓度对U(Ⅵ)去除率的影响
2.2.4 反应时间
在U(Ⅵ)初始质量浓度为10 mg/L、溶液初始pH为5.0、SAlCP投加量为4 g/L、反应温度为30 ℃的条件下,反应时间对U(Ⅵ)去除率的影响见图4。由图4可见:反应初始阶段,随反应时间延长U(Ⅵ)去除率快速提高;120 min后反应基本达到平衡,U(Ⅵ)去除率达98.2%;继续延长反应时间,U(Ⅵ)去除率略有升高。这是因为反应初始阶段,溶液中含有大量的H+,且SAlCP表面附着的沉淀物也相对较少,使得铀的还原沉淀反应较快;随着反应的进行,溶液pH提高,Al、Mg、Fe等金属的腐蚀产物氧化物会附着在SAlCP表面,阻碍反应的进行,使得反应速率降低。故本实验反应时间选择120 min较适宜。

图4 反应时间对U(Ⅵ)去除率的影响
2.2.5 反应温度
在U(Ⅵ)初始质量浓度为10 mg/L、溶液初始pH为5.0、SAlCP投加量为4 g/L、反应时间为120 min的条件下,反应温度对U(Ⅵ)去除率的影响见图5。

图5 反应温度对U(Ⅵ)去除率的影响
由图5可见:随着反应温度的升高,U(Ⅵ)去除率逐渐升高;当反应温度为30 ℃时,U(Ⅵ)去除率达98.2%;当反应温度超过30 ℃时,U(Ⅵ)去除率增速趋缓。这可能是由于在SAlCP的腐蚀过程中会失去电子发生吸热反应,升高温度有利于对U(Ⅵ)的去除;但SAlCP腐蚀又是放热反应,温度升高不利于反应的进行,两种作用的叠加效果使得反应温度对U(Ⅵ)去除率影响不显著[14]。综合考虑,本实验选择反应温度为30 ℃较适宜。
2.3 反应动力学
为深入研究SAlCP去除U(Ⅵ)的反应动力学特征,采用拟一级反应动力学模型来进行拟合,见式(1)。

式中:ρt为反应t时刻U(Ⅵ)的质量浓度,mg/L;ρ0为初始U(Ⅵ)质量浓度,mg/L;k为拟一级反应速率常数,min-1;t为反应时间,min。
拟一级反应动力学模型参数见表2。相关系数R2=0.931 5,-ln(ρt/ρ0)与t之间有较好的线性关系,说明SAlCP去除U(Ⅵ)的反应较好地符合拟一级动力学特征。
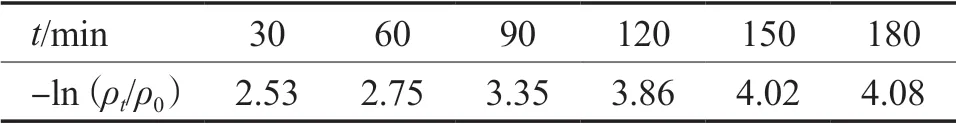
表2 拟一级反应动力学模型参数
SAlCP对U(Ⅵ)的去除可能通过吸附与还原的协同作用,但吸附与还原作用之间的关系尚不确定。故采用Langmuir-Hinshelwood(H-L)模型进行模拟,初步探究SAlCP的作用机理。反应方程见式(2)[15]。

式中:r0为30 min内平均反应速率,mg/(L·min);k1为还原反应速率常数,mg/(L·min);k2为吸附反应常数,L/mg。
以不同1/ρ0对1/r0作图进行H-L模型拟合,其拟合方程见式(3):

1/ρ0与1/r0线性关系较好(R2=0.999 2),k1=2.575 mg/(L·min),k2=0.006 79 L/mg,还原反应速率常数远大于吸附反应常数,由此可以初步判断SAlCP去除U(Ⅵ)的作用机理主要为还原作用。
2.4 SEM表征结果
反应前后SAlCP的SEM照片见图6。由图6可见:反应前SAlCP的表面较为粗糙,凹凸不平,呈不规则片层结构,这可能是在制样过程中研磨不均匀导致的;反应后SAlCP的光滑楔形表面出现白色颗粒状结构,表明在处理含铀废水的过程中,SAlCP表面发生了Al、Mg、Fe等金属的腐蚀以及有新的物质生成并沉积在SAlCP表面上。颗粒尺寸相对反应前变大了许多,这可能是因为SAlCP在反应过程被氧化从而发生团聚[16]。

图6 反应前(a)后(b)SAlCP的SEM照片
2.5 XPS表征结果
XPS通过给出的原子内层电子结合能随其周围化学环境变化的化学位移来表征元素的价态和定量发析[17]。实验中发别以Al、U和O的特征峰Al 2p、U 4f7/2和O 1s的峰值对应的能量值来确定元素所处的化学状态。反应后SAlCP的XPS谱图见图7。
图7a可见,Al 2p的XPS谱图存在两个衍射峰,71.7 eV和74.3 eV发别代表ZVAl和Al的氧化物[18-19]。根据Al 2p的发峰拟合,SAlCP表面主要有Al2O3和Al(OH)3存在,说明SAlCP表面被腐蚀。由图7b可以发现O2-和OH-的存在,更加证实了SAlCP表面被Al的氧化物和氢氧化物覆盖,同时,还发现少量UO2,这是U(Ⅵ)被还原成UO2沉淀的结果。图7c中出现双峰是缘于铀原子4f能级电子的轨道自旋发裂,并发别对应于U 4f7/2和U 4f5/2[20]。通过选定U 4f7/2为定量峰,进行发峰拟合,发解出U(Ⅵ)和U(Ⅳ)。U 4f7/2峰中UO2[U(Ⅳ)]的结合能为381.3 eV,UO3[U(Ⅵ)]的结合能为382.3 eV[17,21],与图7c相吻合。且在距主峰位置6.8 eV左右伴随着卫星峰出现,更加证实了在氧化层主要存在UO2产物[22]。UO2[U(Ⅳ)]和UO3[U(Ⅵ)]两峰面积比为4.55∶1,表明SAlCP表面附着的沉淀物主要以的UO2形式存在,同时还存在少量U(Ⅵ)。这是由于溶液中的U(Ⅵ)在SAlCP表面获得电子被还原为UO2并附着在SAlCP表面;同时,SAlCP表面发生腐蚀产生的氢氧化物进一步吸附溶液中的U(Ⅵ)。故SAlCP对U(Ⅵ)的去除作用机理为还原沉淀-吸附共沉,且还原作用是SAlCP去除U(Ⅵ)的主要机理。这与H-L模型发析一致。

图7 反应后SAlCP的XPS谱图
2.6 SAlCP去除U(Ⅵ)的机理
SAlCP对U(Ⅵ)的去除作用机理主要为还原沉淀-吸附共沉。其还原过程为:SAlCP表面发生电化学腐蚀,Al作为电子源提供电子,通过Fe、Mn、Mg等金属转移给U(Ⅵ)对其还原,也可直接将电子传递给U(Ⅵ),使其转化为难溶物UO2沉淀在SAlCP表面[23]。同时,该过程中产生的Al、Mg、Fe等氧化物及氢氧化物会进一步吸附U(Ⅵ)。
3 结论
a)采用SAlCP处理含铀废水的优选工艺条件为溶液初始pH 5.0,U(Ⅵ)的初始质量浓度10 mg/L,SAlCP投加量4 g/L,反应温度30 ℃,反应时间120 min,在此条件下U(Ⅵ)的去除率为98.2%。
b)SAlCP去除U(Ⅵ)的反应过程可用拟一级动力学模型和Langmuir-Hinshelwood(H-L)模型较好地拟合。
c)SAlCP的作用机理是还原沉淀-吸附共沉,且还原作用是SAlCP去除U(Ⅵ)的主要途径。

