海南特有极小种群植物文昌锥的SCoT-PCR体系建立及有效引物评价
杨立荣 孙秀秀 陈加利 云 勇 陈 宣 郑道君*
(1.海南省农业科学院热带园艺研究所,海口 571100; 2.海南省热带特种经济植物种质资源创新利用重点实验室,海口 571100)
文昌锥(Castanopsiswenchangensis)俗称“杠酸”“油酸”为壳斗科(Fagaceae)锥属(Castanopsis)植物,仅分布于海南文昌东北部常绿季雨林地区[1]。文昌锥坚果淀粉含量在60%~80%,其味美可口,营养价值高,在文昌及海口地区食用历史悠久,为优良的特色干果经济树种资源,具有良好的开发前景。文昌锥分布范围小,居群数量少,个体数量少,为海南特有的极小种群物种。野外调查仅发现7个文昌锥居群,全部的个体数量700株左右。文昌锥是其群落中的优势种或建群种之一,对稳定脆弱的海南岛东北部常绿季雨林生态系统具有重要意义[2]。文昌锥主要分布在土壤贫瘠的沙地,生长环境恶劣,且其资源及生境经常受到台风干扰和人为破坏,种质资源数量日趋变少。因此,文昌锥种群的保护和扩种迫在眉睫,本研究系统地从文昌锥种群生态、生殖生态、种群遗传等方面进行研究,对揭示文昌锥种群进化历史及有效保护和恢复该种群具有重要作用。目前针对文昌锥种群保护生物学方面的研究几乎处于空白。
目标起始密码子多态性(start codon targeted polymorphism,SCoT)标记是Collard和Mackill在2009年开发的一种新型单引物扩增的分子标记技术[3~4]。该标记是根据基因翻译起始点(ATG)的侧翼序列的一致性和保守性,设计引物扩增目的基因。具有操作简单方便,引物通用性强,成本低,多态性高,遗传信息丰富等优点。近几年已经在柑橘[5]、枇杷[6]、龙眼[7]等植物完成体系建立与优化;在甘蔗[8]、铁皮石斛[9]、裸果木[10]等植物进行遗传多样性与亲缘关系的研究;在皂荚[11]、甜橙[12]、马铃薯[13]等植物建立种质资源鉴定与指纹遗传图谱;在花生[14]、甘蔗[15]、柑橘[16]完成基因差异表达和分子遗传图谱的建立。但SCoT标记技术尚未在壳斗科植物上应用。
本研究利用单因子试验和正交试验研究文昌锥SCoT分析的最佳反应条件,首次建立了一套稳定的文昌锥SCoT-PCR反应体系并筛选出有效SCoT引物,为后期文昌锥种质资源鉴定、谱系地理学和保护遗传学等提供技术支持,也对SCoT标记技术应用于其他壳斗科植物研究具有参考意义。
1 材料与方法
1.1 材料
试验所用材料取自海南省文昌市公坡镇龙飞头村文昌锥居群和海南省文昌市昌洒镇宝彩山村文昌锥居群,材料编号依次为:LFT-01、BC-02和BC-20。取健康叶片用硅胶干燥保存备用。实验材料凭证标本编号LFT-001(19.800054N,110.845677E,海拔33.1 m),凭证标本现存放于海南省农业科学院热带园艺研究所实验室。
1.2 基因组DNA的提取
采用FOREGENE试剂盒提取文昌锥的叶片DNA。紫外分光光度计检测基因组DNA的纯度和浓度,1%的琼脂糖凝胶电泳检测基因组DNA的质量,将叶片所获的基因组DNA样品浓度稀释到20 ng·μL-1保存在-20℃冰箱备用。
1.3 SCoT-PCR反应体系的优化与建立
1.3.1 单因素试验设计
80条SCot引物根据Collard[3]和Luo[17]设计,由北京诺塞基因组研究中心有限公司合成。以LFT-01基因组DNA为模板,选用引物组合SCoT5(序列为:CAACAATGGCTACCACGA),初始反应条件为2×PCR buffer 2 μL,Taq DNA聚合酶1 U,dNTPs 0.3 mmol·L-1,引物浓度0.8 μmol·L-1和模板DNA 40 ng,用ddH20补足到20 μL。扩增程序为94℃预变性5 min,94℃变性1 min,54℃复性1 min,72℃延伸1.5 min,35个循环;最后72℃延伸10 min。扩增产物放于4℃保存。保持其他因素不变的情况下变换一种因素的浓度进行扩增(表1),筛选适宜的浓度范围用于正交试验。
表1 SCoT-PCR单因素试验设计
Table 1 SCoT-PCR single factor experiment design
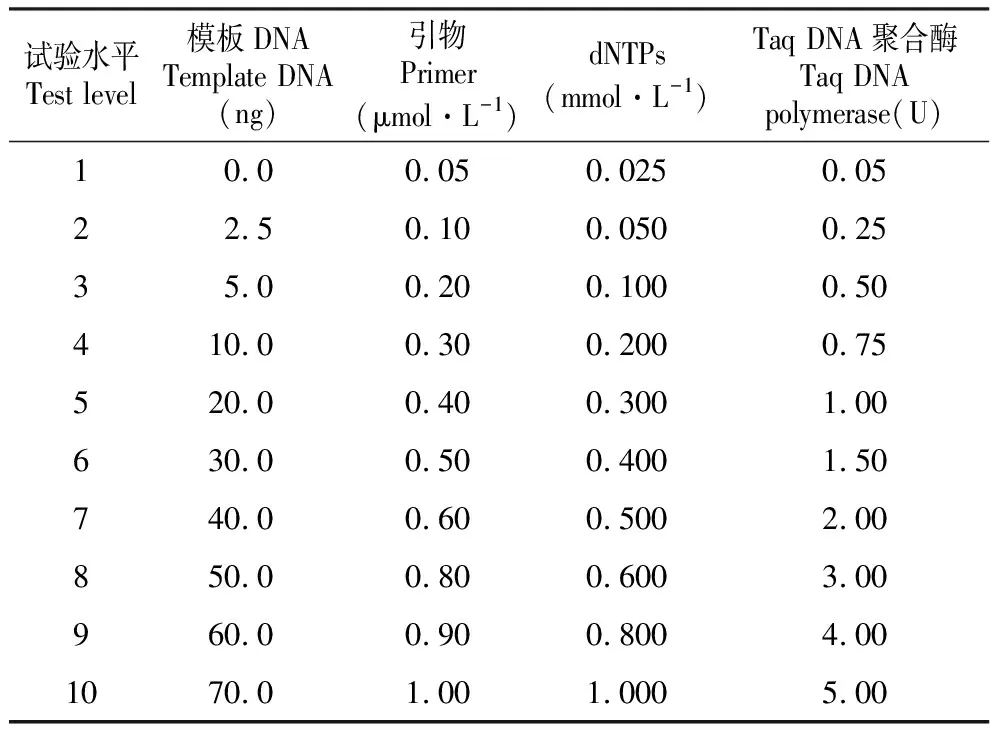
试验水平Test level模板DNATemplate DNA(ng)引物Primer(μmol·L-1)dNTPs(mmol·L-1)Taq DNA聚合酶Taq DNA polymerase(U)10.00.050.0250.0522.50.100.0500.2535.00.200.1000.50410.00.300.2000.75520.00.400.3001.00630.00.500.4001.50740.00.600.5002.00850.00.800.6003.00960.00.900.8004.001070.01.001.0005.00
1.3.2 正交试验设计
基于单因素试验结果,进行L16(45)方案的正交试验[18],确立最优反应体系。参照郑道君等[16~17]的直观分析法,根据扩增条带的清晰度和丰富度对16个组合的扩增结果进行打分,最优扩增结果为16分,最差为1分。分别进行两次独立计分,取两次的平均数。进行极差R值分析。
1.4 SCoT-PCR反应体系验证和多态性引物评价
以LFT-01的基因组DNA为模板,采用优化建立的反应条件,对80个SCoT引物进行初选,选择扩增条带3条以上的引物进行复选。
以3份地理距离相差较远的文昌锥资源(LFT-01、BC-02、BC-20)的基因组DNA为模板,以多态性比率(PPB)为主要评价标准,对初选获得的SCoT引物进行多态性评价和复选,并进行反应体系稳定性验证。
2 结果与分析
2.1 单因素试验结果
2.1.1 模板DNA的用量对SCoT-PCR的影响
如图1所示,文昌锥基因组DNA的浓度对SCoT-PCR扩增影响差异显著。DNA用量为2.5~50.0 ng(图1:泳道2~8)时扩增条带丰富且清晰稳定;当DNA的用量达到60 ng以上时(图1:泳道9~10),扩增强度降低和扩增产物减少,在泳道10(DNA用量为70 ng)仅扩增获得1条550 bp的产物。可见,文昌锥基因组DNA的用量越多,对SCoT-PCR反应效率就越差。经初选,确定2.5~20.0 ng为SCoT-PCR的适宜DNA浓度范围,用于正交试验。
2.1.2 引物浓度对SCoT-PCR的影响
引物是PCR反应中的重要原料之一,引物浓度过低时扩增产物少或没有,引物浓度过高时反应的特异性降低[18]。本试验结果表明,设计的浓度范围内,引物浓度越高时,文昌锥SCoT-PCR扩增效果越好(图1:泳道11~20)。引物浓度小于0.2 μmol·L-1时无扩增产物;当引物浓度为0.2 μmol·L-1(图1:泳道13)时仅扩增1条大于2 000 bp的产物;当达到在0.5 μmol·L-1及以上浓度(图1:泳道16~20)时达到稳定,扩增条带多且条带清晰。因此,选择引物浓度范围0.5~1.0 μmol·L-1作为正交试验设计的适宜浓度。
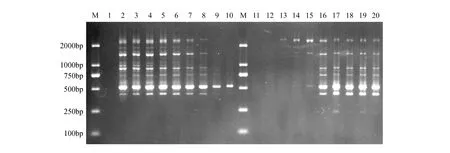
图1 DNA模板用量和引物浓度对SCoT-PCR反应体系的影响Fig.1 Effect of template DNA concentration and primer concentration on SCoT-PCR reaction system M. 100 bp DNA marker; 1-10. 0,2.5,5,10,20,30,40,50,60 and 70 ng(DNA); 11-20. 0.05,0.1,0.2,0.3,0.4,0.5,0.6,0.8,0.9 and 1.0 μmol·L-1(Primer)
2.1.3 dNTPs浓度对SCoT-PCR的影响
dNTPs作为PCR扩增反应的原材料,其浓度过低时,会导致扩增效率低,条带弱或不产生扩增产物[19];当浓度过高时,会降低镁离子与Taq DNA聚合酶的结合效率。随着dNTPs浓度的增加,SCoT-PCR扩增产物由有到无(图2)。dNTPs浓度为0.025 mmol·L-1时,泳道1扩增效率低且扩增条带少。当浓度在0.05~0.30 mmol·L-1范围内时,扩增条带丰富且主带清晰;浓度高于0.3 mmol·L-1,泳道6~10无扩增产物。可见,过高的dNTPs浓度会抑制文昌锥的SCoT-PCR反应。所以选择0.05~0.30 mmol·L-1范围为正交试验设计的dNTPs适宜浓度范围。
2.1.4 Taq DNA聚合酶用量对SCoT-PCR的影响
由图2可知(泳道11~20),当Taq DNA聚合酶浓度低于0.5 U,Taq DNA聚合酶活性低,导致SCoT-PCR反应不完全,泳道11-12没有扩增产物;随着酶用量的增加,扩增条带逐渐增多并清晰,尤其是Taq DNA聚合酶浓度在0.75~2.00 U(图2:泳道14~17)时扩增效果最好;当高于2 U时,开始出现拖尾现象。因此,选择Taq DNA聚合酶0.75~2.00 U范围用于正交试验设计。
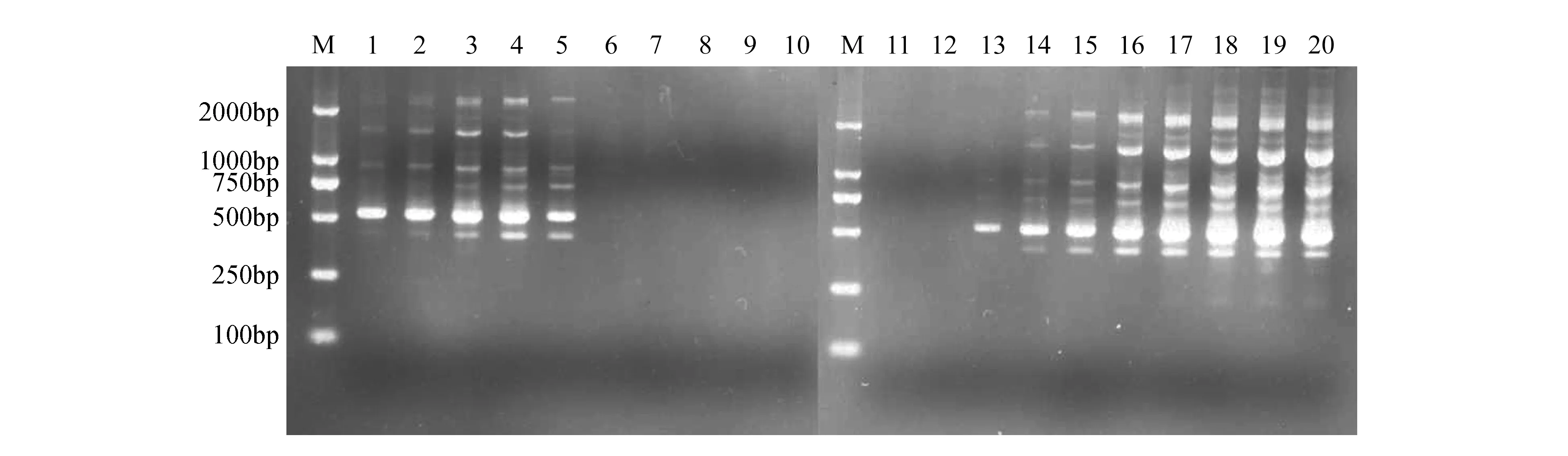
图2 dNTPs浓度和Taq DNA聚合酶浓度对SCoT-PCR反应体系的影响Fig.2 Effect of dNTPs concentration and Taq DNA polymerase on SCoT-PCR reaction system M. 100 bp DNA marker; 1-10. 0.025,0.05l,0.1,0.2,0.3,0.4,0.5,0.6,0.8,1.0 mmol·L-1 (dNTP); 11-20. 0.05,0.25,0.5,0.75,1,1.5,2.0,3.0,4.0,5.0 U(Taq)
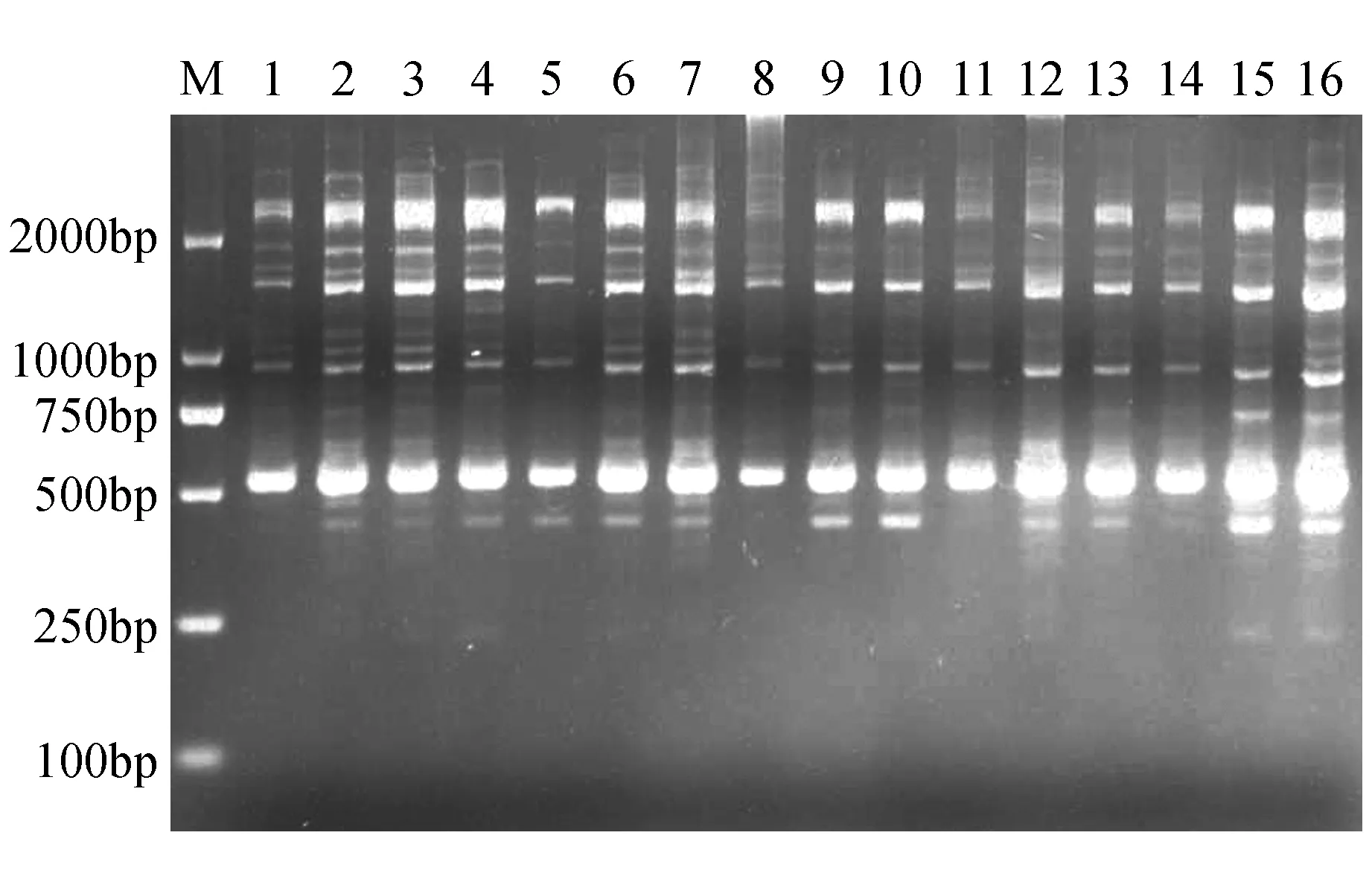
图3 不同正交试验组合的扩增结果 M. 100 bp DNA marker;1~16. 16个处理,编号与表2一致Fig.3 Orthogonal test combination M. 100 bp DNA marker; 1-16. 16 processing,the number is consistent with Table 2.
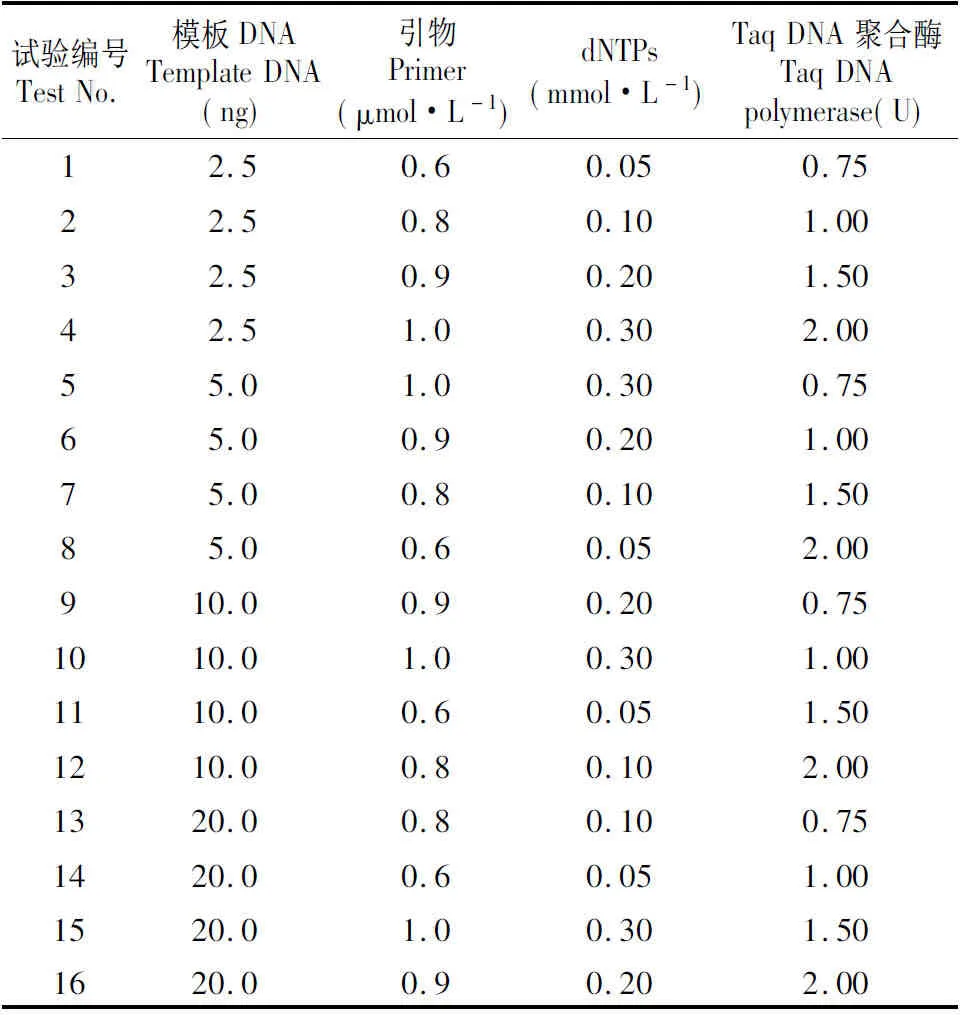
表3 SCoT-PCR正交试验设计表
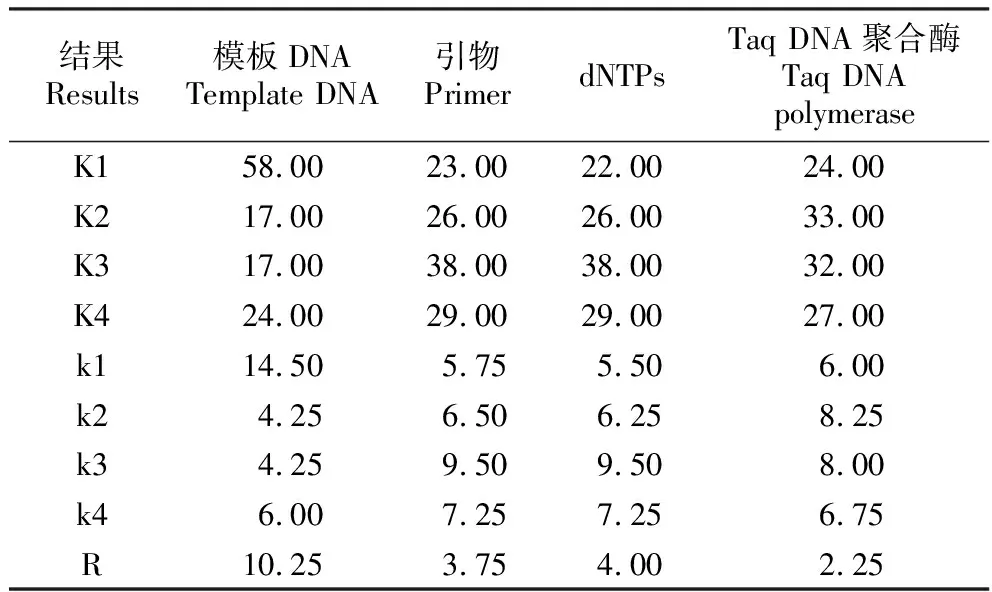
表4 正交设计结果直观分析
注:K表示某影响因素在不同水平下的分数;k表示某影响因素在不同水平下的分数平均数;1~4表示某影响因素由低到高的4个水平;R表示极差,某影响因素在各个水平分分数平均数的最大值与最小值之差。
Note:K represents the score of a certain influencing factor at different levels; k represents the average of the scores of a certain influencing factor at different levels; 1-4 represent the four levels of a certain influencing factor from low to high; R is the difference between the maximum and minimum values of the average of the scores of each of the influencing factors at each level.
2.2 正交试验设计与分析
在上述单因素实验基础上,基于适宜的DNA用量、引物浓度、dNTPs浓度和Taq DNA聚合酶用量,设计文昌锥SCoT-PCR L16正交试验表(表3)。从扩增的结果(图3)看,16个组合均能扩增出产物,组合1,2,3,4,7扩增的条带较多且清晰,组合8扩增的条带少且弥散。
依据条带多少、强弱和清晰度给16个组合的扩增结果进行打分,分数依次为13,16,15,14,3,10,13,1,4,4,6,3,4,3,4,3,8,9。组合2的分数最高,为最佳组合,组合8分数最低,为最差组合。因此,组合2是文昌锥SCoT的最佳反应组合,即总体系为20 μL,DNA含量为2.5 ng,引物浓度为0.8 μmol·L-1,dNTPs浓度为0.2 mmol·L-1,Taq DNA聚合酶的含量1 U。
根据打分情况分别求出DNA、引物、dNTPs和Taq DNA聚合酶在同一水平下的K值及均值k。并求出同一影响因子在不同水平下平均值的极差R值(表4)。R值大小说明了每个因素对PCR扩增的影响程度,R值越大,影响越显著。DNA、引物、dNTPs和Taq DNA聚合酶的R值分别为10.25,3.75,4和2.25。可见适宜的DNA、引物、dNTPs和Taq DNA聚合酶浓度条件下,它们对文昌锥SCoT-PCR扩增结果影响大小为:DNA>dNTPs>引物>Taq DNA聚合酶。
2.3 有效引物筛选及稳定性检验
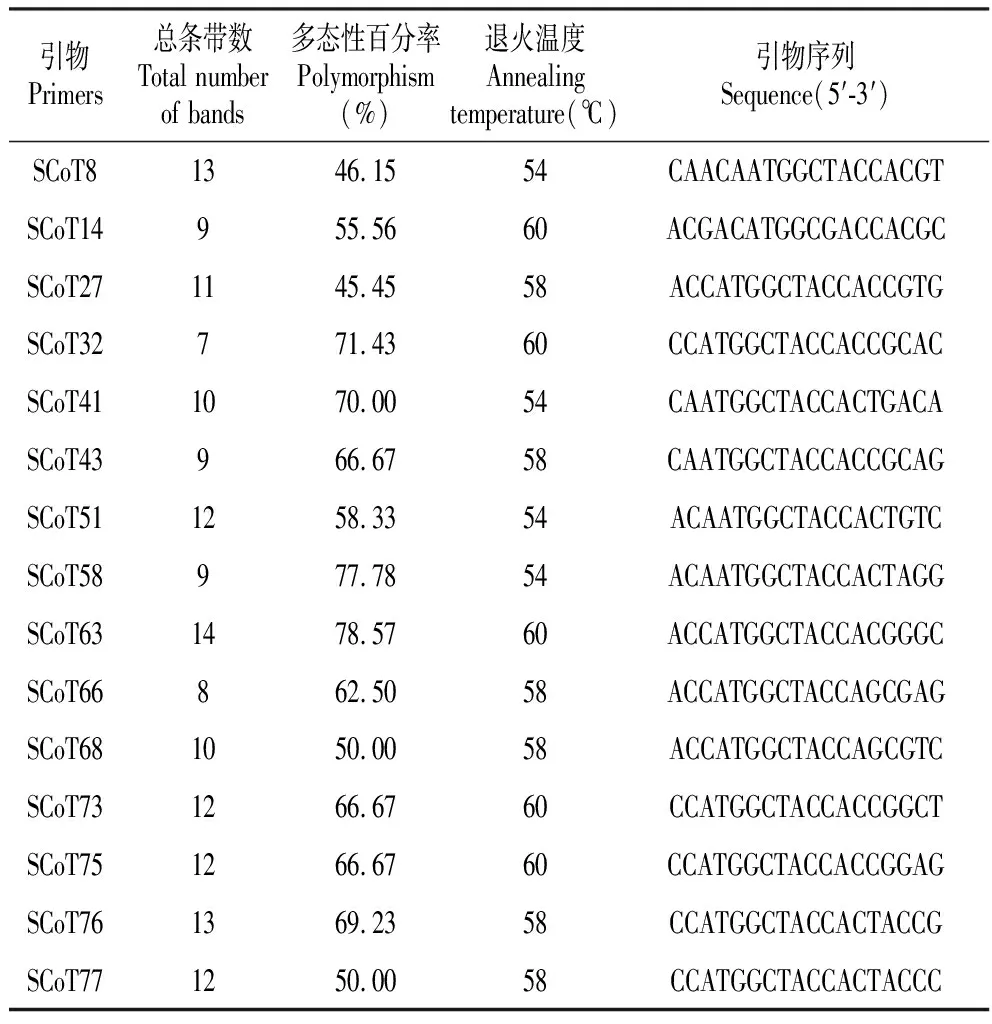
采用上述已优化的反应体系(组合2),以LFT-01基因组DNA为模板对全合成的80条引物进行初选,获得40条效果较好的初选引物(扩增获得3条以上产物)。以文昌锥LFT-01、BC-02、BC-20(地理距离相差较远)基因组DNA为模板,对40条初选引物进行评价与复选。经复选,获得15条适合文昌锥的SCoT多态性引物(图4,表5)。共有15条引物的扩增多态性百分率在45.45%~78.57%,扩增得到的条带个数在7~14条。其中SCoT63扩增条带最多(14条),多态性最好(78.57%)。从图4的扩增效果看,基于最佳反应体系,3份文昌锥均能扩增出清晰的条带且主带型稳定,分散性好、重复性高,说明该体系稳定可靠,适用于文昌锥SCoT分析。
表5 经过复选后获得的15条SCoT引物组合扩增信息分析及最佳退火温度
Table 5 Amplification information analysis and optimal annealing temperature of 15 SCotT primer combinations obtained after re-selection
引物Primers 总条带数Total number of bands多态性百分率Polymorphism(%)退火温度Annealing temperature(℃)引物序列Sequence(5′-3′)SCoT81346.1554CAACAATGGCTACCACGTSCoT14955.5660ACGACATGGCGACCACGCSCoT271145.4558ACCATGGCTACCACCGTGSCoT32771.4360CCATGGCTACCACCGCACSCoT411070.0054CAATGGCTACCACTGACASCoT43966.6758CAATGGCTACCACCGCAGSCoT511258.3354ACAATGGCTACCACTGTCSCoT58977.7854ACAATGGCTACCACTAGGSCoT631478.5760ACCATGGCTACCACGGGCSCoT66862.5058ACCATGGCTACCAGCGAGSCoT681050.0058ACCATGGCTACCAGCGTCSCoT731266.6760CCATGGCTACCACCGGCTSCoT751266.6760CCATGGCTACCACCGGAGSCoT761369.2358CCATGGCTACCACTACCGSCoT771250.0058CCATGGCTACCACTACCC
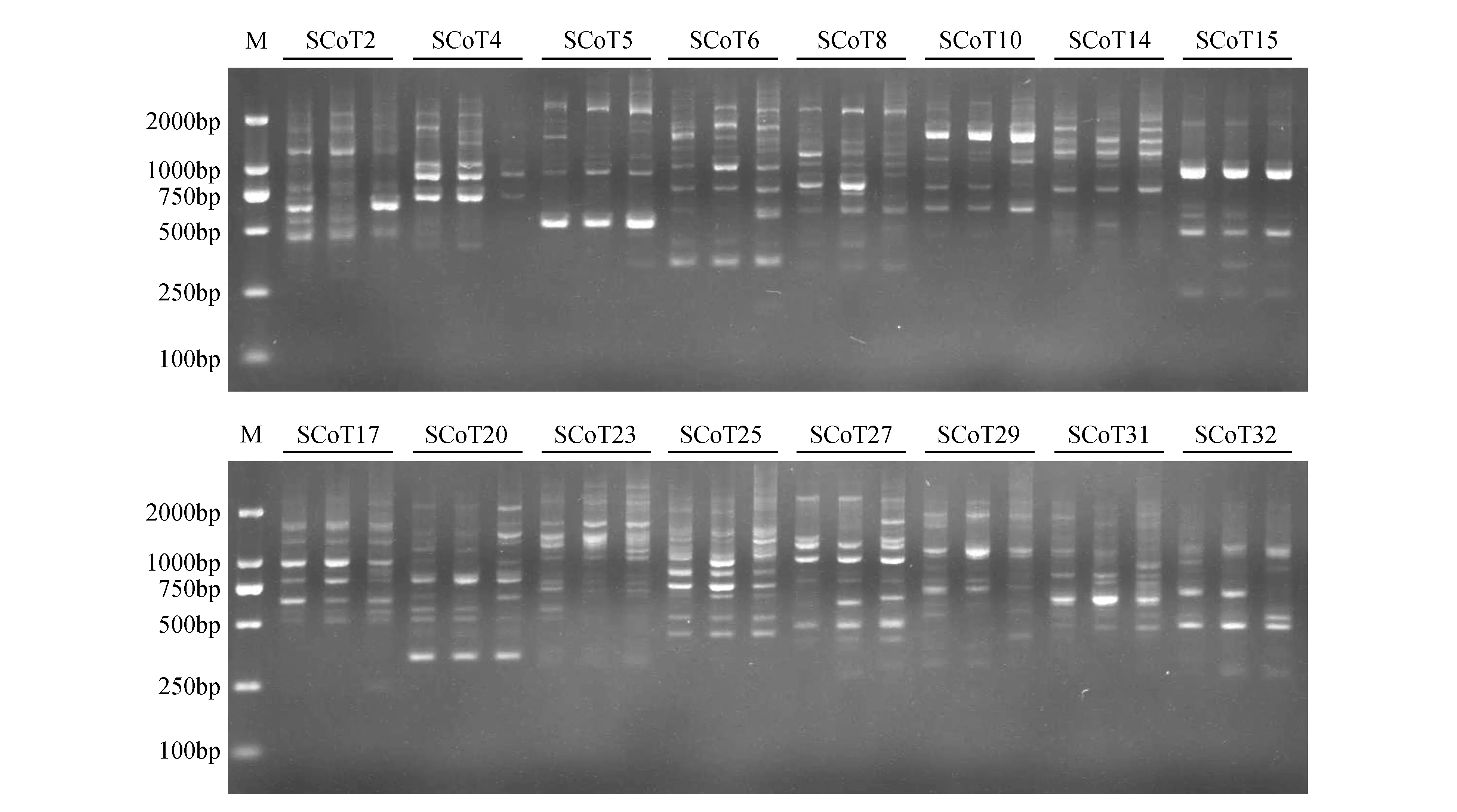
图4 经过复选后获得的40条SCoT引物扩增结果Fig.4 Amplification results of 40 SCoT primers after re-selection
3 讨论
SCoT基于PCR反应的新型目的基因分子标记技术,虽然有操作方便,成本低,多态性高,遗传信息丰富等优点,但PCR反应是一种复杂的反应体系,受到时间、温度、循环数和体系中各试剂浓度的影响[6]。所以建立文昌锥的SCoT-PCR最优体系尤其重要。
虽然SCoT分析已经在多个物种上广泛应用,但不同物种SCoT-PCR反应体系的主要影响因素不同。对于南瓜和辣椒而言,引物浓度是对SCoT-PCR扩增效果影响最主要的因素[20];对于梨和木薯而言,dNTPs浓度是对SCoT-PCR扩增效果影响最主要的因素[21];药用菊花和葛根[22]以Taq DNA聚合酶为SCoT-PCR扩增的最主要影响因素。本研究通过正交试验直观分析表明:各因素对文昌锥SCoT-PCR反应体系影响程度大小依次为:DNA>dNTPs>引物>Taq DNA聚合酶。但在其他植物中还未发现DNA浓度是影响SCoT-PCR体系扩增效果的最主要因素。在白檀[23]和光萼荷属植物[24]的SRAP分析中也发现DNA浓度是影响扩增效果的最主要因素,与本研究结果一致。通过单因素试验表明:模板DNA浓度对SCoT-PCR扩增影响显著,本实验中DNA模板浓度越高,扩增条带越少产量越低,可能是文昌锥叶片细胞内含有Taq DNA聚合酶反应效率的抑制性物质较多引起。因此,在对包括文昌锥在内的诸多壳斗科植物进行PCR扩增时,需要注意其叶片的DNA溶液中可能含有的Taq DNA聚合酶反应效率抑制性物质。
通过单因素试验和正交试验,本研究获得文昌锥SCoT-PCR的最佳反应体系,即总体系为20 μL,模板DNA含量为2.5 ng,引物浓度为0.8 μmol·L-1,dNTPs浓度为0.2 mmol·L-1,Taq DNA聚合酶的含量1 U。经验证,该体系的稳定性好,可靠性高。基于该体系,本研究从80条SCoT引物中筛选出15条多态性在45.45%~78.57%、扩增条带在7~14条且清晰度高的有效引物。文昌锥SCoT-PCR反应体系的建立和获得的有效引物,为海南特有极小种群植物文昌锥的资源评价鉴定、保护遗传学等方面的研究奠定了较好的基础。

