乙酸异丁酯与甲醇酯交换反应动力学
王 坤
(湖南中创化工股份公司,湖南 岳阳 414000)
异丁醇是一种重要的基础化工原料,可用作有机合成的原料,用于制造石油添加剂,抗氧剂、2、6-二叔丁基对甲酚增塑剂、合成橡胶、人造麝香和合成药物等,还可作为高级溶剂、萃取剂等。其酯类衍生物如醋酸异丁酯、丁酸异丁酯、乳酸异丁酯等在涂料行业中可作为溶剂使用。异丁醇还被广泛用作硝酸纤维素漆的助溶剂,以增加其光泽和流动性,并防止其褪色[1]。乙酸甲酯在工业上主要用于医药、涂料、胶粘剂、油墨、皮革生产过程中的溶剂,聚氨酯泡沫发泡剂、天那水等[2]。
目前,异丁醇主要来自于丙烯羰基化生产丁/辛醇装置副产的异丁醛加氢。丙烯羰基合成法制得正、异丁醛,加氢成正、异丁醇,该路线产物中有多种同分异构体,如正丁醛与异丁醛或者正丁醇与异丁醇,产物分离难度较大[3]。目前国内外研究较多的制备异丁醇的方法是以合成气为原料制备甲醇、异丁醇的工艺路线,但是CO加氢合成低碳醇的过程中会伴随生成CO2、烃类、酮类等副产物,目前该技术的难点是设计出高选择性、高活性的催化剂,目前的催化剂还不能满足工业生产的要求[3]。针对以上合成异丁醇的方法存在的问题,提出了以乙酸异丁酯和甲醇为原料,通过酯交换生产异丁醇,副产乙酸甲酯的方法。已有的文献报道均表明反应精馏技术可以有效地提高酯交换反应的转化率,为了提高产物的收率,主要是采用反应精馏的方法进行酯交换反应[4]。
目前的文献报道显示阳离子交换树脂作催化剂用于酯交换反应,反应效果较好,但是该动力学研究目前尚无人报道。本文对乙酸异丁酯与甲醇酯交换的反应动力学进行了研究,考察了反应温度,催化剂浓度,醇酯比等条件的影响,建立了反应动力学模型,为该反应的反应精馏塔的设计模拟、工艺优化等提供理论依据。
1 实验与方法
1.1 实验原料
乙酸异丁酯,分析纯,湖南汇虹化工试剂有限公司;甲醇,分析纯,湖南汇虹化工试剂有限公司;醋酸甲酯,分析纯,湖南汇虹化工试剂有限公司;异丁醇,分析纯,阿拉丁试剂有限公司;A-16阳离子交换树脂。
1.2 实验方法和步骤
实验室在间歇搅拌釜中进行,反应器为250mL三口烧瓶,中间采用机械搅拌控制转速,机械搅拌转速0~2000 r/ min,反应器的两侧分别装有温度计和取样口。实验温度采用恒温水浴控制,控制精度为±0.5℃[5]。
实验开始时开启恒温水浴槽,称取一定量的乙酸异丁酯和催化剂树脂,加入到三口烧瓶中,开启机械搅拌器,然后将甲醇放入到恒温水浴槽中预热,待二者都达到指定的温度后,将甲醇迅速加入到三口烧瓶中。以甲醇的加入时间为反应开始时间,此后每隔一定时间取样分析,当反应液内各组分浓度趋于不变时,表明反应达到平衡,停止实验[5]。
1.3 分析方法
采用岛津GC2010气相色谱仪进行样品定性定量分析,采用校正面积归一法进行定量。色谱操作条件:FID检测器;进样口温度:250℃,检测器温度:250℃,载气:N2,色谱柱型号 HP-FFAP,30m×0.25mm×0.25μm,起始柱温40℃保持3min,5℃/min升到100℃,再以15℃/min升至205℃。
2 实验结果和讨论
2.1 外扩散的影响
对于间歇搅拌釜式反应器,一般来说外扩散的影响随着搅拌速率的增大将逐渐减少直至可以忽略[6]。为确定适宜的搅拌速度,可采用不同的转速重复进行同一实验,若经过相同的反应时间,反应转化率不再随搅拌转速改变,说明外扩散的影响己基本消除[6]。催化剂粒径0.6~0.8 mm,其它工艺条件为温度75℃,醇酯物质的量比为2∶1,催化剂用量为乙酸异丁酯质量的12%,改变搅拌速度并计算不同搅拌速度下甲醇转化率,实验结果见图1。从图1可知,搅拌速率从400 r/min增至600 r/min时,甲醇的转化率增大;当搅拌速率从600 r/min增至800 r/min时,甲醇的转化率几乎无变化。说明当实验的搅拌速率大于600 r/min时,反应的外扩散影响可以忽略。
2.2 内扩散的影响
影响内扩散的因素中最显著的是催化剂颗粒的大小。筛选几种不同粒径范围的催化剂,分别用这几种不同粒径范围的催化剂在同等实验条件下进行实验,如果这几种粒径范围的催化剂的催化效果基本是相同,则可认为实验中所用粒径范围的树脂可以忽略其内部传质阻力[6],内扩散影响基本消除。在搅拌速率为600 r/min,反应温度 75℃,醇酯物质的量比为2∶1的条件下,催化剂用量为乙酸异丁酯质量的12%,考察不同粒径范围的催化剂对甲醇转化率的影响,从图2的结果中可知,不同粒径范围下的甲醇反应速率相差很小。说明当催化剂粒径小于0.8 mm时,反应的内扩散影响基本可忽略。

图1 转速对甲醇转化率的影响

图2 催化剂粒径对甲醇转化率的形响
2.3 温度的影响
温度是影响化学反应速率的一个最敏感的因素,一般来说,化学反应速率随温度的升高而增加[6]。在催化剂粒径0.6~0.8mm,搅拌速率600 r/min,催化剂用量为乙酸异丁酯质量的12%,醇酯物质的量比2∶1的条件下,考察反应温度对甲醇转化率的影响。由图3的实验结果可知,反应温度升高,反应速率加快,符合可逆吸热反应的规律。

图3 温度对甲醇转化率的影响
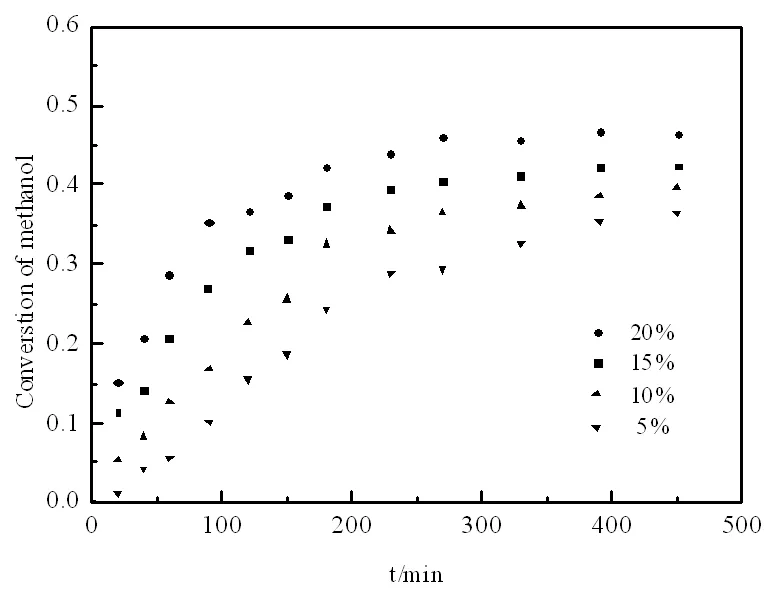
图4 催化剂用量对甲醇转化率的形响
2.4 催化剂用量的影响
在搅拌速率为600 r/min,醇酯物质的量比为2∶1、反应温度为72℃的条件下,考察实验中催化剂加入量对甲醇转化率的影响。
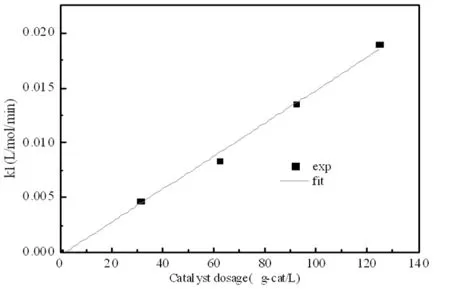
图5 催化剂质量分数对正反应速率的影响
从图4的结果中可知,反应速率随着催化剂量的增加而逐渐加快,达到平衡所需要的时间逐渐缩短。反应中的催化剂浓度影响阿伦尼乌斯方程中的指前因子A,从而影响反应速率常数k,为描述催化剂量与反应速率常数的关系,将催化剂浓度与正反应速率常数作图[6]。由图5可知:正反应速率常数与催化剂用量呈线性关系。 k1=1.5059×10-4mcat
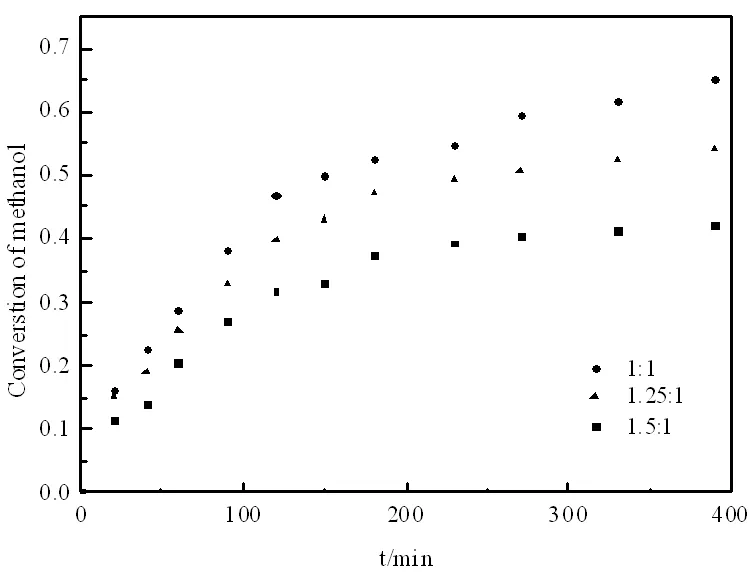
图6 醇酯物质的量比对甲醇转化率的影响
2.5 原料醇酯物质的量比的影响
在其它条件为搅拌速率为600 r/min,反应温度75℃,催化剂用量为乙酸异丁酯质量的12%,考察原料醇酯物质的量比对甲醇转化率的影响。从图6中可知:甲醇的平衡转化率随着醇酯物质的量比的减小而逐渐提高。
3 动力学模型
3.1 动力学反应级数
以A-16阳离子交换树脂为催化剂的该酯交换反应为液固非均相催化反应,包括反应物从液相主体扩散到催化剂外表面,再沿外表面扩散到内表面,在催化剂内表面上吸附并反应,反应产物从内表面上脱附并扩散到外表面,再由外表面扩散到液相主体[6]。在忽略内、外扩散影响的前提下,实际反应过程仅受吸附、表面反应和脱附的控制[7]。该反应是可逆反应,正反应为甲醇和乙酸异丁酯反应生成异丁醇和乙酸甲酯,逆反应则相反。
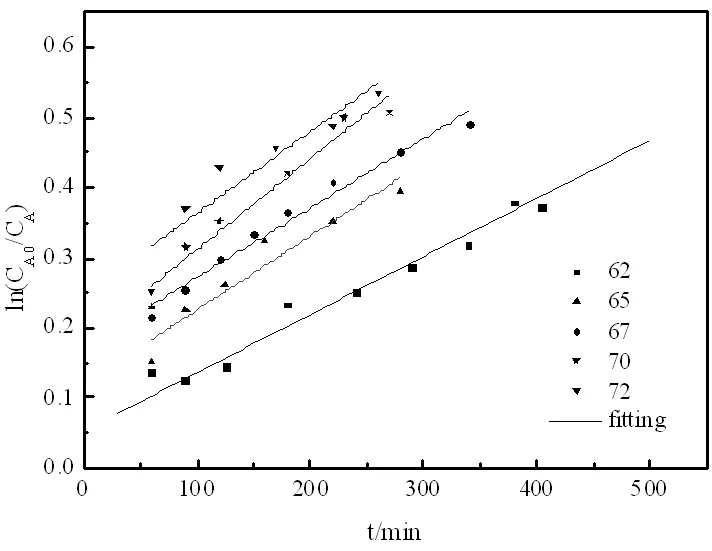
图7 甲醇的图

逆反应级数的确定,等物质的量的乙酸甲酯与异丁醇在75℃条件下实验,计算得到数据作图如图9。
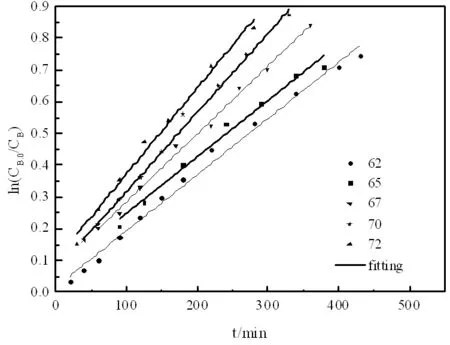
图8 乙酸异丁酯的图
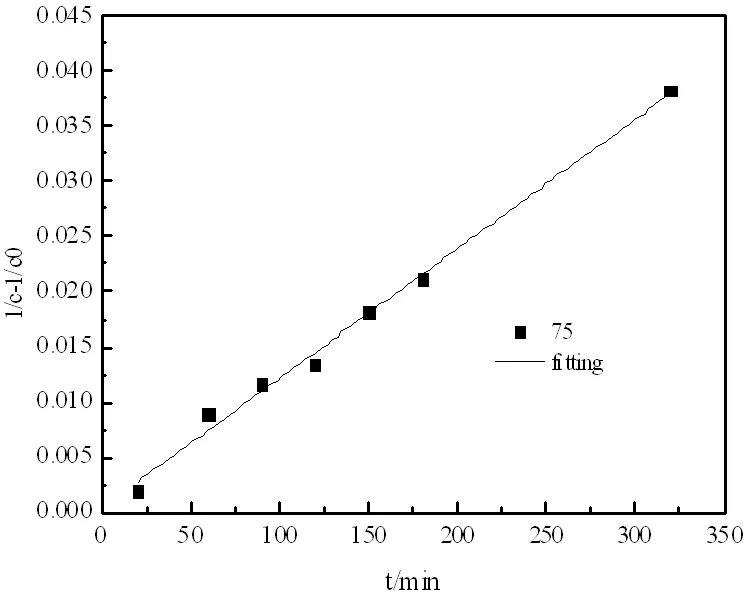
图9 逆反应的图
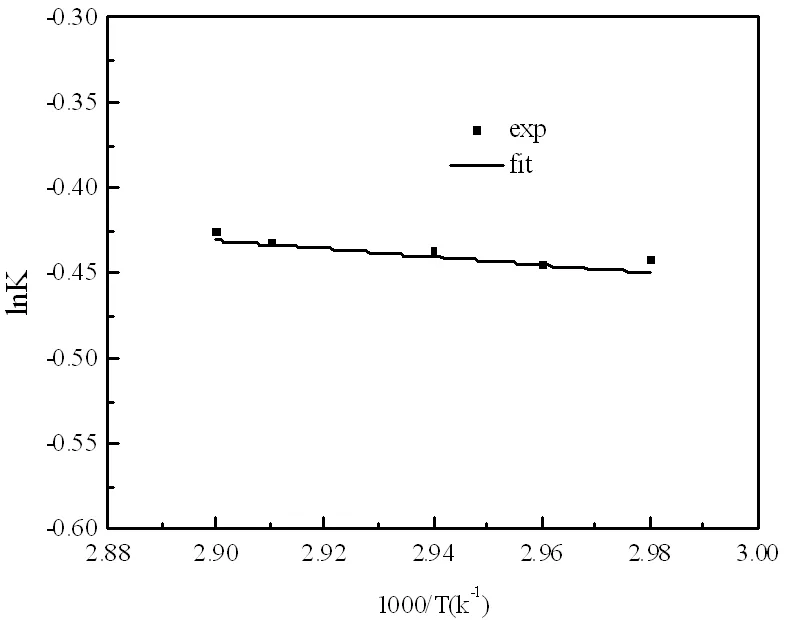
图10 反应平衡常数与温度的关系图
3.2 动力学方程的计算
从以上动力学反应级数的分析可知:该酯交换反应为可逆二级反应。因此,乙酸异丁酯与甲醇酯交换的反应速率可以用拟均相模型描述为:
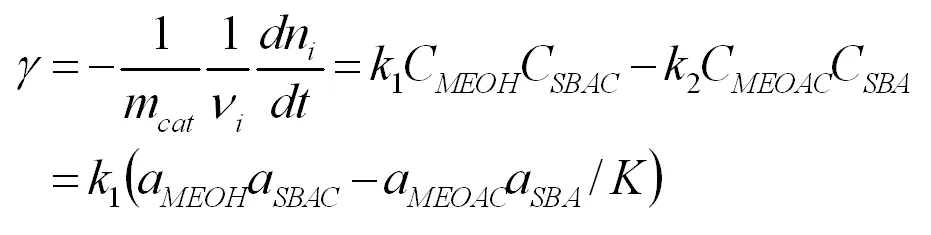
其中K为反应平衡常数,反应平衡常数可以由混合物的反应平衡组成得到。
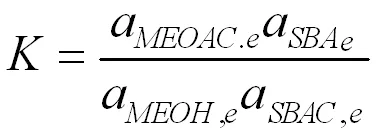

通过计算得到各温度下的反应速率常数k,根据阿伦尼乌斯方程,对lnk与1/T进行线性回归,见图11。

图11 反应速率与温度的关系
正逆反应速率常数k1和kz的值可用阿伦尼乌斯方程描述如下,它是温度和催化剂用量的函数:

通过计算得到正逆反应均为二级反应,通过计算得到正逆反应的指前因子和活化能见下表:

反应iAi/(L/mol/min/g-cat)Ea,i/(J/mol)正反应12.78×10462276逆反应-12.23×10459956
得到该酯交换的动力学方程为:
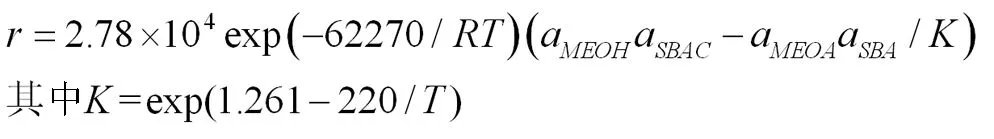
4 结论
本文研究了以阳离子交换树脂作为催化剂,乙酸异丁酯与甲醇酯交换反应的动力学,得到如下结论:
(1)乙酸异丁酯与甲醇的酯交换反应,正逆反应均为二级反应, 正逆反应的活化能分别为 Ea1+=42.276 kJ/mol 和 Ea1=39.956 kJ/ mol。
(2)反应平衡常数与温度的方程为 ,反应平衡常数随温度的升高逐渐增大,该反应为吸热反应。
(3)乙酸异丁酯与甲醇酯交换的动力学方程为:

