陆地棉开花时间相关基因GhMYB44的克隆与功能验证
段怡红,阎媛媛,陈丽婷,李青,张冬梅,孙正文,张艳,马峙英,王省芬
(河北农业大学农学院, 华北作物改良与调控国家重点实验室, 河北省棉花产业协同创新中心,河北 保定 071001)
我国人多地少,提高复种指数和土地利用率始终是农业生产的主题之一。短季棉是适合中国一年两熟和多熟制种植的棉花类型。我国以金字棉为基础,通过近百年的育种,成功培育了一系列适宜黄河流域和长江流域一年两熟乃至多熟的短季棉品种,以及适宜内陆棉区耐迟播早熟的短季棉品种。此外,短季棉株型紧凑、植株偏矮、叶量少的特点符合我国目前棉花产业机械化、轻简化发展的需求,短季棉已成为棉花育种的基本需求之一。然而,我国短季棉种质资源狭窄,制约着短季棉育种的快速发展,利用分子育种的优势,挖掘棉花开花时间调控基因,有助于短季棉的遗传改良[1-4]。
MYB转录因子是植物中最大转录因子家族之一,其结构上都有一段保守的DNA结合区,即MYB结构域。在植物界,人们最早在玉米中发现了与色素合成有关的ZmMYBC1[5]。随着基因组学和分子生物学的发展,越来越多的MYB家族成员被鉴定。植物中存在大量的MYB转录因子,具有多重生物学功能,如维持光周期,调控细胞的形态和模式建成,参与抗逆、抗病等一系列生理生化过程。MYB转录因子在调控植物开花过程中也发挥关键的作用。研究发现,LHY和CCA1是拟南芥MYB家族中维持和重设生物钟的负反馈调控因子,生物钟昼夜节律根据LHY、CAA1和TOC1转录和翻译水平的变化而改变,三者相互作用,从而维持了拟南芥长日照促进开花、短日照抑制开花的典型特征[6-7]。Song等[8]也研究了拟南芥中LHY与ELF3基因之间的相互作用,发现ELF3突变体植株中LHY的转录本和蛋白表达减少,开花时间提前。MYR1和MYR2影响赤霉素合成,并在光强减弱时抑制开花[9]。EMF和FE均是在维管束组织特异表达的开花抑制子,通过调控FT响应光照和温度对开花时间的影响[10-11]。CPL3通过FT调控开花时间[12]。TaMYB72在长日照条件下显著促进水稻开花[13]。对金盏花花芽分化起始时转录组学和蛋白组学的研究也发现了MYB转录子[14]。上述研究表明,MYB转录因子是MADS基因外又一类重要的植物开花时间调控子。
棉花中已经发现500多个MYB基因[15],GhMYB7和GhMYB9在花及纤维中表达,并且调控纤维发育[16];GaMYB2在纤维中特异性表达,在叶片及纤维生长过程中都起作用[17];GhMYB109在纤维起始时期及伸长的纤维中特异性表达[18];GhMYB25在纤维伸长中也起着重要作用[19];GhMYB52在棉纤维次生壁加厚期优势表达,参与纤维次生壁加厚过程[20]。重金属胁迫可短暂抑制GbMYB5基因表达,PEG、脱落酸和赤霉酸诱导均可增强其表达[21];干旱、低温和高盐胁迫诱导GhMYB113基因表达[22];干旱胁迫诱导GaMYB2基因上调表达[23];GhRAX3响应干旱胁迫诱导,使棉花耐干旱胁迫能力下降[24]。目前,有关棉花MYB基因调控开花时间的报道甚少。
开花是植物由营养生长向生殖生长转变的关键时期,受温度、光周期等多种环境因子的调控,并在基因的调节作用下完成[25]。研究棉花开花时间相关基因的功能,探究其作用及调控机制,对于改良棉花生育期、产量、品质等方面具有重要作用[26]。本课题组前期首次完成了来自中国、美国、澳大利亚等主要植棉国419份陆地棉核心种质的基因组重测序。基于3 665 030个SNP的全基因组关联分析,发现位于D03染色体的一个MYB基因与开花时间显著关联[27]。本研究对该MYB基因进行了分析,发现棉花基因组中含有两个序列相似度高的基因序列,分别位于D03和A02染色体,进一步对该基因进行了克隆和功能研究,研究结果将为棉花早熟分子育种提供重要的基因资源和理论依据。
1 材料与方法
1.1 试验材料
棉花材料TM-1、哥伦比亚型拟南芥、本氏烟草均由本课题组保存。试验所用pMD18-T载体、大肠杆菌感受态DH5α购自北京天根生化科技有限公司;农杆菌感受态GV3103为自制,植物表达载体35spGreen由本实验室保存。
植物RNA提取试剂盒购自北京艾德莱生物科技公司,反转录试剂盒购自TaKaRa公司,荧光定量试剂盒购自US EVERBRIGHT©INC公司,2×PhantaTMMaster Mix购自南京诺唯赞生物科技公司,限制性内切酶购自赛默飞公司,2×TaqPCR Master Mix、琼脂糖凝胶回收试剂盒和质粒提取试剂盒均购自天根生物科技有限公司。引物合成与测序均由金唯智公司完成。
1.2 处理及取样方法
棉花种植于河北农业大学农学院温室,在植株生长到2片真叶(二叶期)时开始取样,到五叶期结束,每次选取长势均匀一致的植株最新生长出的一片真叶用于基因的实时定量表达试验和基因克隆。拟南芥种植于23 ℃植物培养室,16 h光照,8 h黑暗,在苗期进行取样,用于基因表达分析。所取材料立即投入液氮中冷冻,然后于-80 ℃冰箱保存备用。
1.3 基因克隆
从南京农业大学陆地棉基因组数据库(https://cottonfgd.org/)下载基因序列并设计引物(表1),以cDNA为模板进行扩增,扩增体系20 μL:模板1 μL,前后引物各1 μL,2×PhantaTMMaster Mix 10 μL,ddH2O 7 μL。扩增程序:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火45 s,72 ℃延伸1 min,32个循环;72 ℃延伸5 min,12 ℃保存。扩增产物于1.2%的琼脂糖凝胶进行电泳,将得到的目的条带用胶回收试剂盒回收后,与pMD18-T载体连接,然后转化大肠杆菌DH5α。挑取菌斑进行PCR检测,阳性克隆用于测序。保存测序正确的单克隆菌液以供后续试验使用。
1.4 生物信息学分析
利用Ex PASy网站上的Compute p I/Mw(http://web.expasy.org/compute_pi/)对目的基因编码蛋白的理化性质进行预测和分析,并用NCBI的CDD数据库( https://www.ncbi.nlm.nih.gov/Structure/cdd/ cdd.shtml)对其结构域进行预测。用SWISS-MODEL(https://swissmodel.expasy.org/interactive/Vh8qXc/models/)预测蛋白三级结构。从CottonFGD网站(https://cottonfgd.org/)搜索GhMYB44基因的同源序列,利用Mapchart软件绘制基因在染色体上的分布图,借助MEGA7.0进行系统进化树分析。
1.5 GhMYB44表达分析
采用cotton FGD网站(https://cottonfgd.org/)提供的转录组数据,分析GhMYB44a和GhMYB44b基因在棉花各组织部位及不同胁迫条件下的表达模式。
1.6 表达载体构建
以测序正确的阳性克隆质粒为模板,利用引物GhMYB44-F和GhMYB44-R(表1)进行PCR扩增(体系和程序同1.3方法),获得GhMYB44a和GhMYB44b基因片段,用限制性内切酶EcoRⅤ和BamHⅠ酶切目的基因片段、超表达载体35S pGreen和亚细胞定位载体35S pGreen-GFP,采用T4连接酶16 ℃过夜连接,将连接产物转化大肠杆菌DH5α,并送公司测序。将测序正确的重组表达载体转化农杆菌GV3101。
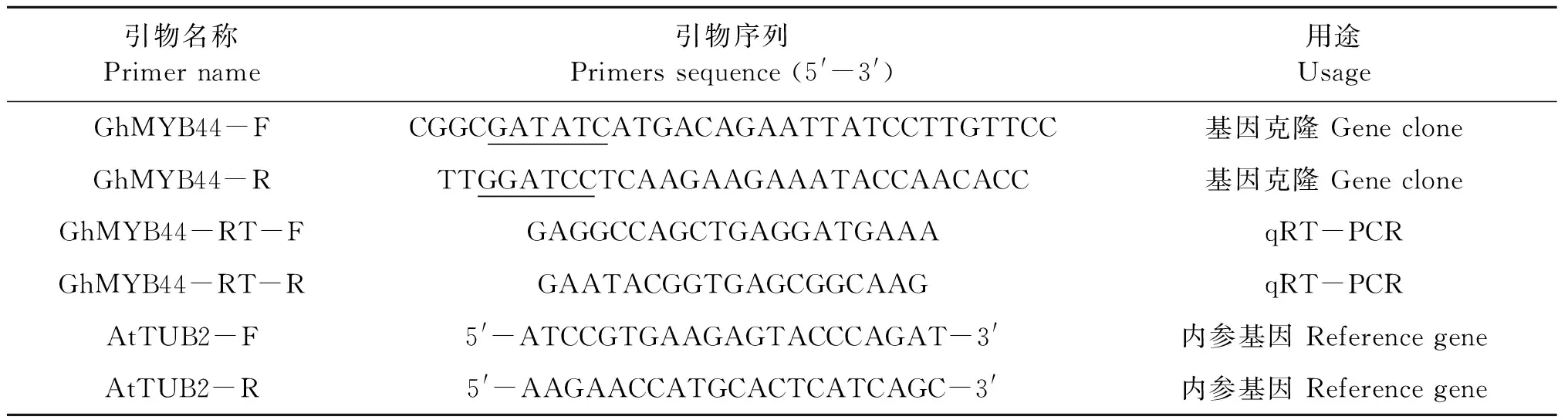
表1 本研究中所用引物序列Table 1 Primer sequences in this study
1.7 GhMYB44的亚细胞定位
构建目的基因与GFP的融合表达载体35S:GhMYB44a-GFP和35S:GhMYB44b-GFP,用电击法将重组质粒转化农杆菌感受态GV3101,28 ℃震荡培养,当OD600为1.0~1.2左右时,50 mL菌液收集菌体并重悬于50 mL缓冲液中,缓冲液包括:50 μL 乙酰丁香酮(200 μmol·L-1)、0.101 6 g MgCl2·6H2O、0.097 g 吗啉乙磺酸、1 mol·L-1NaOH 150 μL,用ddH2O定容至50 mL,室温放置3 h。本氏烟草种植于23 ℃植物培养室,16 h光照,8 h黑暗,选取长势良好,叶片肥厚的烟草植株,将静置的菌体悬浮液用1 mL的一次性注射器吸取出来,从烟草叶片下表皮慢慢注射,让菌液充满整个烟草叶片,黑暗避光48 h,撕取表皮细胞制片,在玻片上滴加DAPI染料,使用OLYMPUS激光共聚焦显微镜FV10I观察叶片中绿色荧光蛋白的表达情况。
1.8 拟南芥的遗传转化
构建植物超表达载体35S:GhMYB44a和35S:GhMYB44b,用电击法将重组质粒转化农杆菌感受态GV3101,并转化拟南芥[28]。转基因拟南芥后代种植于营养土,在植株生长至两片子叶平展后,叶面喷施除草剂Basta筛选阳性苗。待植株叶片稍大时,用CTAB法[29]提取拟南芥叶片基因组DNA,对目的基因进行PCR检测。待植株开花时,统计植株莲座叶数目,观察植株的生长状态。
1.9 转基因拟南芥目的基因表达分析
按照北京艾德莱RNA试剂盒说明书提取RNA,保证所得RNA的OD260/280为1.8~2.1,OD260/230大于1.8。使用TaKaRa RR047A和RR6110A试剂盒进行反转录。荧光定量使用SYBR Green分析法,所用试剂盒为Fast Super EvaGreen qPCR Master Mix,仪器为Applied Biosystems 7500实时定量PCR仪。PCR反应体系包括:2×Super EvaGreen Master Mix 5.0 μL,前后引物各0.5 μL,cDNA 模板1.0 μL,10×ROX reference dye(B) 0.1 μL,ddH2O 2.9 μL。PCR反应条件:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 5 s,72 ℃ 50 s,40个循环。以拟南芥At-TUB2为内参基因。每个样品进行3次试验重复,采用2-ΔΔCt法[30]分析试验数据。利用SPSS11.0软件处理数据,Graphpad Prism 7.00软件作图。
2 结果与分析
2.1 GhMYB44基因克隆及生物信息学分析
以棉花TM-1叶片的cDNA为模板进行扩增,得到1 000 bp左右的特异性条带,测序结果显示为两条基因序列,长度为987和984 bp,同源性达98%,蛋白序列相似度达95%(图1A)。两者的结构域非常保守,蛋白的差异性位于C端,但保守域与C端的相对位置不同,可能导致功能的差异。通过cottonFGD数据库(https://cottonfgd.org/blast/)比对发现,两个基因位于D03和A02染色体(图1C),分别命名为GhMYB44a和GhMYB44b。通过ExPASy网站预测,GhMYB44a编码蛋白的分子量为37.1 kD,等电点为8.93;GhMYB44b编码蛋白分子量为37.2 kD,等电点为9.15。进一步分析发现,GhMYB44a和GhMYB44b在A03和D02染色体上没有相似度很高的同源序列,只与A11和D11染色体上的两个基因有较高的同源性,说明本研究克隆的两条序列是不同的基因,且各自在基因组中都是单拷贝(图2)。

A: 氨基酸序列比对,红框所示为MYB区域;B: 蛋白三级结构;C: 两个基因在D03与A02染色体的位置。A: Alignment analysis of amino acid sequences, and red frames show MYB domains; B: 3D structure of protein; C: Chromosome location of the two genes in D03 and A02 chromosomes.图1 GhMYB44a和GhMYB44b的生物信息学分析Fig.1 Bioinformatic analysis of GhMYB44a and GhMYB44b

图2 GhMYB44a和GhMYB44b同源基因的系统进化树分析Fig.2 Phylogenetic analysis of GhMYB44a and GhMYB44b
2.2 GhMYB44a和GhMYB44b在烟草中的亚细胞定位分析
为确认GhMYB44在细胞中的位置,在烟草表皮细胞中进行瞬时表达,结果显示GhMYB44a和GhMYB44b蛋白均位于细胞核中,这与转录因子定位于核内的特征相一致(图3)。

图3 GhMYB44蛋白烟草亚细胞定位Fig.3 Subcellular localization of GhMYB44 protein in tobacco
2.3 GhMYB44在棉花不同组织及不同胁迫条件下的表达分析
利用Cotton FGD(https://cottonfgd.org/)中的转录组数据对两个基因进行分析发现,两个基因在不同组织中的表达呈现出差异,GhMYB44a在陆地棉的根、茎、叶、雌蕊中表达,GhMYB44b在茎、叶、花托、雌蕊中表达,但两个基因均在叶片中高表达(图4)。GhMYB44a和GhMYB44b均不响应冷热胁迫,但受PEG快速诱导,且在PEG处理12 h时表达量仍保持较高水平;在盐胁迫条件下,GhMYB44a不表达,而GhMYB44b在12 h时受诱导高表达(图5),由此推断,GhMYB44a比GhMYB44b对干旱胁迫可能更加敏感,而GhMYB44b参与盐胁迫反应。

图4 GhMYB44基因组织特异性表达分析Fig.4 Expression analysis of GhMYB44 in different tissues

图5 不同胁迫条件下GhMYB44的表达分析Fig.5 Expression difference analysis of GhMYB44 under different stresses
2.4 GhMYB44在棉花花芽分化时期的表达分析
花芽分化的起始标志着植物生殖生长的开始,一般发生于苗期。为了探究GhMYB44是否参与开花时间调控,本研究检测了棉花从两叶期到五叶期叶片中GhMYB44的表达变化。结果显示,GhMYB44在叶片中的表达量一直较高,在四叶期基因的表达量达到高峰,表明该基因可能是开花时间促进子。
2.5 GhMYB44基因的功能分析
通过喷施除草剂Basta初步筛选获得转基因拟南芥植株(图7),进一步对抗除草剂植株进行PCR检测,获得了转基因阳性植株,经后代筛选获得纯合株系。提取纯合株系阳性植株叶片RNA进行表达量分析,发现GhMYB44a和GhMYB44b在转基因株系中高表达,说明两个基因均被成功转入到拟南芥基因组中并表达(图7)。

图6 GhMYB44在棉花花芽分化不同时期叶片中的表达Fig.6 Relative expression of GhMYB44 in the cotton leaves of of different flower bud differentiation stages

图7 转基因拟南芥鉴定及目的基因表达分析Fig.7 Identification and expression analysis of transgenic Arabidopsis thaliana
将转基因纯合株系在23 ℃长日照条件下培养,发现转基因拟南芥比野生型提前抽薹且转基因拟南芥莲座叶数目显著少于野生型,早花现象显著。转GhMYB44a拟南芥抽薹时平均轮作叶片数为10.2,而转GhMYB44b拟南芥抽薹时平均叶片数为11.4,前者的早花现象更加明显(图8、图9)。且GhMYB44a表达量越高的植株,早花表型越明显,说明该基因对开花时间的促进作用具有数量特征,而GhMYB44b的表达量与开花时间基本没有关联。

注:**表示与野生型之间差异在 P<0.01水平具有统计学意义。Note: ** indicates significant difference compared with WT.图8 转GhMYB44a拟南芥表型鉴定Fig.8 Phenotypic identification for over-expressing GhMYB44a Arabidopsis

注:**表示与野生型之间差异在 P<0.01水平具有统计学意义。Note: ** indicates significant difference compared with WT.图9 转GhMYB44b拟南芥表型鉴定Fig.9 Phenotyping identification for over-expressing GhMYB44b Arabidopsis
3 讨论
植物叶片感知环境的变化,并在适宜的时候开花、产生后代,开花过程决定着生殖生长的成功与否,是植物发育过程中的重要阶段。随着地球人口的不断增长,高效利用有限的土地资源是科学家一直努力的方向。缩短作物生长周期,是解决土地问题的有效方法之一。克隆参与开花时间调控的基因并研究其功能对于改良作物熟性具有重要意义。MYB转录因子在植物中具有多重生物学功能,目前,有关棉花MYB基因的研究主要集中在纤维发育和抗逆过程[16-24],对其调控棉花开花时间的报道甚少。本研究从棉花基因组中克隆了两个序列高度相似的GhMYB44a和GhMYB44b基因,二者都能促进拟南芥早开花,但GhMYB44a的功能更强,这可能与蛋白结构在C端存在差异有关。绝大部分R2R3 MYB蛋白的C端都具有转录激活功能域特征,决定着蛋白的稳定性、与DNA结合的强度以及互作蛋白类型等[31-32]。此外,GhMYB44a和GhMYB44b基因不仅响应PEG胁迫,而且GhMYB44b还受盐胁迫的诱导,这与前人报道的植物在逆境条件下(如干旱、高盐、低温等)会提前开花结实[33]相一致。本研究首次报道MYB基因调控棉花开花时间,丰富了MYB基因的功能,加深了对棉花开花时间调控的认识。棉花基因组较大,含有500多个MYB基因,前人研究表明,MYB常以二聚体或多聚体形式发挥功能,因此挖掘GhMYB44a和GhMYB44b的互作蛋白及其调控的靶基因,对于深入了解MYB基因如何调控开花时间具有重要意义,也是今后研究的重点。

